高中化學/電離能
當我們研究元素週期表中的趨勢時,不能僅僅停留在原子大小上。在本節中,我們將開始理解一個重要的概念,即電離能,並認識它在元素週期表中的趨勢。
- 定義電離能。
- 描述元素週期表中電離能存在的趨勢。
- 描述元素失去一個電子時存在的離子尺寸趨勢。
鋰的電子構型為1s22s1。鋰在其最外層能級上有一個電子。為了去除這個電子,必須向系統中新增能量。請看下面的方程式
透過新增能量,可以透過失去一個電子從鋰原子形成鋰離子。這種能量被稱為電離能。電離能是從氣態原子或離子中去除最鬆散結合的電子所需的能量。“氣相”是指定的,因為在液體或固體中,會涉及其他能量。電離能的一般方程式如下。
電離能的值越高,去除該電子就越困難。當我們檢視第二週期元素的電離能時,我們可以看到一個趨勢。表10.7總結了第二週期元素的電子構型和電離能。
| 元素 | 電子構型 | 第一電離能IE1 |
|---|---|---|
| 鋰 (Li) | [He]2s1 | 520 kJ/mol |
| 鈹 (Be) | [He]2s2 | 899 kJ/mol |
| 硼 (B) | [He]2s22p1 | 801 kJ/mol |
| 碳 (C) | [He]2s22p2 | 1086 kJ/mol |
| 氮 (N) | [He]2s22p3 | 1400 kJ/mol |
| 氧 (O) | [He]2s22p4 | 1314 kJ/mol |
| 氟 (F) | [He]2s22p5 | 1680 kJ/mol |
當我們仔細觀察表10.7中提供的資料時,我們可以看到,當我們從左到右穿過週期時,一般來說,電離能會增加。在週期的開始,對於鹼金屬和鹼土金屬,失去一個或兩個電子可以讓這些原子變成離子。
隨著我們沿著週期表橫向移動,原子變得更小,導致原子核對價電子的吸引力更大。因此,電子更難以去除。
在同一族元素中也可以觀察到類似的趨勢。表 10.8 顯示了第一族(鹼金屬)中一些元素的電子構型和第一電離能(IE1)。
| 元素 | 電子構型 | 第一電離能IE1 |
|---|---|---|
| 鋰 (Li) | [He]2s1 | 520 kJ/mol |
| 鈉 (Na) | [Ne]3s1 | 495.5 kJ/mol |
| 鉀 (K) | [Ar]4s1 | 418.7 kJ/mol |
比較鋰到鉀的電子構型,我們知道要被移除的電子離原子核更遠。我們知道這一點是因為n值更大,這意味著容納價電子的能級更大。因此,更容易去除最鬆散結合的電子,因為原子更大,遮蔽效應更強,這意味著原子核對鉀的外層電子 4s1 的控制力更小。
因此,鉀的IE1(418.7 kJ/mol)小於鋰的IE1(520 kJ/mol)。
如果要從原子中移除第二個電子,則一般方程式如下:
由於在移除第二個電子時正負電荷不平衡,因此第二次電離所需的能量(IE2)將大於第一次電離所需的能量(IE1)。簡單來說,IE1 < IE2 < IE3 < IE4。
因此,如果我們檢視元素週期表中的電離能趨勢,並將其新增到原子尺寸存在的趨勢中,我們可以在元素週期表圖表上顯示以下內容。

但是為什麼電離能沿週期表橫向移動時增加,沿週期表縱向移動時減少呢?這與兩個因素有關。一個因素是原子尺寸減小。第二個因素是有效核電荷增加。**有效核電荷**是指特定原子內特定電子所感受到的電荷。請記住,核電荷用於描述為什麼原子尺寸沿週期表橫向移動時減小。當我們再次查看錶 10.7 中的資料時,我們可以看到有效核電荷如何沿週期表橫向移動時增加。表 10.9 顯示了第二週期元素的有效核電荷以及電離能。
| 元素 | 電子 構型 |
質子 數目 |
內層 電子 |
數目 有效 |
核電荷 電離 |
|---|---|---|---|---|---|
| 鋰 (Li) | [He]2s1 | 3 | 2 | 1 | 520 kJ/mol |
| 鈹 (Be) | [He]2s2 | 4 | 2 | 2 | 899 kJ/mol |
| 硼 (B) | [He]2s22p1 | 5 | 2 | 3 | 801 kJ/mol |
| 碳 (C) | [He]2s22p2 | 6 | 2 | 4 | 1086 kJ/mol |
| 氮 (N) | [He]2s22p3 | 7 | 2 | 5 | 1400 kJ/mol |
| 氧 (O) | [He]2s22p4 | 8 | 2 | 6 | 1314 kJ/mol |
| 氟 (F) | [He]2s22p5 | 9 | 2 | 7 | 1680 kJ/mol |
遮蔽核電荷的電子是內層電子,或者在第二週期的情況下,是 1s2 電子。有效核電荷是原子核中總電荷(質子數)與遮蔽電子數之間的差值。請注意,隨著有效核電荷的增加,電離能也隨之增加。總的來說,電離能的一般趨勢如下所示。
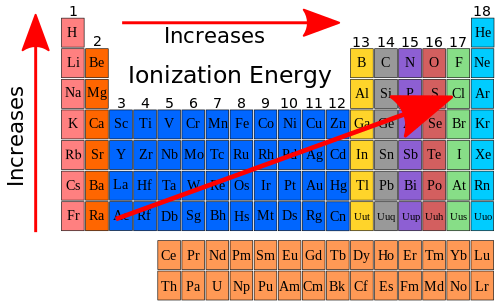
|
示例問題 氯的有效核電荷是多少?你預測它的電離能會高於還是低於氟? 解答: 氯的電子構型為 [Ne]3s23p5 有效核電荷為 7,與氟相同。僅憑這一點很難預測電離能。然而,氯的原子尺寸大於氟,因為現在有三個能級(氯位於第三週期)。現在我們可以說,氯的電離能應該低於氟,因為電子更容易從遠離原子核的能級上剝離。(事實上,氯的電離能為 1251 kJ/mol)。 |
電離能趨勢中存在一些異常現象。在一個週期內,電離能可能會受到電子構型的兩種方式的影響。當我們觀察第三週期時,我們可以看到從3s亞層到3p亞層時觀察到一個異常現象。下表顯示了第三週期主族元素的電子構型以及這些元素的第一電離能。
|
在表中我們看到,當我們將鎂與鋁進行比較時,第一IE降低而不是像我們預期的那樣增加。那麼為什麼會這樣呢?鎂的最外層電子位於s亞層。鋁原子最外層電子位於3p亞層。由於p電子的能量略高於s電子,因此從鋁中去除該電子所需的能量略少。另一個輕微的因素是3s2中的電子遮蔽了3p1中的電子。這兩個因素導致Al的IE1小於Mg的IE1。
當我們查看下錶時,我們可以看到氮的電離能似乎有些異常。
|
雖然氮有一個電子佔據第二亞層中三個p軌道的每一個,但氧有兩個軌道只被一個電子佔據,而一個軌道包含一對電子。這些2p電子所經歷的更大的電子-電子斥力使得去除其中一個電子所需的能量更少。因此,氧的IE1小於氮。
- 電離能是從氣態原子或離子中去除最鬆散結合的電子所需的能量。電離能通常沿週期遞增,沿族遞減。有效核電荷是價電子感受到的原子核電荷。
- 有效核電荷和原子尺寸有助於解釋電離能的趨勢。沿族向下,原子尺寸變大,電子更容易被去除,因此電離能降低。沿週期向右,有效核電荷增加,因此電子更難被去除,電離能增加。一旦一個電子被去除,第二個電子可以被去除,但IE1 < IE2。如果去除第三個電子,則IE1 < IE2 < IE3,依此類推。
- 定義電離能並展示一個電離方程式的例子。
- 繪製元素週期表的視覺表示,描述電離能的趨勢。
- 下列哪種元素的電離能最大?
- (a) Na
- (b) Al
- (c) H
- (d) He
- 下列哪種元素的電離能最小?
- (a) K
- (b) P
- (c) S
- (d) Ca
- 將下列元素按電離能遞增的順序排列:Na、O、Ca、Ne、K。
- 將下列元素按電離能遞減的順序排列:N、Si、S、Mg、He。
- 使用實驗資料,發現某元素的第一電離能為600 kJ/mol。發現形成的離子的第二電離能為1,800 kJ/mol。發現形成的離子的第三電離能為2,700 kJ/mol。發現形成的離子的第四電離能為11,600 kJ/mol。最後,發現第五電離能為15,000 kJ/mol。寫出本題中表示的資料的反應。該元素屬於哪一族?解釋。
- 利用電子構型和您對電離能的理解,您預測哪種元素的第二電離能更高:Na還是Mg?
- 比較鈣 (Ca) 和鎂 (Mg) 的第一電離能 (IE1),
- (a) Ca 的IE1較高,因為它的半徑較小。
- (b) Mg 的IE1較高,因為它的半徑較小。
- (c) Ca 的IE1較高,因為它的外層亞層已滿。
- (d) Mg 的IE1較高,因為它的外層亞層已滿。
- (e) 它們的IE1相同,因為它們具有相同數量的價電子。
- 比較鈹 (Be) 和硼 (B) 的第一電離能 (IE1)
- (a) Be 的IE1較高,因為它的半徑較小。
- (b) B 的IE1較高,因為它的半徑較小。
- (c) Be 的IE1較高,因為它的s亞層已滿。
- (d) B 的IE1較高,因為它的s亞層已滿。
- (e) 它們的IE1相同,因為B比Be多一個電子。
- 有效核電荷
- 原子或離子對最外層電子(價電子)的電荷。
- 電離能
- 從氣態原子或離子中去除一個電子所需的能量:能量 + J → J+ + e−(第一電離能)。
此材料改編自可在此處找到的原始 CK-12 書籍。此作品根據知識共享署名-相同方式共享 3.0 美國許可釋出









![{\displaystyle [{\text{He}}]+2s^{1}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ef0c3bd08060b641f187157e1f50ebddedd4525)
![{\displaystyle [{\text{He}}]+e^{-}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eea03da7708e973f2218af8fc0a9c7f23c226b03)
![{\displaystyle [{\text{Ne}}]+3s^{2}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/79706974a36cef696a78dc6c3ef8d64d4b2cd90b)
![{\displaystyle [{\text{Ne}}]+2e^{-}\,\!}](https://wikimedia.org/api/rest_v1/media/math/render/svg/25977b668258576b378bb0118a84e86ccf5fbb84)







