地質學家歷史地質學/化學

在本文中,我們將瞭解一些學習本教材或任何其他地質學入門教材所需的化學知識。
當然,化學是一個龐大而複雜的學科,本文不可能對其進行詳細介紹。我省略了所有不必要的資訊,以及可能被化學家認為是必不可少的資訊;為了簡化起見,我隨意犧牲了準確性,這在本書的主體部分是不可接受的。為了全面準確地瞭解化學,讀者需要閱讀專門的化學書籍;本附錄的目標是確保當本文中引入化學術語、符號和概念時,讀者不會覺得這些內容完全是外語。我沒有做更多嘗試。
其他一些不太基礎的化學資訊將在本教科書的各個條目中根據相關性進行介紹。
一個原子由質子、中子和電子組成。質子帶+1的電荷,中子不帶電,電子帶-1的電荷。原子中的質子數量等於電子數量,因此整個原子不帶電。原子中質子的數量被稱為原子序數,根據原子序數對原子進行分類,形成元素:例如,鈉元素包含所有原子序數為11的原子。
原子中的質子和中子聚集在一起,位於原子中心的原子核中。電子形成一個圍繞原子核的雲層。質子或中子的質量大約是電子的1836倍。這意味著原子的質量幾乎完全由它所含質子和中子的總和決定;這被稱為原子的原子量。
電子不會像蒼蠅圍繞果醬罐那樣隨機地在原子核周圍嗡嗡作響。相反,它們根據量子電動力學定律排列在原子核周圍。讀者可以在化學教科書中找到這些定律的討論;將量子理論引入地質學入門教材,是對還原論解釋的過度延伸。
相反,我們必須滿足於在量子力學被發現之前人們所接受的那種解釋,這種解釋至今仍被中學生所接受;這對我們的目的已經足夠了。
根據這種方案,電子以電子層的形式排列在原子核周圍。最內層的電子層可以容納兩個電子,第二層可以容納八個電子,第三層可以容納八個電子,第四層可以容納十八個電子,以此類推,遵循一個我們不得不留待解釋的模式,因為我們不會討論量子理論。電子從裡到外依次排列在這些電子層中,因此最內層的電子層必須填滿電子,才能有電子進入第二層;第二層必須填滿電子,才能有電子進入第三層;以此類推。
我們可以用比喻的方式說,當原子所有含有電子的電子層中,最外層的電子層都填滿了電子時,原子就“最快樂”。
這意味著原子可以透過分享它們最外層電子層中的電子來形成互惠互利的關係;這被稱為共價鍵。例如,考慮右側的圖,它顯示了兩個氧原子之間形成共價鍵的情況,其中原子核用紅色表示,電子用綠色表示。每個單獨的原子在最外層電子層中都有六個電子,但透過共享電子,它們在最外層電子層中各有八個電子。以這種方式結合在一起的兩個原子形成一個分子:在這種情況下,分子為O2(這種化學符號將在下面解釋)。
或者,原子可以形成離子鍵,其中一個原子直接將一個或多個電子傳遞給另一個原子,而不是共享電子。例如,一個鈉原子有 11 個電子,它更願意失去一個電子,剩下 8 個電子,這些電子就成了它的最外層電子層;而一個氯原子有 17 個電子,它更願意在最外層電子層中新增一個電子,使其填滿。如果鈉原子將它不需要的電子傳遞給氯原子,那麼它們都會滿足。
這樣一來,鈉原子就帶有一個+1的電荷,因為它比電子多一個質子,而氯原子比質子多一個電子,因此帶有一個-1的電荷。
元素的縮寫
每個元素都用一個大寫字母表示(例如,H 代表氫,K 代表鉀,W 代表鎢),或用一個大寫字母后跟一個小寫字母表示(例如,Cl 代表氯,Hg 代表汞,Na 代表鈉)。
化學式
我們可以使用這些縮寫來描述分子的組成:例如,上面描述的鈉和氯的組合可以寫成 NaCl。(按照慣例,Na 寫在前面,因為鈉帶正電荷。)
當一個分子中某一元素的原子數超過一個時,用元素符號右側的下標數字表示。例如,一個水分子包含兩個氫(H)原子和一個氧(O)原子,寫成 H2O;一個甲烷分子包含一個碳(C)原子和四個氫(H)原子,寫成 CH4。
化學反應
我們可以用化學式和一些額外的符號來表示化學反應,其中分子形成、分解和重新組合。例如,我們可以寫成
- Na + Cl → NaCl
表示箭頭左側的鈉和氯將結合起來,生成箭頭右側的 NaCl。
注意,箭頭兩側的元素相同,數量也相同;在化學反應中,原子既不會被創造,也不會被破壞,只有它們之間關係的性質發生了改變。
在描述化學反應時,另一個慣例是在原子或分子名稱前使用正常大小的數字,表示參與反應的原子或分子數量。例如,我們可以寫成
- 2HCl + Mg → MgCl2 + H2
這裡,正常大小的數字 2 表示左側有兩個 HCl 分子。注意,2 指的是它右側的整個公式 HCl,而不是它右側的 H。
為什麼我們不直接寫成 H2Cl2 而不是 2HCl?因為 H2Cl2 不是一個分子;我們有兩個 HCl 分子,符號反映了這一點。另一方面,我們寫右側的 H2 而不是 2H,因為 H2 是一個分子,寫成 2H 會不準確。
離子
如果一個原子或一個原子集合體失去了一個電子,就像在形成離子鍵時那樣,那麼它就會帶正電荷,被稱為帶正電荷的離子。我們可以用一個加號表示這一點,加號寫成元素符號右側的上標。如果它獲得了一個電子,它就會帶負電荷,被稱為負離子;我們可以用一個減號表示這一點,減號寫成元素符號右側的上標。
因此,例如,如果我們願意,我們可以將鈉和氯的組合寫成 Na+Cl-。
如果一個離子失去了或獲得了不止一個電子,那麼我們可以用一個數字表示這一點,數字寫成電荷符號前面的數字:例如,我們可以寫成 Ca2+,表示一個失去最外層電子層中兩個電子的鈣原子,因此帶有一個+2的電荷。
指示電離不是必須的。例如,沒有一個化學家會真正地費心去寫 Na+Cl-,因為任何化學家都知道,為了形成一個分子,鈉和氯必須以這種方式電離。但是,這種符號作為一種可選的表示方法還是很有用的。
化學名稱
還有一些慣例,可以為分子取一些合理的發音的名稱:例如,一個化學家看到公式 CaSO4 就會知道它叫做硫酸鈣。對於我們的目的來說,沒有必要解釋這個系統的細節:在本教科書的各條目中,我只是在化學式旁邊給出了化學名稱。
如果兩種元素在最外層電子層中的情況相似,那麼在化學上,它們的行為會非常相似。例如,鈉和鉀在最外層電子層中都只有一個電子。這意味著,就像一個鈉原子可以與一個氯原子結合形成 NaCl 一樣,一個鉀原子也可以與一個氯原子結合形成 KCl。
類似地,氟 (F) 與氯處於相同狀態:它們的外層電子殼層都缺失一個電子。這意味著氟會像氯一樣與鈉或鉀結合,分別形成 NaF 或 KF。
有關元素的資訊可以透過將元素排列在元素週期表中來總結,如下所示。
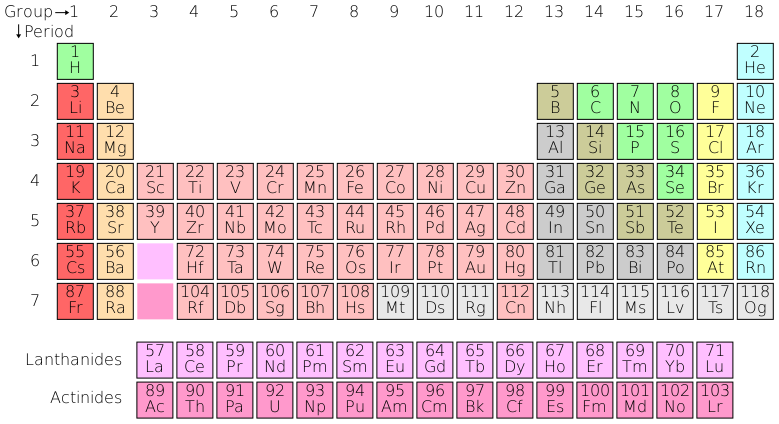
同一列中的元素被稱為屬於同一族,它們的外層電子殼層結構相似。例如,最左側一列中的元素在外層電子殼層中只有一個電子,它們渴望放棄這個電子;而最右側一列中的元素外層電子殼層都已填滿,因此不會形成化學鍵,因為它們已經非常穩定。
元素週期表中總結的事實對於我們理解地質學各個方面至關重要;例如,在我們討論古氣候學時,我們將利用鎂和鍶可以代替鈣這一事實;在討論 U-Pb 年代測定法時,重要的是要知道鈾可以在公式 ZrSiO4 中代替鋯,但鉛卻不能。
讀者會注意到,透過檢視元素週期表,在最後一個例子中,鈾 (U) 並不完全位於與鋯 (Zr) 相同的列中。然而,由於量子理論無法解釋的原因,表格中粉紅色元素之間存在更大的相互替代靈活性:因此鈾可以替代鋯,但例如鈣不能替代鈉,儘管它們在表格中的位置比鈾與鋯更接近。
如果一種物質(溶質)與另一種物質(溶劑)混合,以至於溶質獲得了溶劑的相態(即固態、液態或氣態,以及如果是固態則包括其晶體結構),則稱該物質溶解在另一種物質中。
例如,比較一下當我們在水中加入不溶於水的物質(例如沙子)和溶於水的物質(例如食鹽(NaCl))時會發生什麼。沙子仍然保持固態;我們所做的只是將固體與液體混合。此外,它不會均勻地分佈在水中,而是會沉到底部,因為它的密度大於水;如果它的密度小於水,它就會漂浮在上面。
相反,鹽會溶解在水中,因此我們得到的不是固態(鹽)在液態(水)中,而僅僅是液態,即鹹水;並且鹽會迅速地均勻地分佈在整個水中,而不是沉到底部。
鹽 (NaCl) 是一個由離子鍵結合的分子,正如我們上面提到的。然而,溶解在水中時,離子鍵也被溶解,因為帶正電的鈉被水中氧原子的負電荷吸引,而氯原子被氫原子的正電荷吸引。描述溶解的鹽為 NaCl 不準確,更準確的描述是 Na+ + Cl-;這是離子符號有用的一個場合。
由於原子的化學行為是由其電子間的相互作用決定的,因此決定原子化學性質的關鍵引數是其原子序數;它告訴我們原子有多少個電子,而電子的數量決定了它們在電子殼層中的排列方式。這就是為什麼對化學家來說,將原子根據其原子序數分類成元素是正確的方式。
但是,我們可以對原子進行更精細的區分:兩個具有相同電子數量(因此具有相同質子數量)的原子可以具有不同的中子數量,因此具有不同的原子量。例如,我們可以區分鈾-235(具有 143 箇中子、92 個質子、92 個電子,原子量為 235)和鈾-238(具有 146 箇中子、92 個質子、92 個電子,原子量為 238)。
用於表示同位素的符號是在元素符號的左側寫上原子量作為上標:例如,鈾-235 將寫成 235U。(一些文字還將原子序數作為元素符號左側的下標;在這本教科書中,我沒有遵循這種慣例。)
因為同一元素的兩種不同同位素仍然是同一元素,具有相同的電子排列,因此它們具有相同的化學性質。因此,正如同一族中的元素可以相互替代一樣,同一元素的兩種同位素在化學上可以相互替換。這一事實對地質學家特別有用,因為如果沒有它,許多放射性年代測定法將無法實現。
在這一點上,通常會解釋核衰變和放射性;然而,這本教科書在關於絕對年代測定的章節中有一篇專門討論這個主題的文章。歷史地質學/放射性衰變
