有機化學/芳香族
在理解不飽和化合物或共軛體系的用途後,我們希望探索芳香族化合物的獨特結構,包括為什麼苯不應該被稱為 1,3,5-環己三烯,因為它比典型的三烯更穩定,並且似乎不反應。最初被稱為“芳香族”是因為它的香味,芳香性現在指的是被認為是芳香族的化合物的穩定性,而不僅僅是苯。任何具有 4n+2 個 π 電子的環狀化合物都是芳香族的。芳香族化合物的穩定性來自於所有成鍵軌道都被填滿並且能量較低。
19 世紀初,裝置、技術和通訊方面的進步使化學家發現了新的化學化合物並對其進行了實驗。在他們的研究過程中,他們偶然發現了一種不同型別的穩定化合物,其分子式為 C6H6。由於無法想象這種化合物可能是什麼樣子,科學家們發明了各種碳碳鍵模型——其中許多模型並不完全穩定——以便將他們觀察到的結果與他們期望的 C6H6 化合物的樣子相匹配。
苯(這是賦予芳香族化合物 C6H6 的名稱)可能是當今使用最廣泛、工業上最重要的芳香族化合物。它是由邁克爾·法拉第於 1825 年發現的,大約 25 年後,它開始從煤焦油(以及後來從其他天然來源)中商業化生產。苯的結構出現在 19 世紀 60 年代,是幾位化學家貢獻的結果,最著名的是凱庫勒的貢獻。Kekulé。
當時的科學家沒有認識到電子能夠離域,因此所有碳原子都可以平等地共享相同的 π 鍵電子構型。Huckel 是第一個將新的量子力學理論應用於明確分離 σ 和 π 電子的化學家。他繼續發展了苯的 π 電子鍵合理論,這是第一個解釋芳香性電子起源的理論。
苯是一個六個碳原子組成的六邊形環,每個碳原子透過一個 p 軌道連線在一起。它的化學式為 C6H6,其結構是一個六邊形碳環,共享對稱鍵,所有六個氫原子從碳環向外突出,但與環位於同一平面上。p 軌道系統包含 6 個電子,其中一種電子分佈方式會產生以下結構
但是,苯的另一種共振形式是可能的,其中第一個結構的單鍵被雙鍵取代,雙鍵被單鍵取代。這兩種共振形式在苯中占主導地位。(其他形式,例如一個結構,其 π 鍵連線相對碳原子,是可能的,但可以忽略不計。)因此,苯中每個鍵的長度和強度在實驗上被證明是相等的,並且每個鍵都被認為大約是“1.5”鍵,而不是單獨的單鍵或雙鍵。
電子密度在碳原子之間共享,實際上既不是單鍵也不是雙鍵,而是在六個碳原子中的每一個之間形成一種“一又二分之一”鍵。苯在環結構形成的平面上下都具有負電荷密度。儘管苯非常穩定,並且不傾向於與大多數物質發生能量反應,但親電化合物可能會被這種區域性電子密度吸引,並且這些物質可能會與芳香苯環形成鍵。
可以使用電子離域環在一張圖中顯示苯的兩種主要共振形式
苯是一種無色、易燃的液體,具有甜味香氣和致癌作用。苯的芳香性質使其在許多方面與其他烯烴截然不同。
- 主條目: 芳香族反應
與烯烴不同,苯等芳香族化合物發生取代反應而不是加成反應。苯最常見的反應是親電芳香取代 (EAS),儘管在少數特殊情況下,取代苯可以發生親核芳香取代。
在體內,苯被代謝,苯暴露可能對健康產生相當嚴重的影響。吸入高濃度的苯會導致死亡,而較低濃度(但仍然很高)的苯會導致嗜睡、頭暈、心率加快、頭痛、震顫、意識混亂和昏迷。食用或飲用含有高濃度苯的食物會導致嘔吐、胃部刺激、頭暈、嗜睡、抽搐、心率加快,甚至死亡。
長期(長期)暴露於苯的主要影響是血液。苯會損傷骨髓,導致紅細胞減少,從而導致貧血。它還會導致過度出血並抑制免疫系統,增加感染的風險。一些吸入高濃度苯數月的女性出現了月經不規則和卵巢萎縮。目前尚不清楚苯暴露是否會影響孕婦的胎兒發育或男性的生育能力,但動物研究表明,當懷孕的動物吸入苯時,會導致出生體重低、骨骼形成延遲和骨髓損傷。
美國衛生與公眾服務部 (DHHS) 還將苯歸類為人類致癌物。長期暴露於空氣中高濃度苯會導致白血病,這是一種可能致命的血細胞生成器官癌症。特別是急性髓系白血病 (AML) 可能由苯引起。
有機化學中的芳香性並不指分子是否會觸發嗅覺器官的感官反應(是否“有氣味”,而是指環狀分子中電子鍵的排列。許多具有強烈氣味的分子(例如二原子氯 Cl2)在結構上不是芳香族——氣味與化學芳香性幾乎沒有關係。然而,許多最早發現的芳香族化合物具有明顯宜人的氣味。這一性質導致了這類化合物的“芳香族”一詞,因此,由於離域電子而具有增強穩定性的性質被稱為“芳香性”。
芳香性是指一個共軛環狀體系(體系中含有不飽和鍵,孤對電子或空軌道)所表現出的穩定性比僅靠共軛效應所產生的穩定性更強的化學性質。它也可以被視為環狀離域和共振的體現。
通常認為這是因為電子可以自由地在原子環狀排列中迴圈,這些原子交替地以單鍵和雙鍵的形式相互連線。這些鍵可以被視為單鍵和雙鍵的混合體,環中每一個鍵都與其他鍵相同。這種常見的芳香環模型是由凱庫勒提出的。苯的模型由兩種共振形式組成,對應於雙鍵和單鍵的位置互換。苯比理論上的環己三烯更穩定,環己三烯是一個理論上的分子。
按照慣例,雙箭頭表示兩種結構只是假設的,因為它們都不能說是對實際化合物的準確描述。實際分子最好用最可能結構的混合體(平均值)來表示,這些混合體被稱為共振形式。碳-碳雙鍵的長度比碳-碳單鍵短,但芳香族化合物在幾何上是完美的(即,不偏斜),因為所有碳-碳鍵的長度都相同。芳香族分子內部原子的實際距離介於單鍵和雙鍵的距離之間。
比路易斯結構圖更好的表示方法是環狀π鍵(阿姆斯特朗的內環),其中電子密度均勻分佈在環上方的π鍵和環下方的π鍵中。這種模型更準確地表示了芳香族分子總體結構內的電子密度位置。單鍵是由電子位於碳原子核之間“直線”位置形成的σ(σ)鍵。雙鍵由一個“直線”σ鍵和另一個非線性排列的鍵組成——π鍵。π鍵是由原子p軌道的重疊形成的,這些原子p軌道同時位於由“直線”σ鍵形成的環的平面上方和下方。
由於π軌道不在原子的平面上,因此它們可以自由地相互作用,從而變得離域化。這意味著每個電子不是與特定碳原子相連,而是可以與芳香環中的所有碳原子共享。因此,沒有足夠的電子在所有碳原子上形成雙鍵,但“額外”的電子平等地加強了環的所有鍵。
芳香族化合物包含一組具有特定特徵的共價鍵合原子
- 該分子必須是環狀的
- 離域化的共軛π體系,最常見的是交替的單鍵和雙鍵的排列(如果分子的幾何結構允許,有時可以包括三鍵)
- 共平面結構,所有參與原子都在同一平面上
- π離域電子的數量是偶數,但不是4的倍數。(這被稱為休克爾(4n+2)Π規則,其中n= 0,1,2,3等。π電子的允許數量包括2, 6, 10, 14等)
- 在有機反應中表現出特殊的反應性,例如親電芳香取代反應和親核芳香取代反應
雖然苯是芳香族的(6個電子,來自3個雙鍵),但環丁二烯不是,因為π離域電子的數量是4,它不滿足任何n整數的值。然而,環丁二烯化物(2−)離子是芳香族的(6個電子)。芳香體系中的原子可以有其他不屬於體系的電子,因此在4n + 2規則中被忽略。在呋喃中,氧原子是sp2雜化的。一個孤對電子在π體系中,另一個在環的平面上(類似於其他位置的C-H鍵)。有6個π電子,所以呋喃是芳香族的。
與類似的非芳香族分子相比,芳香族分子通常表現出增強的化學穩定性。芳香族分子中的迴圈(即離域的)π電子會產生顯著的區域性磁場,這些磁場可以透過核磁共振技術檢測。核磁共振實驗表明,芳香環上的質子比脂肪族碳上的質子發生明顯更強的去遮蔽效應。含有4nπ電子的平面單環分子稱為反芳香族,通常是不穩定的。能夠形成反芳香族的分子傾向於改變其電子或構象結構以避免這種情況,從而僅僅變得是非芳香族的。
芳香族分子能夠以所謂的π-π堆積方式相互作用:π體系形成兩個平行的環,以“面對面”的方式重疊。芳香族分子也能夠以“邊緣對面”的方式相互作用:一個分子環原子上取代基的輕微正電荷被另一個分子芳香體系的輕微負電荷吸引。
苯是一個非常重要的基本結構,在有機化學的大多數方面都用於分析和合成。苯環本身並不是分子中最有趣或最有用的特徵;哪些取代基以及它們在環上的位置可以被認為是苯化學中最關鍵的方面。
根據取代基的型別,原子或原子團可以使苯環變得更具反應性或更不具反應性。如果原子或基團使環變得更具反應性,則稱為活化;如果使環變得更不具反應性,則稱為失活。
通常,活化和失活的術語是指屬於親電芳香取代反應(EAS)類別的反應。這些是芳香環最常見的反應形式。然而,芳香環可以進行其他型別的反應,在親核芳香取代反應的情況下,環上取代基的活化和失活性質會反轉。在EAS中,羥基是強活化基團,但在親核芳香取代反應中,羥基是強失活基團。但由於EAS是芳香環最常見的反應,因此在討論活化和失活時,通常是在EAS的術語中進行的。
除了活化或失活之外,苯環上的所有基團和/或取代原子都是定位的。原子或基團可能會鼓勵額外的原子或基團新增到與定位基團相連的碳相關的其他特定碳上,或者不新增到這些特定碳上。這個概念將在下一章中進一步討論,但在記憶下面的基團時,同時記憶它們是O(鄰位)、M(間位)還是P(對位)定位的會很有幫助。
然而,另一個極大地影響方向的因素是空間位阻。例如,如果在環上有一個叔丁基取代基,儘管它是鄰位/對位定位基團,但叔丁基基團會很大程度地阻擋鄰位,因此幾乎所有產物都是對位產物。
活化取代基使苯變得略微更具反應性,或者變得非常更具反應性,具體取決於基團或原子。通常,如果主要雜原子(氮或氧)直接連線到碳環,那麼結果可能是活化。這只是一個經驗法則,存在許多例外,因此最好記住下面列出的基團,而不是依賴於快速而粗糙的經驗法則。
| 基團 | 強度 | 定位 |
| -NH2, -NHR, -NRR | 非常強 | 鄰位/對位 |
| -OH, -O- | 非常強 | 鄰位/對位 |
| -NHCOCH3, -NHCOR | 強 | 鄰位/對位 |
| -OCH3, -OR | 強 | 鄰位/對位 |
| -CH3, -C2H5, -R | 弱 | 鄰位/對位 |
| -C6H5 | 非常弱 | 鄰位/對位 |
失活基團是一種連線到苯分子上的官能團,它從苯環中去除電子密度,使得親電芳香取代反應比單獨在苯上進行的反應速度更慢,難度更大。如上所述,失活基團還可以決定取代發生的部位(相對於它們本身)在苯環上的位置,因此每個失活基團及其指向特徵列在下面。
| 基團 | 強度 | 定位 |
| -NR3+ | 非常強 | 間位 |
| -NO2 | 非常強 | 間位 |
| -CF3, CCl3 | 非常強 | 間位 |
| -CN | 強 | 間位 |
| -SO3H | 強 | 間位 |
| -CO2H, -CO2R | 強 | 間位 |
| -COH, -COR | 強 | 間位 |
| -F | 弱 | 鄰位/對位 |
| -Cl | 弱 | 鄰位/對位 |
| -Br | 弱 | 鄰位/對位 |
活化與失活以及鄰/對位與間位指向
[edit | edit source]那麼,為什麼有些取代基是活化或失活的?為什麼有些是間位指向,而另一些是鄰/對位指向?從上面的表格來看,它們之間似乎存在一定的關係。
取代基對環的影響主要有兩個方面,影響了這些特徵
- 共振效應
- 誘導效應
共振效應
[edit | edit source]讓我們先看一下共振效應。共振效應是指取代基向環提供電子或無法向環提供電子並增強其共振穩定性的能力。為了理解這一點,我們首先要了解親電芳香取代反應的機理。我們將在下一節中詳細討論EAS,但這裡需要了解一些基礎知識。

如上圖所示,親電試劑受到環中pi電子的攻擊。同一個碳原子現在與之前與它相連的氫原子和親電試劑都形成了鍵。這反過來在相鄰的碳原子上產生一個碳正離子,使得環失去芳香性。但芳香環喜歡保持芳香性。之前與親電試劑相連的親核試劑現在攻擊氫原子,從環中將其抽象出來,並使pi鍵重新形成,使環恢復其芳香性。
正如我們在其他一些反應中所見,當碳正離子作為中間體產生時,該碳正離子的穩定性對反應至關重要。親電芳香取代反應也是如此。
那麼,取代基對環的影響是什麼呢?
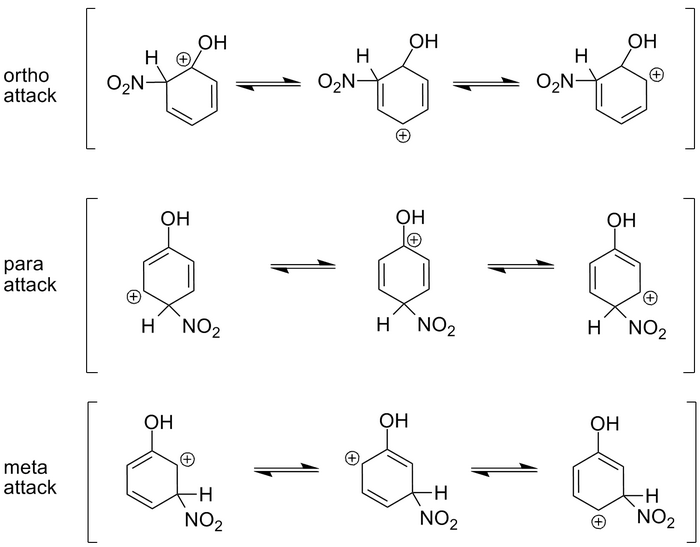
讓我們看一下上面的情況。在這種情況下,我們有苯酚,一個帶有連線的-OH(羥基)基團的苯環。當我們在硫酸中用硝酸對環進行硝化(我們在下一節中會討論的反應)時,一個硝基會連線到苯環上。
硝基有三個可能的連線位置:鄰位、間位或對位。為了理解碳正離子的穩定性,我們需要觀察特定攻擊的共振結構,並瞭解結果是什麼。
鄰位攻擊的第一個共振結構導致帶有羥基的碳原子帶上正電荷。這恰好是鄰位攻擊三個共振結構中最穩定的結構,因為氧原子中的兩個負電子對有助於穩定碳原子上的正電荷。另外兩個共振形式將正電荷留在與氫原子相連的碳原子上。氫原子無法穩定電荷,因此這些形式不太穩定。
在對位攻擊的情況下,請注意,第二個共振形式也使帶有羥基的碳原子帶上正電荷。這提供了穩定性,就像在鄰位攻擊的情況下一樣,因此中間共振形式非常穩定。
最後,在間位攻擊的情況下,所有共振形式都導致帶有氫原子的碳原子帶上正電荷。這些都不穩定,因此,帶有羥基連線的間位攻擊只佔產物的很小一部分。
因此,氧原子中的電子對有助於穩定鄰位和對位攻擊。
誘導效應
[edit | edit source]現在讓我們看一下失活取代基的誘導效應。假設我們沒有羥基,而是用羰基代替羥基連線到環上。當羰基連線時,環與一個碳原子相連,該碳原子又與一個氧原子形成雙鍵,雙鍵氧原子會吸引電子,這種誘導效應會傳遞到環上,強烈地失活其pi鍵性質,並在碳原子上產生一個正偶極。觀察共振結構,這個碳原子已經帶有一定的正性,現在又增加了正電荷的共振,在鄰位和對位攻擊的情況下。正加正等於更正,因此更不穩定。沒有負電荷或負電子對來穩定這個正電荷。
因此,在這種情況下,整個環不僅活性降低,而且鄰位和對位攻擊導致碳正離子共振形式更不穩定。因此,間位是優選的位置,但總體反應活性低於純苯。
鹵素的例外
[edit | edit source]請注意,在活化與失活取代基的列表中,活化取代基都是鄰/對位指向。在失活取代基中,除了鹵素之外,其餘都是間位指向。為什麼鹵素是例外?
因為鹵素比碳更具電負性,它們在連線的碳原子上誘導一個正偶極,在其自身原子(誘導效應)上誘導一個負偶極,根據之前關於活化/失活取代基的邏輯,鹵素會使環失活。然而,鹵素在外層電子殼層中也具有孤對電子,可以與環共享,允許由於間位攻擊共振形式很差而導致鄰/對位攻擊佔優勢的共振結構。本質上,儘管鹵素在一定程度上使環失活,但由於孤對電子的可用性,它們提供了主要的共振貢獻者。共振結構通常優於誘導效應。
取代基的詳細影響
[edit | edit source]我們已經討論了一些關於取代基影響的概論,甚至討論了一些關於特定取代基的具體內容,但讓我們更仔細地看一下取代基,並嘗試瞭解是什麼使它們活化或失活的細節。
-NH2、-NHR 和 -NRR 都是強活化基團。儘管氮原子比碳原子更具電負性,但它共享一對電子的能力遠遠超過其吸電子效應。
-OH 和 -O- 類似,它比氮原子更具電負性,但它有兩對電子可以共享,這也遠遠超過其吸電子效應。
-NHCOCH3 和 -NHCOR 也是強活化基團,但雙鍵氧原子的誘導效應會使氮原子更具吸電子性,因此它們不像上面提到的其他-N取代基那樣活化。
-OCH3 和 -OR 也仍然是強活化基團,但程度較低,因為電子密度在氧原子的兩側都被共享。
-CH3 和 -R 通常會提供一些電子密度共享,但遠不如一對電子。因此,它們的影響只會被微弱地感受到。
對於失活基團,我們有
-NO2 或硝基和 -NR3+。硝基由於其共振結構而具有很強的失活性。硝基有兩種共振形式:O=N+-O- 和 O--N+=O。這兩種形式都在氮原子上留下一個完整的正電荷,使其完全無法幫助穩定正碳正離子中間體。-NR3+ 也是如此。
-CF3 和 -CCl3 都有 3 個鹵素的誘導電負性效應,但沒有電子可以與環共享,因此它們也是強失活基團。
-CN 在碳原子和氮原子之間有一個三鍵,共振形式為碳原子和氮原子之間有一個雙鍵,碳原子帶上正電荷,這意味著氮原子的電負性和共振形式中帶正電荷的碳原子之間的作用會使碳正離子不穩定,並且不向環提供電子。
-SO3、-COR、-CO2R - 這些都具有電負性氧原子,使碳原子帶上正偏電荷,並且不提供電子以穩定環。
-F、-Cl、-Br 的作用類似。它們具有電負性,使環失活,但它們可以共享電子,在一定程度上彌補了這一點,允許鄰/對位指向。但要更好地理解它們的影響,你需要從它們在元素週期表上的位置來看。氟是最具電負性的元素,而且它很小,因此與它連線的碳原子非常接近。這使得它的電磁影響具有更強的失活特性。氯的電負性較低,但它也較大,因此與碳原子之間的距離更遠,使其難以共享電子。依此類推。
多取代苯
[edit | edit source]未取代的苯在自然界或實驗室中很少見,你會發現在你的研究中,苯環最常作為其他更復雜分子的組成部分。為了使苯在大多數情況下發生反應,它會根據連線的官能團而增加或減少一些功能。儘管最簡單的情況是處理只有一個官能團的苯,但瞭解連線到同一個苯環上的多個官能團之間的相互作用和競爭也至關重要。
當苯環上存在多個取代基時,基團之間的空間關係變得重要,這就是為什麼設計了 **鄰位 (ortho)**、**間位 (meta)** 和 **對位 (para)** 芳烴取代模式。例如,甲酚分子存在三種異構體,因為甲基和羥基可以相鄰放置 (鄰位),相隔一個位置 (間位) 或相隔兩個位置 (對位)。每個基團連線的位置通常取決於它們連線的順序,因為先前連線的基團的活化/失活和指向活性會影響後續基團的連線位置。
當環上有多個官能團時,這些基團的影響會疊加,需要考慮它們總體的效應。通常情況下,這些效應是累加的。例如,甲苯(甲基苯)是弱活化劑。但對硝基甲苯同時具有甲基和硝基。甲基是弱活化劑,而硝基則是強失活劑,因此總體而言,該基團是高度失活的。然而,在指向方面,這兩個取代基都指向同一個位置。甲基是鄰/對位指向。硝基佔據了對位,所以現在甲基只想要鄰位指向。硝基是間位指向。硝基的間位也與甲基的鄰位一致,所以這個效果會疊加,並且後續的取代基幾乎全部會位於甲基的鄰位。
如果兩個官能團在指向方面不一致,則活化性更強的基團控制指向方向。也就是說,如果你是間硝基甲苯,你的大多數產物會傾向於在甲苯的鄰/對位,而不是在硝基的間位,儘管硝基對整體活化有更強的影響。
當苯環上連線有多個取代基時,必須明確宣告所有未直接連線到碳原子 1 的基團的位置。這可以透過列出基團連線的碳原子編號,然後用連字元和基團名稱來實現。苯環的碳原子應根據先前確定的優先順序進行編號,即溴的優先順序高於硝基,硝基的優先順序又高於醇或烷烴基團。基團的名稱應按字母順序排列,例如“2-甲基-5-硝基苯甲醛”。
