有機化學/芳香反應
與含有多個共軛雙鍵的典型化合物相比,芳烴的反應性缺乏是值得注意的。例如,1,3,5-己三烯比己烷、己烯或任何己二烯的反應性都強得多。苯的反應性遠低於這些化合物中的任何一種。在稀釋的H2SO4水溶液存在下,任何烯烴都將很容易地轉化為醇,但苯卻呈惰性。類似地,烯烴很容易與鹵素和鹵化氫發生加成反應生成滷代烷烴,而鹵素與苯發生取代反應,且僅在催化劑存在下進行。KMnO4或重鉻酸溶液(通常為CrO3或K2Cr2O7)裂解烯烴的雙鍵,生成酮或羧酸,但與苯完全不反應。然而,由於芳香化合物的穩定性,涉及這些化合物的反應具有極高的活化能,因為進入過渡態必然需要破壞芳香體系,導致芳香穩定能的暫時損失。苯及其衍生物通常透過親電芳香取代反應而不是像非芳香化合物那樣透過加成和消除反應進行反應。
Birch還原反應[1]是指芳香化合物在液氨中用鈉還原的反應。它歸因於化學家Arthur Birch。反應產物為1,4-環己二烯。金屬也可以是鋰或鉀,氫原子由乙醇或叔丁醇等醇提供。

Birch還原反應的第一步是芳香環的一電子還原生成自由基陰離子。鈉被氧化為鈉離子Na+。該中間體能夠二聚生成二陰離子。在醇存在下,第二個中間體是自由基,它吸收另一個電子形成碳負離子。該碳負離子從醇中奪取一個質子形成環己二烯。
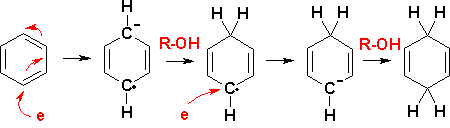
在滷代烷存在下,碳負離子還可以參與親核取代反應,形成碳-碳鍵。在取代芳烴中,吸電子取代基(如羧酸)穩定碳負離子,並生成取代最少的烯烴。對於供電子取代基,則發生相反的效果。非共軛的1,4-加成產物比共軛的1,3-二烯更受青睞,這可以用最小運動原理來解釋。也存在更易於處理的實驗性鹼金屬替代品,例如M-SG還原劑。
由於苯是非極性的,它不能透過尿液排出,並且會留在體內直到被氧化。苯本身對健康沒有危害,但為了排出體外,它會在肝臟中被細胞色素P-450氧化。這會產生苯氧化物,這是一種高度致畸和致癌的化合物。苯已被甲苯取代作為工業溶劑,因為甲苯可以被氧化為苯甲酸,苯甲酸對健康基本無害,並且很快就會排出體外。最近,蘇打水中苯甲酸分解成苯和二氧化碳的問題也成為一個問題。
親核取代反應是有機化學中的一種取代反應,其中親核試劑取代了良好的離去基團,例如芳香環上的鹵素。為了理解這種型別的反應,必須認識哪些化學基團是良好的離去基團,哪些不是。
離去基團可能最簡單地被描述為從有機分子上脫落的原子或分子。官能團離開的能力稱為不穩定性。離去基團影響整個分子的內在反應性,但僅在它們真正離開之前才會影響。
給定離去基團的共軛酸的pKa越低,該離去基團實際離開的能力就越強。這是因為這些基團可以很容易地穩定任何正在形成的負電荷,並且如果沒有穩定,離去基團實際上會變成親核試劑,導致反應在連線和分離形式之間毫無意義地迴圈。(這解釋了為什麼強鹼幾乎總是差的離去基團。)
在室溫水中,不穩定性的順序為
- 不穩定性較低
- 胺/醯胺 (NH2-)
- 烷氧基/醇負離子 (RO-)
- 羥基/氫氧根 (HO-)
- 羧酸根 (RCOO-)
- 氟/氟離子 (F-)
- 水 (H2O)
- 氯/氯離子 (Cl-)
- 溴/溴離子 (Br-)
- 碘/碘離子 (I-)
- 疊氮根 (N3-)
- 硫氰酸根 (SCN-)
- 硝基/亞硝酸根 (NO2)
- 氰基/氰離子 (CN-)
- 不穩定性較高
離去基團越好,親核反應發生的速率就越快。這可以透過滷代烷之間的動力學比較來證明,其中溴化物比氯化物更快地解離,但碘化物比其他兩者更快地解離。這是因為在發生親核取代反應時,必須在某個時刻斷開鹵素與其最近的碳之間的鍵。例如,由於碘的相對較大的尺寸和相對較多的可電離電子,碘和碳之間的鍵比碳和氯之間的鍵更容易極化。水是比氫氧根更好的離去基團這一事實還具有重要的結果,即氫氧根離開的反應速率會因酸的存在而急劇增加,因為氫氧根會被質子化為水,而水是一種弱得多的親核試劑。
芳香體系中通常會遇到三種親核取代機理,即SNAr(加成-消除)機理、苯炔機理和自由基SRN1機理。其中最重要的機理是SNAr機理,其中吸電子基團啟用環對親核進攻,例如,如果硝基官能團位於滷代離去基團的鄰位或對位。在有機化學入門課程的背景下,通常沒有必要詳細討論這些型別。
親電試劑是電子不足的粒子。因此,它們很可能與具有過量電子的物質發生反應。芳香族化合物在其離域的π軌道形式下具有更高的電子密度。
首先,親電試劑與芳香環的離域軌道相互作用,形成π-絡合物。
在這個階段沒有形成化學鍵。對於某些反應,已經發現了作為中間態的π-絡合物形成的證據,但並非所有反應都有,因為π-絡合物中的化學相互作用非常弱。
在π-絡合物形成後,在電子受體存在下,會形成另一種絡合物——σ-絡合物。它是一種陽離子物種,一種缺乏芳香族性質的中間體,但其四個π電子在環上離域,這在一定程度上穩定了陽離子,有時允許其分離。一個例子是間三甲苯氟硼酸鹽,它在低溫下穩定,並透過間三甲苯(1,3,5-三甲基苯)與氟硼酸(BF3/HF)反應制備;該鹽的陽離子是質子化的間三甲苯。σ-絡合物也稱為惠蘭中間體。
在下一階段,σ-絡合物分解,釋放氫陽離子並形成取代產物。

苯的另一個重要反應是鹵化物的親電取代,一種特定的親電芳香取代型別。這些反應對於向芳香體系中新增取代基非常有用。反應速率隨著鹵素的親電性而增加:因此,以這種方式進行的氟化反應太快且放熱,不切實際,而碘則需要最劇烈的條件。在四種可能的鹵化反應中,氯化和溴化在實驗室中最常進行。滷代苯用於殺蟲劑,以及其他產品的先驅。許多COX-2抑制劑含有滷代苯亞基。
一些高度活化的芳香族化合物,如苯酚和苯胺,反應性足夠強,可以在沒有催化劑的情況下進行鹵化,但對於典型的苯衍生物(以及苯本身),在室溫下沒有催化劑的情況下,反應極其緩慢。通常,路易斯酸用作催化劑,它們透過幫助極化鹵素-鹵素鍵來發揮作用,從而降低一個鹵素原子周圍的電子密度,使其更具親電性。最常用的催化劑是Fe或Al,或它們各自的氯化物和溴化物(+3氧化態)。如果三溴化鐵和三氯化鐵被任何存在的溼氣(包括大氣水蒸氣)水解,它們就會失去催化活性。因此,它們是原位透過向溴或氯中加入鐵屑來生成的。碘化反應在不同的條件下進行:通常使用高碘酸作為催化劑。在這些條件下,形成I+離子,它具有足夠的親電性來攻擊環。碘化也可以透過重氮反應來完成。氟化最常使用這種技術進行,因為使用氟氣既不方便,而且經常會使有機化合物斷裂。
芳香族化合物的鹵化與加成到烯烴或烷烴的自由基鹵化不同,後者不需要路易斯酸催化劑。芳烴離子的形成導致芳香性的暫時喪失,總的結果是反應的活化能高於脂肪族化合物的鹵化反應。
由於苯酚的解離,苯酚的鹵化在極性溶劑中更快,因為苯氧基(-O-)基團比羥基本身具有更強的活化作用。
芳香磺化是一種有機反應,其中芳烴上的氫原子被磺酸官能團取代,該反應為親電芳香取代。
這種反應的親電試劑是三氧化硫(SO3),它可以從發煙硫酸(也稱為發煙硫酸)中釋放出來,本質上是溶解了三氧化硫氣體的硫酸。
與芳香硝化和其他親電芳香取代反應相比,芳香磺化是可逆的。磺化在強酸性條件下進行,脫磺化可以在加熱和少量酸存在下發生。這也意味著可以在高溫下實現熱力學控制而不是動力學控制。因此,預計導向效應在確定高溫磺化產物異構體比例方面不會發揮關鍵作用。
芳香族磺酸可以作為染料和許多藥物製備的中間體。苯胺的磺化產生對氨基苯磺酸或磺胺酸,這是一種具有異常高熔點的兩性離子化合物。這種化合物及其相關化合物的醯胺形成一大類磺胺類藥物(一種抗生素)。
總反應:ArH + SO3 → ArSO3H
芳香族有機化合物的硝化透過親電取代機理髮生,該機理涉及富電子苯環被硝醯(硝基)離子攻擊。苯通常透過在50°C下用濃硫酸和濃硝酸的混合物迴流進行硝化。硫酸會再生,因此充當催化劑。
選擇性始終是硝化反應中的一個挑戰。芴酮硝化具有選擇性,並且透過稍微調整反應條件即可得到三硝基化合物或四硝基化合物。另一個三硝化的例子可以在間苯三酚的合成中找到。其他硝化試劑包括硝醯四氟硼酸鹽,它是一種真正的硝醯鹽。該化合物可以由氫氟酸、硝酸和三氟化硼製備。芳香族硝基化合物是苯胺的重要中間體;後者可以透過還原劑的作用很容易地製備。
總反應:ArH + HNO3 → ArNO2 + H2O

傅-克反應,由法國生物鹼化學家查爾斯·弗裡德爾和他的美國合夥人詹姆斯·克萊夫茨於1877年發現,是路易斯酸催化的芳香族化合物的烷基化或醯基化。它們在實驗室中用於形成芳香核與側鏈之間的碳-碳鍵非常有用。
傅-克烷基化是芳香族化合物中親電取代的一個例子。親電試劑是在烷基鹵化物與路易斯酸反應中形成的。路易斯酸使烷基鹵化物分子極化,導致其烴部分帶正電荷,從而變得更具親電性。
CH3—Cl + AlCl3 → CH3+ + AlCl4−
或
CH3Cl + AlCl3 → CH3δ+Cl+Al−Cl3
(碳原子略微過量的正電荷,因為電負性氯原子將電子密度吸引到自身。氯原子帶正電荷,因為它與鋁原子形成了次級鍵。實際上,Cl原子失去了一個電子,而Al原子獲得了一個電子。因此,Al原子帶負電荷。)
極化的親電試劑分子隨後試圖飽和其電子缺陷,並與富含π電子的芳香族化合物形成π絡合物。形成π絡合物不會導致芳香性的喪失。然而,在反應的下一階段即σ絡合物中,芳香性會消失。σ絡合物中的正電荷均勻分佈在苯環上。
C6H6 + CH3+ → C6H6+Br → C6H5Br + H+
σ絡合物C6H6+Br可以分離(在低溫下穩定),而π絡合物則不能。
- 鈍化官能團,如硝基(-NO2),通常會阻止反應以任何可觀的速率發生,因此可以使用硝基苯等溶劑進行傅克烷基化反應。
- 伯和仲碳正離子比叔碳正離子穩定性差得多,因此當試圖將伯和仲烷基引入環上時,通常會發生重排。因此,使用正丁基氯進行傅克烷基化會生成正丁基碳正離子,該碳正離子重排為叔丁基碳正離子,後者穩定性高得多,產物完全是叔丁基衍生物。在某些情況下,可以透過使用較弱的路易斯酸來避免這種情況。
- 傅克反應不能用於烷基化對酸敏感的化合物,包括許多雜環化合物。
- 限制傅克烷基化反應使用的另一個因素是多烷基化。由於烷基具有活化作用,取代的芳香族化合物比原始化合物更容易發生烷基化,因此嘗試將苯甲基化以得到甲苯通常會得到大量的二甲苯和均三甲苯。通常的解決方法是先醯化(參見以下部分),然後將羰基還原為烷基。

傅克醯化反應與傅克烷基化反應一樣,是親電取代反應的經典例子。
與路易斯酸反應,酸的酸酐和醯氯會變得高度極化,並經常形成醯基正離子。
RCOCl + AlCl3 → RC+O + AlCl4-
醯化反應的機理與烷基化反應非常相似。
C6H6 + RC+O → C6H6—CO—R + H+
然後形成的酮與三氯化鋁形成絡合物,降低了其催化活性。
C6H6—CO—R + AlCl3 → C6H6—C+(R)—O—Al−Cl3
因此,醯化反應所需的催化劑量遠大於烷基化反應。
- 雖然由於醯基正離子提供的共振穩定作用,碳正離子沒有發生異構化,但某些碳正離子可能會失去CO,然後發生烷基化而不是醯化。例如,嘗試將新戊醯基新增到芳香環上會導致碳正離子失去CO,然後形成叔丁基衍生物。
- 某些怕酸的芳香族化合物,如許多雜環化合物,不能在路易斯酸和酸酐的存在下存在。
- 甲醯氯不穩定,不能用於透過傅克醯化反應將甲醯基引入環中。相反,通常使用加特曼-科赫反應。
例如,傅克醯化反應用於由苯和鄰苯二甲酸酐合成蒽醌。
在實驗室合成中,在烷基化困難或不可能的情況下,通常使用傅克醯化反應代替烷基化反應,例如單取代烷基苯的合成。
- 鄰茴香酸還原成2-庚基-2-己烯酮在《有機合成》中鈍化間位版本文章
- 萘還原成1,4,5,8-四氫萘(異四氫萘)在《有機合成》中 文章。
- 鄰二甲苯還原成1,2-二甲基-1,4-環己二烯在《有機合成》中 文章
- 苯甲酸還原成2,5-環己二烯-1-羧酸在《有機合成》中 文章
- ↑ * A. J. Birch, J. Chem. Soc. 1944, 430。


