生物化學原理/脂類生物合成
| 此頁面已 匯入 並需要去維基化. 書籍應該謹慎使用維基連結,並且只用於引用對理解內容至關重要的技術或深奧術語。大多數如果不是全部維基連結都應該被刪除。請在頁面去維基化後刪除{{dewikify}}。 |
在動物中,當膳食碳水化合物供應過剩時,過量的碳水化合物會轉化為三醯甘油。這包括從乙醯輔酶 A 合成脂肪酸,以及在三醯甘油的生產中酯化脂肪酸,這是一個稱為脂肪生成的過程。脂肪酸由脂肪酸合成酶聚合然後還原乙醯輔酶 A 單位制成。脂肪酸中的醯基鏈透過新增乙醯基,將其還原為醇,將其脫水為烯烴基團,然後再次將其還原為烷烴基團的反應迴圈延長。脂肪酸生物合成的酶分為兩組,在動物和真菌中,所有這些脂肪酸合成酶反應都由單個多功能蛋白進行,而在植物質體和細菌中,不同的酶執行途徑中的每個步驟。脂肪酸隨後可以轉化為三醯甘油,這些三醯甘油包裝在脂蛋白中,並從肝臟分泌。
不飽和脂肪酸的合成涉及一個脫飽和反應,其中在脂肪醯基鏈中引入一個雙鍵。例如,在人類中,硬脂醯輔酶 A 去飽和酶 1 對硬脂酸的脫飽和會產生油酸。雙不飽和脂肪酸亞油酸以及三不飽和 α-亞麻酸不能在哺乳動物組織中合成,因此是必需脂肪酸,必須從飲食中獲取。三醯甘油合成在內質網中透過代謝途徑進行,其中脂肪醯輔酶 A 中的醯基被轉移到甘油 3 磷酸和二醯甘油的羥基上。
萜類和類異戊二烯,包括類胡蘿蔔素,是由來自活性前體異戊烯基焦磷酸和二甲基烯丙基焦磷酸的異戊二烯單元的組裝和修飾製成的。這些前體可以透過不同的方式製備。在動物和古菌中,甲羥戊酸途徑從乙醯輔酶 A 生產這些化合物,而在植物和細菌中,非甲羥戊酸途徑使用丙酮酸和甘油醛 3 磷酸作為底物。一個使用這些活化的異戊二烯供體的重要反應是類固醇生物合成。在這裡,異戊二烯單元連線在一起形成角鯊烯,然後摺疊並形成一組環以形成羊毛甾醇。羊毛甾醇隨後可以轉化為其他類固醇,例如膽固醇和麥角甾醇[1]。
| 此頁面可能需要透過引用可靠的出版物來 驗證事實。 您可以透過新增對可靠出版物的引用或 更正 被引用為事實的陳述來提供幫助。 |
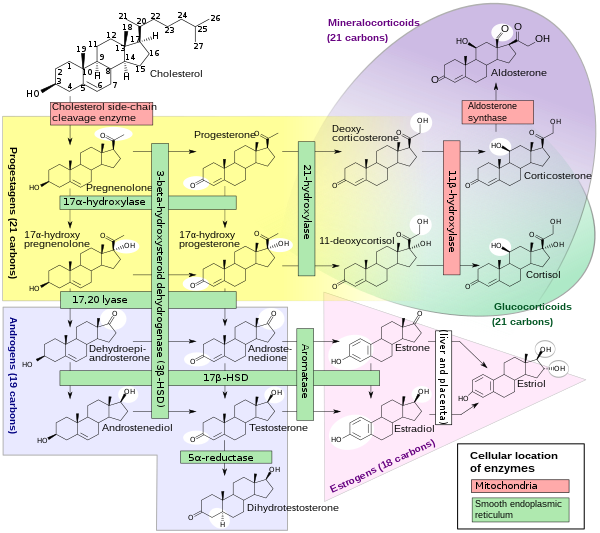
類固醇生物合成是一種合成代謝途徑,它從簡單的前體產生類固醇。這條途徑在動物中的進行方式與許多其他生物不同,使這條途徑成為抗生素和其他抗感染藥物的常見目標。此外,人類的類固醇代謝是降膽固醇藥物(如他汀類藥物)的目標。它始於人類的甲羥戊酸途徑,以乙醯輔酶 A 為構件,形成 DMAPP 和 IPP。在接下來的步驟中,DMAPP 和 IPP 形成羊毛甾醇,這是第一個類固醇。進一步的修飾屬於隨後的類固醇生成。類固醇生成是類固醇從膽固醇中生成並轉化為其他類固醇的生物過程。類固醇生成的途徑在不同的物種之間有所不同,但人類類固醇生成的途徑如圖所示。類固醇生成的產物包括:雄激素睪酮雌激素和孕酮皮質類固醇皮質醇醛固酮
睪酮生物合成 就像其他類固醇激素一樣,睪酮衍生自膽固醇(見右圖)。生物合成的第一步涉及 CYP11A 對膽固醇側鏈的氧化裂解,CYP11A 是一種線粒體細胞色素 P450 氧化酶,損失了六個碳原子,形成了孕烯醇酮。在下一步中,CYP17A 酶在內質網中去除了另外兩個碳原子,產生了各種 C19 類固醇。此外,3-羥基被 3-β-HSD 氧化,產生雄烯二酮。在最後一步和限速步驟中,雄烯二酮的 C-17 酮基被 17-β 羥基類固醇脫氫酶還原,生成睪酮。男性睪丸產生最多的睪酮(>95%)。它也以少得多的量在女性卵巢的卵泡膜細胞中合成,在胎盤中合成,以及在男女兩性的腎上腺皮質網狀帶中合成。在睪丸中,睪酮由睪丸間質細胞產生。男性生殖腺還包含支援細胞,支援細胞需要睪酮才能進行精子生成。像大多數激素一樣,睪酮透過血液供應給靶組織,在那裡睪酮的大部分與特異性血漿蛋白結合,即性激素結合球蛋白 (SHBG)[2]。
合成代謝類固醇及其濫用 合成代謝類固醇 (AAS) 首次分離、鑑定和合成於 1930 年代,現在在醫學中作為治療藥物用於刺激骨骼生長和食慾、誘導男性青春期以及治療癌症和艾滋病等慢性消耗性疾病。合成代謝類固醇還會增加肌肉質量和力量,因此在運動和健美中被用來增強力量或體格。已知副作用包括膽固醇水平的危害變化(低密度脂蛋白升高,高密度脂蛋白降低)、痤瘡、高血壓、肝臟損傷。其中一些副作用可以透過補充藥物來緩解。體育界 AAS 使用始於 1954 年 10 月,美國運動員的醫生約翰·齊格勒與美國舉重隊一起前往維也納。在那裡,他遇到了一個俄羅斯物理學家,在“喝了幾杯酒”後,反覆問道:“你們給孩子們吃什麼?”當齊格勒反問這個問題時,俄羅斯人說他自己的運動員正在服用睪酮。回到美國後,齊格勒嘗試對自己的身體、美國教練鮑勃·霍夫曼以及兩名舉重運動員吉姆·帕克和亞茲·庫扎拉進行了低劑量睪酮治療。所有這些人都比任何訓練計劃所能產生的體重和力量增加得更多,但也有副作用。齊格勒尋找一種沒有副作用的藥物,並找到了合成代謝類固醇甲基睪丸酮(大力補,DBOL),該藥物由西巴公司於 1958 年在美國製造。結果令人印象深刻——如此令人印象深刻,以至於舉重運動員開始服用越來越多的藥物。類固醇傳播到其他需要體重的運動專案中。美國聖地亞哥閃電隊的退役跑衛保羅·洛伊在 1970 年對加州立法委員會藥物濫用小組說:“我們必須在午餐時間服用它們[類固醇]。他[官員]會把它們放在一個碟子上,給我們開處方,如果不服用,他就會暗示可能會被罰款。”奧運會統計資料顯示,從 1956 年到 1972 年,推鉛球運動員的體重增加了 14%,而障礙賽跑運動員的體重增加了 7.6%。金牌五項全能運動員瑪麗·彼得斯說:“美國的一個醫學研究小組試圖對類固醇對舉重運動員和投擲運動員的影響進行廣泛的研究,但發現沒有服用類固醇的人太少了,他們無法建立任何有價值的比較。”1984 年,傑伊·西爾維斯特,前四屆奧運會選手和 1972 年鐵餅銀牌得主,當時在美國楊百翰大學體育系任職,對當年奧運會的參賽選手進行了詢問。他發現類固醇使用範圍從每天 10 毫克到 100 毫克不等[3]。
在比賽中使用違禁類固醇的著名案例是加拿大運動員本·約翰遜在 1988 年夏季奧運會上 100 米短跑中的勝利。隨後,他在尿液中被檢測出斯坦諾佐醇,因此未能透過藥檢。他後來承認使用過這種類固醇,以及雄烯二醇、環丙酸睪酮、呋喃唑酮和人生長激素等。因此,約翰遜被剝奪了金牌,也失去了打破世界紀錄的認可。卡爾·劉易斯隨後被提升一位,獲得了奧運會金牌。劉易斯也跑出了當時的世界紀錄,因此被認定為新的紀錄保持者,然而,在 2003 年,美國奧委會(USOC)從 1991 年到 2000 年的禁藥控制管理主管韋德·埃克斯姆博士向《體育畫報》提供了一些檔案,這些檔案揭示了大約 100 名美國運動員未能透過藥檢,本應被禁止參加奧運會,但他們卻被允許參賽。這些運動員中就包括卡爾·劉易斯。劉易斯隨後打破沉默,回應了他受益於禁藥掩蓋的指控,承認自己曾被檢測出違禁物質陽性,但聲稱他只是“數百名”被美國奧委會隱瞞,從而得以逃脫禁賽的美國運動員之一。劉易斯現在已經承認,他在 1988 年美國奧運會選拔賽中三次檢測出違禁物質陽性,根據當時的國際規則,他應該被禁止參加兩個月後的漢城奧運會。
前運動員和官員紛紛譴責美國奧委會的掩蓋行為。“我經歷了那麼多年。我知道這件事在發生,但作為一名運動員,你無能為力。你必須相信管理機構會履行他們的職責。很明顯,他們沒有做到,”前美國短跑運動員、1984 年奧運會冠軍埃夫林·阿什福德說。
皮質醇的生物合成
皮質醇是由膽固醇合成的。合成發生在腎上腺皮質的束狀帶。(皮質醇的名字來源於皮質。)雖然腎上腺皮質也產生醛固酮(在球狀帶)和一些性激素(在網狀帶),但皮質醇是其主要分泌物。腎上腺髓質位於皮質下方,主要分泌腎上腺素和去甲腎上腺素,這兩種兒茶酚胺在交感神經刺激下分泌。腎上腺中皮質醇的合成是由垂體前葉的促腎上腺皮質激素(ACTH)刺激的;ACTH 的產生反過來又受到下丘腦分泌的促腎上腺皮質激素釋放激素(CRH)的刺激。ACTH 透過調節 STAR(類固醇生成急性調節)蛋白,增加內線粒體膜中膽固醇的濃度。它還刺激皮質醇合成中主要的限速步驟,在這個步驟中,膽固醇被轉化為孕烯醇酮,並由細胞色素 P450SCC(側鏈裂解酶)催化。
膽固醇合成
[edit | edit source]所有動物細胞都會合成膽固醇,合成速率因細胞型別和器官功能而異。大約 20-25% 的每日總膽固醇合成發生在肝臟;其他合成速率較高的部位包括腸道、腎上腺和生殖器官。體內合成從一個乙醯輔酶 A 分子和一個乙醯乙醯輔酶 A 分子開始,它們脫水形成 3-羥基-3-甲基戊二醯輔酶 A (HMG-CoA)。然後,該分子在酶 HMG-CoA 還原酶的作用下被還原為甲羥戊酸。這一步驟是膽固醇合成中受調節的、限速的和不可逆的步驟,也是他汀類藥物(HMG-CoA 還原酶競爭性抑制劑)的作用位點。然後甲羥戊酸在三個需要 ATP 的反應中被轉化為 3-異戊烯基焦磷酸。該分子被脫羧為異戊烯基焦磷酸,它是各種生物反應的關鍵代謝物。三個異戊烯基焦磷酸分子透過香葉基轉移酶的作用,縮合成法呢基焦磷酸。然後,兩個法呢基焦磷酸分子透過內質網中角鯊烯合酶的作用縮合成角鯊烯。氧化角鯊烯環化酶隨後將角鯊烯環化為羊毛固醇。最後,羊毛固醇被轉化為膽固醇。康拉德·布洛赫和費奧多爾·萊寧因其在膽固醇和脂肪酸代謝機制和調節方面的發現而共同獲得了 1964 年諾貝爾生理學或醫學獎[4]。
膽固醇的生物合成受現有膽固醇水平的直接調節,儘管所涉及的穩態機制只是部分被理解。從食物中攝入更多的膽固醇會導致內源性合成淨減少,而從食物中攝入的膽固醇較少則會產生相反的效果。主要的調節機制是內質網中蛋白質 SREBP(固醇調節元件結合蛋白 1 和 2)感知細胞內膽固醇。在存在膽固醇的情況下,SREBP 與另外兩個蛋白質結合:SCAP(SREBP 裂解啟用蛋白)和 Insig1。當膽固醇水平下降時,Insig-1 會從 SREBP-SCAP 複合體中分離出來,允許該複合體遷移到高爾基體,在那裡 SREBP 被 S1P 和 S2P(位點 1 和 2 蛋白酶)裂解,這兩種酶在膽固醇水平低時由 SCAP 啟用。然後,裂解的 SREBP 遷移到細胞核,作為轉錄因子與 SRE(固醇調節元件)結合,從而刺激許多基因的轉錄。其中包括低密度脂蛋白 (LDL) 受體和 HMG-CoA 還原酶。前者從血液中清除迴圈的 LDL,而後者會導致膽固醇內源性合成的增加。邁克爾·S·布朗博士和約瑟夫·L·戈德斯坦博士在 1970 年代闡明瞭這一訊號通路的大部分內容。1985 年,他們因其研究成果獲得了諾貝爾生理學或醫學獎。他們隨後的研究表明,SREBP 通路如何調節許多基因的表達,這些基因控制著脂質的形成和代謝以及身體燃料的分配。當膽固醇水平高時,膽固醇合成也可以被關閉。HMG CoA 還原酶既包含胞質結構域(負責其催化功能),也包含膜結構域。膜結構域的功能是感知其降解的訊號。膽固醇(和其他固醇)濃度的增加會導致該結構域寡聚化狀態的改變,使其更容易被蛋白酶體破壞。該酶的活性也可以被 AMP 啟用蛋白激酶的磷酸化降低。由於這種激酶被 AMP 啟用,而 AMP 是在 ATP 水解時產生的,因此當 ATP 水平低時,膽固醇合成就會停止[5]。
類異戊二烯或萜類化合物的生物合成
[edit | edit source]
有兩種代謝途徑可以產生萜類化合物
甲羥戊酸途徑 許多生物體透過 HMG-CoA 還原酶途徑合成萜類化合物,該途徑也產生膽固醇。反應發生在胞質溶膠中。該途徑是在 1950 年代被發現的。
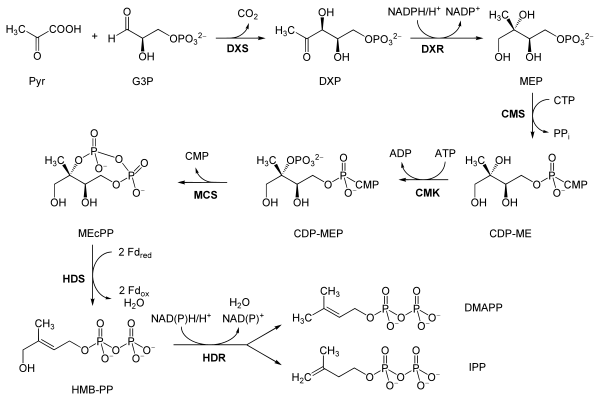
MEP/DOXP 途徑 2-C-甲基-D-赤蘚醇 4-磷酸/1-脫氧-D-木糖醇 5-磷酸途徑 (MEP/DOXP 途徑),也稱為 [非甲羥戊酸途徑] 或甲羥戊酸獨立途徑,發生在植物和頂復門原生動物的質體中,以及許多細菌中。它是在 1980 年代後期被發現的。丙酮酸和甘油醛 3-磷酸在 DOXP 合酶 (Dxs) 的作用下轉化為 1-脫氧-D-木糖醇 5-磷酸,在 DOXP 還原酶 (Dxr, IspC) 的作用下轉化為 2-C-甲基-D-赤蘚醇 4-磷酸 (MEP)。隨後發生的三個反應步驟,由 4-二磷酸胞苷-2-C-甲基-D-赤蘚醇合酶 (YgbP, IspD)、4-二磷酸胞苷-2-C-甲基-D-赤蘚醇激酶 (YchB, IspE) 和 2-C-甲基-D-赤蘚醇 2,4-環二磷酸合酶 (YgbB, IspF) 催化,介導 2-C-甲基-D-赤蘚醇 2,4-環焦磷酸 (MEcPP) 的形成。最後,MEcPP 在 HMB-PP 合酶 (GcpE, IspG) 的作用下被轉化為 (E)-4-羥基-3-甲基-丁-2-烯基焦磷酸 (HMB-PP),HMB-PP 在 HMB-PP 還原酶 (LytB, IspH) 的作用下被轉化為異戊烯基焦磷酸 (IPP) 和二甲基烯丙基焦磷酸 (DMAPP)。IPP 和 DMAPP 是兩種途徑的最終產物,是異戊二烯、單萜類化合物 (10-碳)、二萜類化合物 (20-碳)、類胡蘿蔔素 (40-碳)、葉綠素和質體醌-9 (45-碳) 的前體。所有高階萜類化合物的合成都是透過形成香葉基焦磷酸 (GPP)、法呢基焦磷酸 (FPP) 和香葉基香葉基焦磷酸 (GGPP) 進行的。雖然 MVA 和 MEP 兩種途徑在大多數生物體中是相互排斥的,但據報道它們之間存在相互作用,存在於植物和少數細菌物種中。
| 生物體 | 途徑 |
|---|---|
| 細菌 | MVA 或 MEP |
| 古細菌 | MVA |
| 綠 藻類 | MEP |
| 植物 | MVA 和 MEP |
| 動物 | MVA |
| 真菌 | MVA |
經典的 [甲羥戊酸途徑或 HMG-CoA 還原酶 途徑是所有高等真核生物和許多細菌中存在的重要細胞代謝途徑。它對於產生 IPP 和 DMAPP 至關重要,它們是生物合成各種分子的基礎,這些分子用於各種不同的過程中,例如蛋白質 預醯化、細胞膜 維持、激素、蛋白質錨定 和 N-糖基化。
與經典的甲羥戊酸途徑異戊二烯生物合成不同,植物和如瘧疾寄生蟲的頂復門原生動物能夠透過另一種途徑,即非甲羥戊酸途徑,在它們的質體中產生異戊二烯(萜類)。[6] 此外,大多數包括重要病原體如結核分枝桿菌的細菌透過非甲羥戊酸途徑合成IPP和DMAPP。
{{cite journal}}: CS1 maint: uses authors parameter (link) 請注意,該來源使用的酶名稱和縮寫既不全面也不標準(參見Eisenreich W, Bacher A, Arigoni D, Rohdich F (2004). "Biosynthesis of Isoprenoids Via the Non-mevalonate Pathway". Cell. Mol. Life Sci. 61 (12): 1401–26. doi:10.1007/s00018-004-3381-z. PMID 15197467. Retrieved March 23, 2017.{{cite journal}}: CS1 maint: multiple names: authors list (link));因此,影像內容必須與三個相關門/界中任何一個途徑的標準酶名稱和縮寫相協調。有關說明,請參閱英文維基百科的“非甲羥戊酸途徑”文章。二十碳烷類生物合成
[edit | edit source]有兩類酶催化脂肪酸氧合生成二十碳烷類
二十碳烷類不會儲存在細胞內,而是按需合成。它們來源於構成細胞膜和核膜的脂肪酸。
二十碳烷類生物合成始於細胞被機械損傷、細胞因子、生長因子或其他刺激啟用。(刺激甚至可能是來自鄰近細胞的二十碳烷類;這些途徑很複雜。)這會觸發磷脂酶在細胞膜上的釋放。磷脂酶會移動到核膜。在那裡,磷脂酶催化磷脂(透過A2)或二醯基甘油(透過磷脂酶C)的酯水解。這會釋放一個20碳必需脂肪酸。這種水解似乎是二十碳烷類形成的限速步驟。
脂肪酸可能會被幾種磷脂酶中的任何一種釋放。其中,IV型胞質磷脂酶A2(cPLA2)是關鍵角色,因為缺乏cPLA2的細胞通常沒有二十碳烷類合成。磷脂酶cPLA2專門針對在SN2位置包含AA、EPA或GPLA的磷脂。有趣的是,cPLA2也可能釋放成為血小板活化因子的溶血磷脂。[7]
過氧化和活性氧物質
[edit | edit source]接下來,遊離脂肪酸透過多種途徑之一被氧合;請參見途徑表。二十碳烷類途徑(透過脂氧合酶或COX)會新增分子氧(O2)。儘管脂肪酸是對稱的,但由此產生的二十碳烷類是手性的;氧化過程具有很高的立體專一性。
脂類的氧化對細胞有害,尤其是在靠近細胞核時。存在著防止意外氧化的複雜機制。COX、脂氧合酶和磷脂酶受到嚴格控制——至少有八種蛋白質被啟用以協調白三烯的生成。其中許多存在於多個亞型中。[8]
透過COX或脂氧合酶的氧化會釋放活性氧物質(ROS),而二十碳烷類生成中的初始產物本身就是高反應性的過氧化物。LTA4可以與組織DNA形成加合物。脂氧合酶的其他反應會導致細胞損傷;鼠屬模型將15-脂氧合酶與動脈粥樣硬化的發病機制聯絡起來。[9][10] 二十碳烷類生成中的氧化被分隔開;這限制了過氧化物的損傷。二十碳烷類生物合成酶(例如谷胱甘肽-S-轉移酶、環氧化物水解酶和載體蛋白)屬於家族,其功能主要與細胞解毒有關。這表明二十碳烷類訊號傳導可能起源於ROS的解毒。
細胞必須從在其細胞核附近生成脂類氫過氧化物中獲得一些益處。PG和LT可能在那裡發出訊號或調節DNA轉錄;LTB4是過氧化物酶體增殖物啟用受體α的配體。(參見PPAR的示意圖。)

|
|

| |
| 前列腺素E1。5元環是該類的特徵。 | 血栓烷A2。氧 已經移入環中。 |
白三烯B4。請注意3個共軛雙鍵。 | |

|

| ||
| 前列環素I2。第二個環將其與前列腺素類區分開來。 | 白三烯E4,一種半胱氨醯白三烯的例子。 | ||

環氧合酶 (COX) 透過兩步過程催化遊離必需脂肪酸轉化為前列腺素。第一步,兩個O2分子作為兩個過氧化物鍵新增,並在脂肪酸鏈的中間附近形成一個五元碳環。這形成了短壽命、不穩定的中間體前列腺素G(PGG)。其中一個過氧化物鍵脫落一個氧原子,形成PGH。(參見環氧合酶中的圖表和更多細節)。所有其他前列腺素都源自PGH(作為PGH1、PGH2或PGH3)。
圖1顯示了PGH2(來自花生四烯酸)是如何轉化的

三類前列腺素在分子中心具有不同的環。它們的結構不同。PGH化合物(所有其他化合物的母體)具有一個五元環,由兩個氧原子橋接(一個過氧化物)。衍生的前列腺素包含一個單一的、不飽和的五元環。在血栓烷中,環變成一個包含一個氧原子的六元環。
細菌和病毒感染中PGE2的產生似乎是由某些細胞因子(例如白介素-1)刺激的。[7]
白三烯是在細胞中由花生四烯酸透過5-脂氧合酶合成的。催化機制涉及在花生四烯酸骨架的特定位置插入一個氧基。脂氧合酶途徑在白細胞中是活躍的,包括肥大細胞、嗜酸性粒細胞、中性粒細胞、單核細胞和嗜鹼性粒細胞。當這些細胞被啟用時,花生四烯酸從細胞膜磷脂中釋放出來,由磷脂酶A2釋放,並由5-脂氧合酶啟用蛋白(FLAP)提供給5-脂氧合酶。5-脂氧合酶(5-LO)利用FLAP將花生四烯酸轉化為5-羥過氧化二十碳四烯酸(5-HPETE),5-HPETE自發還原為5-羥二十碳四烯酸(5-HETE)。酶5-LO再次作用於5-HETE,將其轉化為白三烯A4(LTA4),一種不穩定的環氧化合物。在具有LTA4水解酶的細胞中,例如中性粒細胞和單核細胞,LTA4被轉化為二羥基酸白三烯LTB4,它是一種強大的中性粒細胞趨化劑,作用於這些細胞質膜上的BLT1和BLT2受體。在表達LTC4合成酶的細胞中,例如肥大細胞和嗜酸性粒細胞,LTA4與三肽谷胱甘肽結合,形成第一個半胱氨醯白三烯LTC4。在細胞外,LTC4可以透過普遍存在的酶依次轉化為LTD4和LTE4,它們保留生物活性。半胱氨醯白三烯作用於靶細胞上的細胞表面受體CysLT1和CysLT2,導致支氣管和血管平滑肌收縮,增加小血管的通透性,增強氣道和腸道的粘液分泌,並招募白細胞到炎症部位。LTB4和半胱氨醯白三烯(LTC4、LTD4、LTE4)都在區域性組織中部分降解,最終在肝臟中成為無活性的代謝物。
環氧合酶(COX)
COX將花生四烯酸(AA,一個ω-6 PUFA)轉化為前列腺素H2(PGH2),它是系列-2前列腺素的前體。該酶包含兩個活性位點:具有過氧化物酶活性的血紅素,負責將PGG2還原為PGH2,以及環氧合酶位點,花生四烯酸在該位點被轉化為氫過氧化內過氧化物前列腺素G2(PGG2)。反應透過過氧化物酶活性位點產生的酪氨酸自由基從花生四烯酸中奪取H原子進行。然後兩個O2分子與花生四烯酸自由基反應,生成PGG2。目前,已知三種COX同工酶:COX-1、COX-2和COX-3。COX-3是COX-1的剪接變體,保留了內含子1,並具有移碼突變;因此有些人更喜歡使用COX-1b或COX-1變體(COX-1v)這個名字。[3] 不同的組織表達不同水平的COX-1和COX-2。儘管這兩種酶在基本作用上相同,但選擇性抑制在副作用方面會產生差異。COX-1被認為是組成型酶,存在於大多數哺乳動物細胞中。另一方面,COX-2在大多數正常組織中是無法檢測到的。它是一種誘導型酶,在啟用的巨噬細胞和其他炎症部位的細胞中變得豐富。最近,研究表明它在各種癌症中被上調,並在腫瘤發生中發揮核心作用。COX-1和-2(也稱為PGHS-1和-2)也會氧化另外兩種必需脂肪酸——DGLA(ω-6)和EPA(ω-3)——生成系列-1和系列-3前列腺素,這些前列腺素的炎症性比系列-2弱。DGLA和EPA是COX途徑中AA的競爭性抑制劑。這種抑制是膳食來源的DGLA和EPA(例如,琉璃苣油、魚油)減少炎症的主要作用方式。使用合成代謝類固醇現在被所有主要體育組織禁止,包括ATP、WTA、ITF、國際奧委會、國際足聯、歐洲足聯、所有主要職業高爾夫巡迴賽、國家曲棍球聯盟、美國職業棒球大聯盟、美國國家籃球協會、歐洲田徑協會、WWE和NFL。然而,藥物檢測可能存在巨大的差異,在某些情況下,並沒有得到執行。
膽汁酸是主要存在於哺乳動物膽汁中的類固醇酸。膽汁鹽是膽汁酸與陽離子(通常是鈉)結合形成的。在人類中,牛磺膽酸和甘氨膽酸(膽酸的衍生物)的鹽類約佔所有膽汁鹽的百分之八十。兩種主要的膽汁酸是膽酸和鵝去氧膽酸。膽汁酸、甘氨酸和牛磺酸結合物以及7-α-脫羥基衍生物(脫氧膽酸和石膽酸)都存在於人類腸道膽汁中。膽汁酸分泌量的增加表現為膽汁流量的增加。膽汁酸的主要功能是促進膽汁酸的形成,促進膽汁酸的形成,促進膳食脂肪的加工。
膽汁酸是在肝臟中透過細胞色素P450介導的膽固醇氧化生成的。它們與牛磺酸或氨基酸甘氨酸結合,或與硫酸或葡萄糖醛酸結合,然後儲存在膽囊中,膽囊透過去除水來濃縮鹽類。在人類中,限速步驟是在類固醇核的7位新增一個羥基,由酶膽固醇7α-羥化酶催化。進食後,膽囊中的內容物分泌到腸道中,在那裡,膽汁酸起乳化膳食脂肪的作用。膽汁酸還有其他功能,包括從體內消除膽固醇,驅動膽汁流動以消除肝臟中的分解代謝物,乳化腸道中的脂類和脂溶性維生素以形成可以被乳糜管系統運輸的膠束,以及幫助減少小腸和膽道中發現的細菌菌群。
膽汁酸指的是質子化(-COOH)形式。膽汁鹽指的是去質子化或離子化(-COO-)形式。結合膽汁酸在乳化脂肪方面更有效,因為在腸道pH下,它們的離子化程度比未結合膽汁酸更高。[11]
膽汁酸的合成是除人類以外大多數物種中膽固醇代謝的主要途徑。人體每天產生約800毫克的膽固醇,其中約一半用於膽汁酸合成。總共約20-30克膽汁酸每天分泌到腸道中。約90%的排洩膽汁酸被主動運輸在迴腸中重新吸收,並迴圈利用,稱為腸肝迴圈,將膽汁鹽從腸道系統轉移回肝臟和膽囊。這使得每天的合成率很低,但對消化系統的高分泌率。膽汁還用於將脂肪球分解成微小的液滴。屠宰動物的膽汁可以用於制皂。
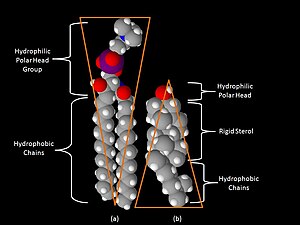
磷脂 磷脂和糖脂由兩條長的非極性 (疏水) 烴鏈 連線到一個 親水 頭部基團。
磷脂的頭部是 磷酸化 的,它們由以下任一種組成:
- 甘油(因此該類脂類被稱為磷酸甘油酯)。
- 鞘氨醇(只有一個成員 - 鞘磷脂)。
糖脂 糖脂的頭部包含一個 鞘氨醇,其上連線著 一個或多個糖單元。疏水鏈屬於以下任一種:
脂肪酸 磷脂和糖脂中的脂肪酸通常含有偶數個 碳 原子,通常在 14 到 24 之間。16 碳和 18 碳 FA 是最常見的。FA 可以是飽和的或不飽和的,雙鍵 的構型幾乎總是順式。FA 鏈的長度和 不飽和度 對膜的 流動性 有著深遠的影響。
磷酸甘油酯 在磷酸甘油酯中,甘油的 C-1 和 C-2 位的羥基酯化為 FA 的羧基。C-3 羥基酯化為磷酸。所得化合物稱為 磷脂酸,是最簡單的 磷酸甘油酸。膜中只有少量磷脂酸。然而,它是其他磷酸甘油酯 生物合成 中的關鍵中間體。
鞘氨醇 鞘氨醇是一種氨基醇,含有長 不飽和 烴鏈。在鞘磷脂和糖脂中,鞘氨醇的氨基透過一個 醯胺 鍵連線到 FA。在鞘磷脂中,鞘氨醇的伯 羥基 酯化為磷醯 膽鹼。在糖脂中,糖成分連線到該基團。最簡單的糖脂是 腦苷脂,其中只有一個糖殘基,可以是 Glc 或 Gal。更復雜的糖脂,如 神經節苷脂,包含多達七個糖殘基的支鏈。
-
鞘氨醇 - IUPAC 名稱:(2S,3R)-2-氨基十八碳-4-烯-1,3-二醇
鞘氨醇由棕櫚醯輔酶 A 和絲氨酸透過縮合反應合成,該反應需要生成 脫氫鞘氨醇。
-
鞘氨醇由棕櫚醯輔酶 A 和絲氨酸透過縮合反應合成,該反應需要生成脫氫鞘氨醇
脫氫鞘氨醇隨後被 NADPH 還原為 二氫鞘氨醇(鞘氨胺),最後被 FAD 氧化為鞘氨醇。
沒有從 鞘氨胺 到鞘氨醇的直接合成途徑;它必須先被醯化成 二氫神經醯胺,然後脫氫成神經醯胺。鞘氨醇是透過溶酶體中鞘脂的降解形成的。
膽固醇
膽固醇 天然存在於 真核生物 細胞膜 中,它在那裡透過 甲羥戊酸 經 萜類 的角鯊烯環化作用生物合成。它優先與 鞘脂(見圖)相關聯,在真核細胞膜的富膽固醇 脂筏 區域中。[12] 藿烷類在原核生物中發揮著類似的功能。
細胞膜需要高水平 - 通常整個膜中平均 20% 的膽固醇分子,在脂筏區域區域性增加至 50% 的膽固醇(-% 是分子比率)[13] 脂筏 的形成促進了外周和 跨膜蛋白 的聚集,包括 SNARE 和 VAMP 蛋白的停靠。[14]
古細菌膜
[edit | edit source]
古細菌膜是由與其他生命形式中的分子截然不同的分子組成的,這表明古細菌與細菌和真核生物的關係僅是遙遠的。[15] 在所有生物體中,細胞膜 由稱為 磷脂 的分子組成。這些分子同時具有溶於水的 極性 部分(磷酸“頭部”),和不溶於水的“油膩”非極性部分(脂尾)。這些不同的部分透過 甘油 部分連線在一起。在水中,磷脂會聚集在一起,頭部朝向水,尾部背離水。細胞膜中的主要結構是這些磷脂的雙層,稱為 脂雙層[16]。
這些磷脂在以下四個方面不同尋常
- 細菌和真核生物的膜主要由甘油-酯 脂類 組成,而古細菌的膜由甘油-醚脂類 組成。[17] 不同之處在於連線脂類與甘油部分的鍵型別;兩種型別在右側圖中以黃色顯示。在酯脂類中,這是一個 酯鍵,而在醚脂類中,這是一個 醚鍵。醚鍵比酯鍵在化學上更穩定。這種穩定性可能有助於古細菌在極端溫度和非常 酸性 或 鹼性 的環境中存活。[18] 細菌和真核生物確實包含一些醚脂類,但與古細菌不同,這些脂類不是其膜的主要部分。
- 立體化學 甘油部分與其他生物體中發現的相反。甘油部分可以存在兩種形式,它們是彼此的映象,稱為右手和左手形式;在化學中,它們被稱為對映異構體。就像右手不能輕鬆地戴進左手的皮手套一樣,右手甘油分子通常不能被適應左手形式的 酶 使用或製造。這表明古細菌使用與細菌和真核生物完全不同的酶來合成磷脂。這些酶在生命歷史的早期發展,表明早期與其他兩個域分離。[15]
- 古細菌的脂類尾部在化學上與其他生物不同。古細菌的脂類以異戊二烯側鏈為基礎,是具有多個側支的長鏈,有時甚至有環丙烷或環己烷環。[19] 這與其他生物膜中發現的脂肪酸形成對比,脂肪酸具有沒有支鏈或環的直鏈。儘管異戊二烯在許多生物的生物化學中起著重要作用,但只有古細菌使用它們來製造磷脂。這些支鏈可能有助於防止古細菌膜在高溫下洩漏。[20]
- 在一些古細菌中,脂質雙層膜被單層膜取代。實際上,古細菌將兩個獨立的磷脂分子的尾部融合成一個具有兩個極性頭的單一分子;這種融合可能使它們的膜更加堅固,並更好地抵抗惡劣的環境。[21] 例如,鐵質菌屬中的脂類就是這種型別,人們認為這有助於該生物在其高酸性棲息地中生存。[22]
萜類生物合成
[edit | edit source]

萜類在生物合成上衍生自異戊二烯單元,異戊二烯的分子式為C5H8。萜類的基本分子式是該分子式的倍數,(C5H8)n,其中n是連線的異戊二烯單元的數目。這被稱為異戊二烯規則或C5規則。異戊二烯單元可以“頭尾相連”連線在一起形成線性鏈,也可以排列成環狀結構。可以將異戊二烯單元視為自然界中常見的結構單元之一。
異戊二烯本身不會參與構建過程,而是活化的形式,即異戊烯焦磷酸(IPP,也稱為異戊烯二磷酸)和二甲基烯丙基焦磷酸(DMAPP,也稱為二甲基烯丙基二磷酸)是生物合成途徑中的組成部分。IPP由乙醯輔酶A透過HMG-CoA還原酶途徑中甲羥戊酸的中間體形成。在一些細菌類群和植物的質體中,已知IPP的另一種完全無關的生物合成途徑,即所謂的MEP(2-甲基-D-赤蘚糖醇-4-磷酸)途徑,該途徑從C5-糖開始。在這兩個途徑中,IPP透過異戊烯焦磷酸異構酶被異構化為DMAPP。
 |
 |
隨著異戊二烯單元鏈的增長,形成的萜類按照大小依次分類為半萜、單萜、倍半萜、二萜、倍二萜、三萜和四萜[23]。
甲羥戊酸途徑和他汀類藥物
[edit | edit source]甲羥戊酸途徑或HMG-CoA還原酶途徑或甲羥戊酸依賴性(MAD)途徑或類異戊二烯途徑是存在於所有高等真核生物和許多細菌中的重要細胞代謝途徑。它對產生二甲基烯丙基焦磷酸(DMAPP)和異戊烯焦磷酸(IPP)非常重要,它們作為生物合成各種分子(用於萜類合成、蛋白質預烯化、細胞膜維持、激素、蛋白質錨定和N-糖基化等多種過程)的基礎。它也是類固醇生物合成的組成部分[24]。
在啟用SREBP(固醇調節元件結合蛋白-1和-2)後,可以透過DNA轉錄調節啟用幾種關鍵酶。這種細胞內感測器檢測低膽固醇水平,並透過HMG-CoA還原酶途徑刺激內源性膽固醇產生,以及透過上調LDL受體來增加脂蛋白的攝取。該途徑的調節還透過控制mRNA的翻譯速率、還原酶的降解和磷酸化來實現。
| 反應 | 圖示 | 酶 |
| 乙醯輔酶A(檸檬酸迴圈)透過乙醯輔酶A轉移酶與另一個乙醯輔酶A亞基發生縮合,形成乙醯乙醯輔酶A | 硫解酶 | |
| 乙醯輔酶A與乙醯乙醯輔酶A縮合,形成3-羥基-3-甲基戊二醯輔酶A(HMG-CoA)。 | HMG-CoA合成酶 | |
| HMG-CoA透過NADPH被還原為甲羥戊酸。該反應發生在胞質溶膠中。它是膽固醇合成的限速步驟,因此催化該反應的酶是他汀類藥物的目標。 |  |
HMG-CoA還原酶 |
| 甲羥戊酸到5-磷酸甲羥戊酸。 |  |
甲羥戊酸激酶 |
| 5-磷酸甲羥戊酸到5-焦磷酸甲羥戊酸。 | 磷酸甲羥戊酸激酶 | |
| 甲羥戊酸-5-焦磷酸到3-異戊烯焦磷酸(IPP)(另見HIDS)。 |  |
甲羥戊酸-5-焦磷酸脫羧酶 |
| 3-異戊烯焦磷酸被異構化為二甲基烯丙基焦磷酸。 |  |
異戊烯焦磷酸異構酶 |

1971年,日本生物化學家遠藤章在製藥公司三共工作期間,開始尋找降低膽固醇的藥物。研究已經表明,膽固醇主要由肝臟透過一種稱為HMG-CoA還原酶的酶在體內合成。遠藤及其團隊推斷,某些微生物可能產生該酶的抑制劑來防禦其他生物,因為甲羥戊酸是許多生物維持其細胞壁(麥角固醇)或細胞骨架(類異戊二烯)所需物質的前體。他們識別的第一個藥物是麥維菌素(ML-236B),這是由真菌青黴菌屬中的一種真菌產生的分子。記者約翰·西蒙斯在《財富》雜誌上寫道,這一發現的訊息很快在醫學界傳開,同時傳言也暗示了這種他汀類藥物與實驗室犬的腫瘤、肌肉退化以及有時死亡有關。幾家製藥公司都被這些報道嚇退了,但默克公司的首席科學家兼後來的執行長P·羅伊·瓦格洛斯表現出了興趣,並從1975年開始多次前往日本。到1978年,默克已經從真菌麴黴屬中分離出洛伐他汀(mevinolin,MK803),該藥物於1987年首次以美降脂的名稱上市。膽固醇與心血管疾病之間的聯絡,即脂質假說,已經被提出。膽固醇是動脈粥樣硬化中動脈壁脂肪塊(動脈粥樣硬化斑塊)的主要成分,當這些斑塊破裂時,會引起絕大多數的心臟病發作。治療主要包括膳食措施,例如低脂肪飲食,以及難以耐受的藥物,例如氯貝特、考來烯胺和煙酸。膽固醇研究員丹尼爾·斯坦伯格寫道,雖然1984年的冠心病一級預防試驗表明,降低膽固醇可以顯著降低心臟病發作和心絞痛的風險,但包括心臟病專家在內的醫生仍然持懷疑態度。為了有效地將他汀類藥物推向市場,默克必須讓人們相信高膽固醇的危害,以及他汀類藥物的安全性和延長壽命的效果。由於公眾宣傳的成果,人們開始熟悉自己的膽固醇數值,以及“好”膽固醇和“壞”膽固醇之間的區別,而競爭對手製藥公司也開始生產自己的他汀類藥物,例如普伐他汀(普羅卡,Pravachol),由三共和百時美施貴寶公司生產。1994年4月,默克公司贊助的一項研究,即“斯堪的納維亞辛伐他汀生存研究”或“4S”的結果公佈。研究人員對4,444名患有高膽固醇和心臟病的患者進行了辛伐他汀(後來由默克公司以卓維爾的名稱銷售)的測試。5年後,研究得出結論,患者的膽固醇降低了35%,死於心臟病發作的可能性降低了42%。1995年,卓維爾和美降脂都為默克公司帶來了超過10億美元的收入。遠藤章獲得了2006年日本獎和2008年拉斯克-德貝基臨床醫學研究獎。他汀類藥物透過競爭性抑制HMG-CoA還原酶(HMG-CoA還原酶途徑中的第一個關鍵酶)發揮作用。由於他汀類藥物在分子水平上與HMG-CoA相似,因此它們取代了HMG-CoA在酶中的位置,並降低了其產生甲羥戊酸(最終產生膽固醇以及其他一些化合物的級聯反應中的下一個分子)的速率。這最終通過幾種機制降低了膽固醇[25]。
他汀類藥物的作用機制
[edit | edit source]抑制膽固醇合成 抑制HMG-CoA還原酶,他汀類藥物會阻斷肝臟合成膽固醇的途徑。這一點很重要,因為大多數迴圈膽固醇來自內部製造而不是飲食。當肝臟不再能產生膽固醇時,血液中的膽固醇水平就會下降。膽固醇合成似乎主要在夜間發生,因此半衰期短的他汀類藥物通常在晚上服用,以最大限度地發揮其作用。研究表明,在晚上服用短效辛伐他汀比在早上服用能更好地降低低密度脂蛋白膽固醇和總膽固醇,但在長效阿託伐他汀中沒有發現差異。
增加低密度脂蛋白攝取 肝細胞感知到肝臟膽固醇水平下降,並試圖透過合成低密度脂蛋白受體來補償,從而從迴圈中吸取膽固醇。這是透過蛋白酶完成的,蛋白酶裂解一種稱為“膜結合固醇調節元件結合蛋白”的蛋白質,該蛋白質遷移到細胞核並導致各種其他蛋白質和酶的產生增加,包括低密度脂蛋白受體。然後,低密度脂蛋白受體重新定位到肝細胞膜,並與經過的低密度脂蛋白和極低密度脂蛋白顆粒(與疾病相關的“壞膽固醇”)結合。低密度脂蛋白和極低密度脂蛋白被從迴圈中吸收到肝臟,在那裡膽固醇被重新加工成膽汁鹽。這些膽汁鹽被排出體外,隨後大部分透過內部膽汁鹽迴圈被回收利用。
其他作用 他汀類藥物除了降低脂質外,還表現出其他作用,可以預防動脈粥樣硬化。ASTEROID試驗顯示,他汀類藥物治療期間,動脈粥樣硬化斑塊的超聲波影像直接表明其消退。研究人員推測,他汀類藥物透過四種機制(所有這些都是大量生物醫學研究的主題)來預防心血管疾病:改善內皮功能,調節炎症反應,維持斑塊穩定性,預防血栓形成。他汀類藥物甚至可能對那些沒有高膽固醇的人有益。2008年,JUPITER研究表明,即使是那些沒有高膽固醇或心臟病史,但只有C反應蛋白水平升高的人,其卒中、心臟病發作和手術次數也更少。癌症死亡減少,導致總死亡率減少了20%,但心血管疾病造成的死亡率沒有減少。
他汀類藥物的不良反應 最常見的不良反應是肝酶升高和肌肉問題。在隨機對照臨床試驗中,報道的不良反應率很低;但他們在“現實世界使用研究中更高”,並且更多樣化。在隨機試驗中,他汀類藥物與安慰劑相比,不良反應風險增加了39%(優勢比為1.4);其中三分之二為肌痛或肝酶升高,嚴重不良反應與安慰劑相似。然而,依賴臨床試驗可能會誤導現實世界不良反應的指示——例如,他汀類藥物塞瑞瓦他汀於2001年從市場上撤回,原因是出現了橫紋肌溶解症(肌肉分解)病例,儘管塞瑞瓦他汀臨床試驗的薈萃分析中沒有出現橫紋肌溶解症。其他可能的不良反應包括認知障礙、神經病變、胰腺和肝功能障礙以及性功能障礙。一些服用他汀類藥物的患者報告肌痛、肌肉痙攣,或較少見的是胃腸道或其他症狀。肝酶異常也可能發生,通常發生在約0.5%的患者中,安慰劑的使用率和重複的酶測試中也觀察到類似的發生率,並且通常在沒有停藥的情況下隨著時間的推移恢復正常,或者在短暫停藥後恢復正常。其他許多副作用很少發生;通常在大型他汀類藥物安全/療效試驗中,僅安慰劑組的發生率也相似。兩項隨機對照臨床試驗發現認知問題,而另兩項沒有發現認知問題;重新引入後復發表明,在某些人中,這些問題與他汀類藥物之間存在因果關係。2002年發表的一項丹麥病例對照研究表明,長期服用他汀類藥物與神經損傷或多發性神經病的風險增加之間存在關聯,但表明這種副作用“很少見,但確實存在”;其他研究人員指出,在涉及50,000人的試驗中,他汀類藥物的有效性研究並沒有顯示神經損傷是一種重要的副作用[26]。
乙醯輔酶A羧化酶 (ACC):
原核生物 和 植物 具有多亞基ACC,由不同基因編碼的多個多肽組成。生物素羧化酶 (BC) 活性、生物素羧基載體蛋白 (BCCP) 和羧基轉移酶 (CT) 活性分別包含在一個不同的亞基中。這些亞基在ACC 全酶 中的化學計量學在不同生物體之間有所不同。 人類 和大多數 真核生物 進化出了一種ACC,其具有CT和BC催化域,以及單個多肽上的生物素羧基載體域。從 N端 到 C端 的ACC功能區域分別是生物素羧化酶 (BC)、生物素結合 (BB)、羧基轉移酶 (CT) 和ATP結合 (AB)。AB位於BC內。 生物素 透過醯胺鍵共價連線到BB中賴氨酸殘基的長 側鏈 上。由於BB位於BC和CT區域之間,生物素可以輕鬆地轉移到需要它的兩個活性位點。
在表達兩種ACC同工型的哺乳動物中,這些同工型之間的主要結構差異是ACC2的N端擴充套件,包含線粒體靶向序列。
ACAC(A,B) 的總體反應透過兩步機制進行。[27] 第一個反應是由BC完成的,它涉及用 碳酸氫鹽 作為CO 2 來源,對 生物素 進行ATP依賴性羧化。羧基從 生物素 轉移到 乙醯輔酶A,在第二個反應中形成 丙二醯輔酶A,該反應由CT催化。
在 活性位點 的背景下,反應在Glu296的殘基以及帶正電荷的Arg338和Arg292與底物之間的廣泛相互作用下進行。[28] 兩個Mg2+ 與 ATP 上的磷酸基團配位,並且是ATP與酶結合所必需的。碳酸氫鹽被Glu296去質子化,儘管在溶液中,這種質子轉移不太可能發生,因為 碳酸氫鹽 的 pKa 為10.3。該 酶 顯然操縱 pKas 來促進碳酸氫鹽的去質子化。 碳酸氫鹽 的pKa 透過與Arg338和Arg292帶正電荷的側鏈的相互作用而降低。此外,Glu296 與Glu211的側鏈相互作用,這種相互作用已被證明會導致表觀pKa的增加。在碳酸氫鹽去質子化後,碳酸氫鹽的氧氣作為 親核試劑,攻擊ATP上的γ磷酸。羧基磷酸中間體迅速分解成CO 2 和PO 4 3- 。PO 4 3- 去質子化生物素,產生一個烯醇負離子,該烯醇負離子被Arg338穩定,隨後攻擊[[CO 2 ]],導致生成羧基生物素。[28] 羧基生物素轉移到羧基轉移酶 (CT) 活性位點,在那裡羧基轉移到乙醯輔酶A。與BC結構域相反,對CT反應機制知之甚少。一種提議的機制是生物素釋放 二氧化碳,然後從乙醯輔酶A羧化酶的甲基中奪取一個質子。生成的 烯醇負離子 攻擊CO 2,形成丙二醯輔酶A。在一種競爭機制中, 質子 的提取與乙醯輔酶A的攻擊是協同的。ACAC的功能是調節脂肪酸的代謝。當酶處於活性狀態時,會產生產物丙二醯輔酶A,它是新脂肪酸的組成部分,並且可以抑制脂肪醯基從醯基輔酶A到肉鹼的轉移,肉鹼醯基轉移酶抑制線粒體中脂肪酸的β氧化。在哺乳動物中,表達了兩種主要的ACC同工型,ACC1和ACC2,它們在組織分佈和功能方面都不同。ACC1存在於所有細胞的細胞質中,但在脂肪組織和泌乳乳腺等脂肪生成組織中富含,這些組織中脂肪酸合成很重要。在氧化組織(如骨骼肌和心臟)中,表達的ACC2比例更高。ACC1和ACC2在肝臟中高表達,肝臟中脂肪酸氧化和合成都很重要。組織分佈的差異表明,ACC1維持脂肪酸合成的調節,而ACC2主要調節脂肪酸氧化。
非甲羥戊酸途徑或MEP/DOXP途徑
[edit | edit source]經典的甲羥戊酸途徑或 HMG-CoA 還原酶途徑是存在於所有高等真核生物和許多細菌中的一種重要的細胞代謝途徑。它對於 IPP 和 DMAPP 的產生至關重要,IPP 和 DMAPP 是用於蛋白質預烯基化、細胞膜維持、激素、蛋白質錨定和N-糖基化等多種過程的生物合成分子的基礎。
與經典的類異戊二烯生物合成甲羥戊酸途徑相反,植物和頂復門原生動物,如瘧疾寄生蟲,能夠利用另一種途徑,即非甲羥戊酸途徑來產生它們的類異戊二烯(萜類),該途徑發生在它們的質體中。[29] 此外,大多數細菌,包括重要的病原體,如結核分枝桿菌,透過非甲羥戊酸途徑合成 IPP 和 DMAPP。

{{cite journal}}: CS1 maint: uses authors parameter (link) 請注意,該來源使用的酶名稱和縮寫既不全面也不標準(參見Eisenreich W, Bacher A, Arigoni D, Rohdich F (2004). "Biosynthesis of Isoprenoids Via the Non-mevalonate Pathway". Cell. Mol. Life Sci. 61 (12): 1401–26. doi:10.1007/s00018-004-3381-z. PMID 15197467. Retrieved March 23, 2017.{{cite journal}}: CS1 maint: multiple names: authors list (link));因此,影像內容必須與三個相關門/界中任何一個途徑的標準酶名稱和縮寫相協調。有關說明,請參閱英文維基百科的“非甲羥戊酸途徑”文章。反應如下:[30]
| 反應物 | 酶 | 產物 | |
| 丙酮酸和3-磷酸甘油醛 | DOXP 合成酶 (Dxs) | 1-脫氧-D-木酮糖-5-磷酸 (DOXP) |  |
| DOXP | DOXP 還原酶 (Dxr, IspC) | 2-C-甲基赤蘚糖醇-4-磷酸 (MEP) |  |
| MEP | 4-二磷酸胞苷-2-C-甲基-D-赤蘚糖醇合成酶 (YgbP, IspD) | 4-二磷酸胞苷-2-C-甲基赤蘚糖醇 (CDP-ME) |  |
| CDP-ME | 4-二磷酸胞苷-2-C-甲基-D-赤蘚糖醇激酶 (YchB, IspE) | 4-二磷酸胞苷-2-C-甲基-D-赤蘚糖醇-2-磷酸 (CDP-MEP) | |
| CDP-MEP | 2-C-甲基-D-赤蘚糖醇-2,4-環二磷酸合成酶 (YgbB, IspF) | 2-C-甲基-D-赤蘚糖醇-2,4-環焦磷酸 (MEcPP) |  |
| MEcPP | HMB-PP 合成酶 (GcpE, IspG) | (E)-4-羥基-3-甲基-丁-2-烯基焦磷酸 (HMB-PP) |  |
| HMB-PP | HMB-PP 還原酶 (LytB, IspH) | IPP 和 DMAPP |   |
磷黴素是一種抗生素,它特異性地抑制 DXP 還原異構酶,這是一種類異戊二烯生物合成非甲羥戊酸途徑中的關鍵酶。它是一種 2-C-甲基-D-赤蘚糖醇-4-磷酸的結構類似物。它以 38 nM (4) 的 KI 值抑制大腸桿菌酶,以 80 nM 抑制 MTB,以 99 nM 抑制弗朗西斯菌酶。瘧疾寄生蟲中非甲羥戊酸途徑的發現表明了使用磷黴素和其他此類抑制劑作為抗瘧藥物。事實上,磷黴素已與克林黴素聯用治療瘧疾,並取得了良好的結果。據證實,在致死性瘧疾寄生蟲惡性瘧原蟲中,靶酶(DXP 還原異構酶)的複製數增加與體外磷黴素耐藥性相關。
參考文獻
[edit | edit source]- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Testosterone&oldid=425129619
- ↑ http://en.wikipedia.org/w/index.php?title=Anabolic_steroid&oldid=425234650
- ↑ http://en.wikipedia.org/w/index.php?title=Cholesterol&oldid=425127311
- ↑ http://en.wikipedia.org/w/index.php?title=Cholesterol&oldid=425127311
- ↑ Lichtenthaler H (1999). "植物類異戊二烯生物合成的 1-脫氧-D-木酮糖-5-磷酸途徑". Annu Rev Plant Physiol Plant Mol Biol. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ↑ a b 堪薩斯大學醫學中心 (2004). "類二十烷酸和炎症" (PDF). 檢索於 2007-01-05. [失效連結] 無效的
<ref>標記;名稱 "University" 定義了多次,內容不同 - ↑ Soberman, Roy J. 和 Christmas, Peter (2003). "類二十烷酸訊號傳導的組織及其後果". J. Clin. Invest. 111 (8): 1107–1113. doi:10.1172/JCI200318338. PMC 152944. PMID 12697726. 檢索於 2007-01-05.
{{cite journal}}: CS1 維護:多個名稱:作者列表 (link) - ↑ Cyrus, Tillmann; Witztum, Joseph L.; Rader, Daniel J.; Tangirala, Rajendra; Fazio, Sergio; Linton, Macrae F.; Funk, Colin D. (1999). "12/15-脂氧合酶基因的破壞減少了 Apo E 缺陷小鼠的動脈粥樣硬化". J Clin Invest. 103 (11): 1597–1604n. doi:10.1172/JCI5897. PMC 408369. PMID 10359569.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Schewe T. (2002 年 3 月 - 4 月). "15-脂氧合酶-1:一種促氧化酶". Biol Chem. 383 (3–4): 365–74. doi:10.1515/BC.2002.041. PMID 12033428.
{{cite journal}}:|access-date=requires|url=(help); Check date values in:|year=(help) - ↑ '醫學生物化學基礎,Lieberman、Marks 和 Smith 編,第 432 頁,2007 年'
- ↑ Chen, H;Born, E;Mathur, S N;Field, F J, J Lipid, Res Dec12 2159-67 培養的人腸道細胞(CaCo-2)中膽固醇和鞘磷脂的合成是獨立調控的:膜膽固醇和鞘磷脂含量的作用 ¦Volume= 34 ¦Year= 1993 ¦PMID=8301234 ¦ISBN=0022-2275
- ↑ de Meyer F, Smit B. 膽固醇對磷脂雙分子層結構的影響。Proc Natl Acad Sci U S A 2009; 106: 3654-8.
- ↑ Lang T, Bruns D, Wenzel D, Riedel D, Holroyd P, Thiele C, Jahn R. SNARE 蛋白濃縮在膽固醇依賴性簇中,定義了胞吐作用的停靠和融合位點 EMBO J 2001;20:2202-13.
- ↑ a b Koga Y, Morii H (2007). "古菌中醚型極性脂類的生物合成及其進化意義". Microbiol. Mol. Biol. Rev. 71 (1): 97–120. doi:10.1128/MMBR.00033-06. PMC 1847378. PMID 17347520.
- ↑ http://en.wikipedia.org/w/index.php?title=Archaea&oldid=423838280
- ↑ De Rosa M, Gambacorta A, Gliozzi A (1986 年 3 月 1 日). "古細菌脂類的結構、生物合成和理化性質". Microbiol. Rev. 50 (1): 70–80. PMC 373054. PMID 3083222.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Albers SV, van de Vossenberg JL, Driessen AJ, Konings WN (2000). "古菌細胞膜對熱脅迫的適應". Front. Biosci. 5: D813–20. doi:10.2741/albers. PMID 10966867.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Damsté JS, Schouten S, Hopmans EC, van Duin AC, Geenevasen JA (2002). "Crenarchaeol:廣泛分佈的遠洋古菌群的特徵性核心甘油雙二植烷基甘油四醚膜脂類". J. Lipid Res. 43 (10): 1641–51. doi:10.1194/jlr.M200148-JLR200. PMID 12364548.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Koga Y, Morii H (2005). "古菌中醚脂結構研究的最新進展,包括比較和生理學方面". Biosci. Biotechnol. Biochem. 69 (11): 2019–34. doi:10.1271/bbb.69.2019. PMID 16306681.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Hanford MJ,Peeples TL(2002)。“古細菌四醚脂類:獨特的結構和應用”。Appl。生物化學。生物技術。97(1):45-62。 doi:10.1385/ABAB:97:1:45。 PMID 11900115.
{{cite journal}}: 未知引數|month=忽略 (幫助) - ↑ Macalady JL,Vestling MM,Baumler D,Boekelheide N,Kaspar CW,Banfield JF(2004)。“鐵質體屬中的四醚連線膜單層:酸性環境中生存的關鍵”。極端微生物。8(5):411-9。 doi:10.1007/s00792-004-0404-5。 PMID 15258835.
{{cite journal}}: 未知引數|month=忽略 (幫助)CS1 維護:多個名稱:作者列表 (連結) - ↑ http://en.wikipedia.org/w/index.php?title=Terpene&oldid=425141133
- ↑ http://en.wikipedia.org/w/index.php?title=Mevalonate_pathway&oldid=404974883
- ↑ http://en.wikipedia.org/w/index.php?title=Statin&oldid=425079417
- ↑ http://en.wikipedia.org/w/index.php?title=Statin&oldid=425079417
- ↑ Lee CK,Cheong HK,Ryu KS,Lee JI,Lee W,Jeon YH,Cheong C(2008 年 8 月)。“人乙醯輔酶 A 羧化酶的生物素醯基結構域:羧基轉移機制的結構洞察”。蛋白質。72(2):613-24。 doi:10.1002/prot.21952。 PMID 18247344.
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ a b Chou CY,Yu LP,Tong L(2009)。“生物素羧化酶與底物的複合物晶體結構及其催化機制的啟示”。J。生物化學。284(17):11690-7。 doi:10.1074/jbc.M805783200。 PMC 2670172。 PMID 19213731.
{{cite journal}}: 未知引數|month=忽略 (幫助)CS1 維護:多個名稱:作者列表 (連結) - ↑ Lichtenthaler H(1999)。“植物中類異戊二烯生物合成的 1-脫氧-D-木酮糖-5-磷酸途徑”。安努 Rev 植物生理學植物分子生物學。50:47-65。 doi:10.1146/annurev.arplant.50.1.47。 PMID 15012203.
- ↑ Eisenreich W,Bacher A,Arigoni D,Rohdich F。透過非甲羥戊酸途徑合成類異戊二烯。細胞分子生命科學。2004;61:1401-1426。 PMID 15197467









