蛋白質組學/翻譯後修飾/氨基修飾
本節

蛋白質在翻譯後會經歷一種稱為翻譯後修飾的化學修飾。這些修飾可能透過改變氨基酸的化學性質或透過結構變化(如摺疊、構象分佈、穩定性、活性等)來改變蛋白質的功能,例如透過新增像乙酸鹽這樣的生化官能團。
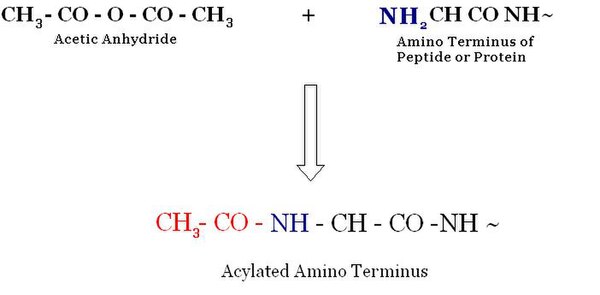
乙醯化是一種醯化(向有機化合物中引入醯基)過程,它涉及用乙酸的有機基團取代 N 端的活性氫原子。
在真核生物中,最廣泛的修飾是蛋白質 N 端 α-胺基的乙醯化。大約 50% 的酵母蛋白質和大約 90% 的人類蛋白質透過這種機制進行修飾。修飾模式在整個進化過程中都是保守的。儘管這是一種非常常見的修飾,但關於 N-α-末端乙醯化的生物學功能的資訊並不多。N-α-乙醯轉移酶 (NATs) 是負責乙醯化的酶。NATs 屬於 GNAT 家族,該家族位於乙醯轉移酶超家族之下。[1]
乙醯化和去乙醯化發生在組蛋白乙醯化和去乙醯化中 N 端尾部的賴氨酸殘基上。這些反應在組蛋白乙醯轉移酶 (HAT) 或組蛋白去乙醯化酶 (HDAC) 酶的存在下進行。
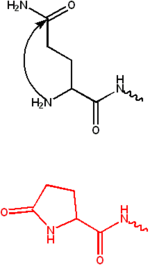
焦穀氨酸是透過谷氨醯胺的環化(化學化合物中形成環)形成的。它通常在抗體中觀察到,這些抗體在它們的 N 端含有穀氨酸或谷氨醯胺殘基。氨基和穀氨酸或谷氨醯胺縮合成一個五元環,稱為焦穀氨酸。該殘基使蛋白質對氨基肽酶更具抵抗力,並具有許多功能作用。[2]
它在 N 端 α-螺旋處保持結構完整性,併為電離組氨酸殘基的催化和對HeLa細胞的細胞毒性提供合適的環境。
N-肉豆蔻醯化也是一種醯化過程,發現它對蛋白質中 N 端氨基酸甘氨酸具有特異性,其中肉豆蔻醯基(源自肉豆蔻酸)透過醯胺鍵與 N 端甘氨酸的 α-氨基共價連線。肉豆蔻醯化在真核生物的二級細胞訊號傳導、逆轉錄病毒的感染力和致癌中起著至關重要的作用。它還影響鈣結合蛋白的生理功能。[3] 胞質酶 N-肉豆蔻醯轉移酶 (NMT) 催化肉豆蔻醯化。
觀察到的蛋白質甲基化是最常見的翻譯後修飾形式。與其他翻譯後修飾類似,蛋白質甲基化參與調節蛋白質-蛋白質相互作用,從而在關鍵的細胞事件中產生大量影響,包括轉錄調控[4] [5] [6] 應激反應、衰老和蛋白質修復[7] T 細胞啟用[8]、核轉運[9]、神經元分化[10] [11]、離子通道功能和細胞因子訊號傳導。當一個甲基基團被新增到一個或多個親核側鏈上時,蛋白質被認為是甲基化的。側鏈氮上的甲基化被認為是不可逆的,而羧基上的甲基化可能是可逆的。蛋白質中氮上發生甲基化的殘基包括賴氨酸的 ε-胺、組氨酸的咪唑環、精氨酸的胍基以及谷氨醯胺和天冬醯胺的側鏈醯胺氮。

蛋白質中的甲基化抵消了蛋白質上的負電荷,並增加了蛋白質的疏水性。羧酸酯側鏈上的甲基化掩蓋了負電荷,並增加了疏水性。賴氨酸的 N-甲基化不會改變陽離子電荷,但會增加疏水性。特別是,蛋白質中賴氨酸側鏈的二甲基化和三甲基化既增加了疏水性又增加了空間位阻,如果它們位於相互作用表面,則會影響蛋白質-蛋白質相互作用。
當異氰酸 (HCNO) 與蛋白質的氨基末端殘基(如賴氨酸)反應時,就會發生氨甲醯化。它是公認的 等電聚焦 中常見的蛋白質人工修飾之一。風險因素是溶液中存在的尿素(致混沌劑),它與氨基甲酸 氰酸鹽 處於平衡狀態。異氰酸是與蛋白質氨基反應的氰酸鹽形式。為了發生氨甲醯化,蛋白質的氨基酸基團(如賴氨酸、精氨酸側鏈)應該被去質子化,這通常發生在鹼性 pH 值下。當蛋白質在尿素溶液中在室溫下放置,並且異氰酸可以自由地與蛋白質反應時,就會發生氨甲醯化。
異氰酸引起的氨甲醯化對蛋白質表徵的下一步不利,因為異氰酸與蛋白質的氨基末端反應,阻礙了肽或蛋白質進行 N 末端測序。異氰酸攻擊賴氨酸和精氨酸殘基的側鏈,使蛋白質不適合許多酶消化。即使氨甲醯化不阻止酶消化,它也會經常混淆來自 質譜 實驗的結果,因為肽具有意外的保留時間和質量。在幾種疾病狀態下觀察到體內蛋白質的氨甲醯化。[12]
甲醯化
[edit | edit source]甲醯化是蛋白質的翻譯後修飾之一,其中蛋白質透過連線甲醯基進行修飾。最常研究的機制是賴氨酸的 N6-甲醯化,它與組蛋白和其他核蛋白相關。組蛋白和其他染色質蛋白的翻譯後修飾在 基因表達 的生理學中起作用。“N6-甲醯賴氨酸殘基似乎代表了內源性組蛋白次級修飾,這種修飾與賴氨酸 N6-乙醯化在化學上相似,被認為是哺乳動物細胞中基因表達的重要決定因素。”研究得出結論,賴氨酸的 N6-甲醯化修飾會干擾乙醯化和甲基化的訊號功能,這些功能在氧化和亞硝化應激的生理學中起作用。[13]
參考文獻
[edit | edit source]- ↑ 維基百科 : 乙醯化 [1]
- ↑ 牛前阿片黑素皮質素的翻譯後修飾。酪氨酸硫酸化和焦穀氨酸形成,一項質譜研究。A Bateman、S Solomon 和 HP Bennett.J. Biol. Chem., Vol. 265, Issue 36, 22130-22136, 12, 1990[2]
- ↑ N 末端肉豆蔻醯化調節神經元鈣感測器-1 中鈣誘導的構象變化。Andreas Jeromin、Dasari Muralidhar、Malavika Nair Parameswaran、John Roder、Thomas Fairwell、Suzanne Scarlata、Louisa Dowal、Sourajit M. Mustafi、Kandala V. R. Chary 和 Yogendra Sharma J. Biol. Chem., Vol. 279, Issue 26, 27158-27167, June 25, 2004[3]
- ↑ Clarke S: 年齡作為化學和生化過程之間的戰爭:蛋白質甲基化和識別受損蛋白質以修復。衰老研究評論 2003, 2(3):263-285。
- ↑ Blanchet F、Cardona A、Letimier FA、Hershfield MS、Acuto O: CD28 共刺激訊號在 T 細胞中誘導蛋白質精氨酸甲基化。實驗醫學雜誌 2005, 202(3):371-377。
- ↑ Smith WA、Schurter BT、Wong-Staal F、David M: RNA 解旋酶 a 的精氨酸甲基化決定了它的亞細胞定位。生物化學雜誌 2004, 279(22):22795-22798。
- ↑ Kujubu DA、Stimmel JB、Law RE、Herschman HR、Clarke S: PC-12 細胞對 NGF 和 EGF 的早期反應:K252a 和 5'-甲硫腺苷對基因表達和膜蛋白甲基化的影響。神經科學研究雜誌 1993, 36(1):58-65.
- ↑ Cimato TR、Ettinger MJ、Zhou X、Aletta JM: 神經生長因子特異性調節 PC12 細胞神經元分化過程中的蛋白質甲基化。細胞生物學雜誌 1997, 138(5):1089-1103
- ↑ Vemuri R、Philipson KD: 蛋白質甲基化抑制心臟肌漿網囊泡中的 Na+-Ca2+ 交換活性。生物化學與生物物理學報 1988, 939(3):503-508.
- ↑ Chen YF、Zhang AY、Zou AP、Campbell WB、Li PL: 蛋白質甲基化啟用從冠狀動脈肌細胞重建的柳葉鹼受體-鈣釋放通道。血管研究雜誌 2004, 41(3):229-240.
- ↑ Mowen KA、Schurter BT、Fathman JW、David M、Glimcher LH: NIP45 的精氨酸甲基化調節效應 T 淋巴細胞中細胞因子的基因表達。分子細胞 2004, 15(4):559-571.
- ↑ 蛋白質組分析的轉折點:使用具有等電膜的多隔室電解器進行樣品預分級。Herbert B、Righetti PG.[4]
- ↑ 賴氨酸的 Nepsilon-甲醯化是核蛋白的廣泛翻譯後修飾,發生在參與染色質功能調節的殘基上 (PMID: 18056081)。Wisniewski JR、Zougman A、Mann M. [5]



