蛋白質組學/蛋白質樣品製備/質譜分析樣品製備
質譜 (MS) 被證明是蛋白質組學中更靈敏的技術之一,雖然使其成為一項非常有用的技術,但也使其容易受到嚴格的樣品製備要求的影響。任何特定質譜實驗的條件最終將決定必要的製備程度和型別,但一些概念可以應用於任何質譜實驗,例如富集和分級分離。此外,由於目前越來越重視涉及質譜的高通量技術,因此對用於蛋白質和肽提取的上游質譜自動化和簡化的樣品製備工具的需求也日益增長。
任何蛋白質組學實驗,尤其是質譜實驗的第一步,通常是降低樣品的複雜性;或對樣品進行分級分離。分級分離的目標通常是去除“蛋白質組中高丰度的組分”[1],然後是“隨後對中等至低丰度的蛋白質進行分級分離”[1],以產生濃縮的蛋白質樣品,這些蛋白質有可能具有臨床相關性。有許多可用的分級分離方案和工具,並且使用不止一種方法來充分減少樣品的複雜性並不少見。可以根據大小、電荷、疏水性和/或結合親和力對蛋白質樣品進行分級分離。這些特性通常是許多可用試劑盒的基礎,這些試劑盒能夠透過從樣品(如血清)中分離出高丰度蛋白質來富集樣品。此類試劑盒的例子包括貝克曼庫爾特公司的ProteomeLab IgY-12離心和液相色譜柱試劑盒,該試劑盒“選擇性地分離血清或血漿中發現的12種高丰度蛋白質”[1],或Bio-Rad公司的ReadyPrep蛋白質提取試劑盒,該試劑盒“根據細胞位置(細胞質/細胞核部分、膜蛋白以及專門參與細胞內訊號傳導的膜蛋白)對蛋白質混合物進行分級分離”。[1]
與大多數其他蛋白質組學實驗相比,在將蛋白質樣品引入質譜儀之前,樣品的淨化更為重要,這主要是由於該技術的靈敏度,但也因為“髒樣品”可能對儀器造成相當大的損害。
在質譜靈敏度方面,“需要去除蛋白質組學樣品製備中常用的去汙劑、[離子抑制]鹽和變性劑以提高溶解度”[1],因為它們會影響分析。在為質譜淨化樣品時,可以使用本章汙染物去除部分中描述的任何數量的概念。最後,應該注意的是,在試圖最大化資料質量的同時,保持對蛋白質產量的認識非常重要。[1]
在此處插入與蛋白質和肽的18O標記相關的資訊。
- ↑ a b c d e f Glaser, V. (2006) 質譜上游樣品製備:進展側重於樣品淨化、分級分離和分離。基因工程與生物技術新聞(第 26 卷,第 10 期)。獲取自 http://www.genengnews.com/articles/chitem.aspx?aid=1667&chid=1
2. 病原體全面蛋白質表徵的蛋白質組學樣品製備程式最佳化 Heather M. Mottaz-Brewer、Angela D. Norbeck、Joshua N. Adkins、Nathan P. Manes、Charles Ansong、Liang Shi、Yasuko Rikihisa、Takane Kikuchi、Scott W. Wong、Ryan D. Estep、Fred Heffron、Ljiljana Pasa-Tolic 和 Richard D. Smith=系統(http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=2628077&tool=pmcentrez)
3. http://www.flickr.com/photos/92329000@N00/387807596/
- Jörg von Hagen,VCH-Wiley 2008 蛋白質組學樣品製備。 ISBN 978-3-527-31796-7
Heather M. Mottaz-Brewer、Angela D. Norbeck、Joshua N. Adkins、Nathan P. Manes、Charles Ansong、Liang Shi、Yasuko Rikihisa、Takane Kikuchi、Scott W. Wong、Ryan D. Estep、Fred Heffron、Ljiljana Pasa-Tolic 和 Richard D. Smith J Biomol Tech. 2008 年 12 月;19(5):285–295。PMCID:PMC2628077
主要關注點
實驗可以得出的結果取決於所用樣品的製備方式。最佳化樣品製備步驟以獲得更好的質譜結果,有助於更好地理解宿主病原體相互作用。
摘要

質譜可用於蛋白質組學,以瞭解病原體與宿主的相互作用。但是,在任何分析中,結果在很大程度上取決於所用樣品的特性。改變實驗中樣品的製備方式可以帶來更好的結果。樣品處理中有很多不同的步驟可以進行最佳化以獲得更好的結果。但是,需要繪製影響圖以確定對樣品製備程式所做的更改。例如,選擇性的提高會導致靈敏度的降低,反之亦然。還必須考慮生物量損失。可以最佳化的不同步驟包括
- 目標蛋白 - 應識別目標蛋白並找出其可能的位置。實驗設計應牢記這一點。
- 生長條件 - 可以設計最適合特定宿主病原體的生長條件
- 樣品製備 - 可以更改所用樣品的大小及其製備方式,以便針對每個實驗進行最佳化
- 樣品分析平臺 - 應考慮用於分析樣品的平臺
- 資料分析 – 發現的資料如何進行分析非常重要。由於並非所有細菌研究都經過了最佳測序,因此最佳的資料分析發揮著重要作用。
調整上述的不同步驟可以帶來更好的結果,從而找出病原體和宿主之間的相互作用,最終導致藥物的發現。
新術語
- HeLa細胞
- 用於研究的永生細胞系,來源於海拉·拉克斯的宮頸癌細胞(http://en.wikipedia.org/wiki/HeLa)
- BCA蛋白測定法
- 雙縮脲酸測定法是一種用於測定溶液中蛋白質總量或蛋白質濃度的測定方法。顏色從綠色變為紫色的程度表明蛋白質的含量。
- SPE(固相萃取)
- 這是一種分離過程,用於根據其物理和化學性質從雜質混合物中去除某些化合物(http://en.wikipedia.org/wiki/Solid_Phase_Extraction)
- 影響圖
- 它是決策情境的緊湊圖形和數學表示。它是貝葉斯網路的推廣,不僅可以對機率推理問題進行建模和求解,還可以對決策問題(遵循最大期望效用準則)進行建模和求解。(http://en.wikipedia.org/wiki/Influence_diagram)
- 脂質組學
- 細胞脂質的通路和網路研究。
課程相關性
- 本文討論了樣品製備和樣品分析在實驗分析中的重要性。它告訴我們可以在各個步驟中進行不同的最佳化以獲得更好的結果。
賽默飛世爾科技(http://www.piercenet.com/products/browse.cfm?fldID=69893E05-475D-4DA1-9DE5-D37CCFA31DF7&Format=Print)
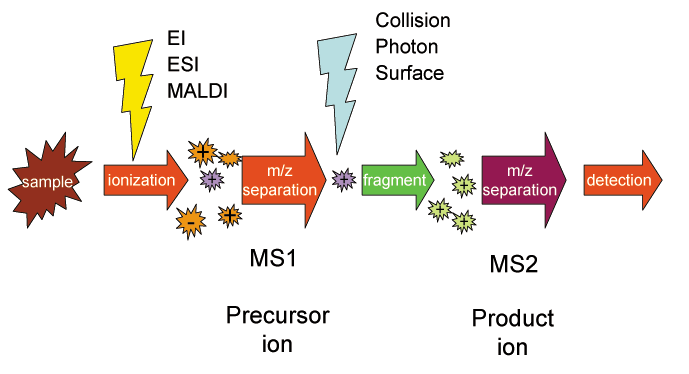
串聯質譜示意圖
主要關注點
可用於最佳化質譜結果的不同樣品製備試劑盒和試劑
摘要
該網站介紹了可用於最佳化樣品製備的不同試劑和試劑盒。可用的不同試劑盒包括:
- SILAC試劑盒和試劑 - 用於在細胞培養中使用氨基酸進行穩定同位素標記的試劑盒。它可以定量和識別蛋白質樣品中相對差異變化。
- 串聯質譜標籤技術 - 等壓化學標籤,能夠同時識別和定量不同樣品中的蛋白質。
- 氘代交聯劑的使用
- 用於最佳化樣品製備的二維樣品製備試劑盒和白蛋白去除試劑盒
- SilverSNAP染色劑,用於二維凝膠的銀染,以提高靈敏度
- 強離子交換離心柱,用於輕鬆、更好的純化
- 三氟乙酸,用於反相肽分離
- 甲酸安瓿瓶,作為無汙染的替代品,用於製備用於蛋白質和肽的HPLC分離的洗脫溶劑
- PepClean C18離心柱,用於在不到30分鐘內純化或濃縮多個肽樣品
- 蛋白質沉澱板,用於目標分子分離
- 磷酸肽分離試劑盒,用於從複雜的蛋白質消化物中分離磷酸化肽
- MALDI分析基質
新術語
- SILAC(細胞培養中氨基酸的穩定同位素標記)
- 一種基於質譜的技術,用於檢測兩個(或多個)樣品之間蛋白質丰度的差異(http://en.wikipedia.org/wiki/SILAC)
- 氘代交聯劑
- 化學試劑,在質譜研究中使用時,與非氘代類似物交聯的蛋白質相比,會產生達爾頓位移。這兩種類似物可用於蛋白質和肽的同位素標記。
- 洗脫
- 化學物質從色譜柱中出現。
- MALDI
- 基質輔助雷射解吸電離(MALDI)是一種用於質譜的軟電離技術,可以分析生物分子(如蛋白質、肽和糖等生物聚合物)和大型有機分子(如聚合物、樹枝狀聚合物和其他大分子),這些分子在用更傳統的電離方法電離時往往很脆弱並會發生碎裂(http://en.wikipedia.org/wiki/MALDI-TOF)
課程相關性
該網站詳細介紹了可以在蛋白質組學實驗室中用來最佳化樣品製備的不同工具和試劑盒。
- 基於MS的蛋白質組學中的18O穩定同位素標記
葉曉英、布萊恩·盧克、托克爾·安德森和約西普·布隆德爾。功能基因組學和蛋白質組學簡報。第8卷。第2號。136-144。http://www.ncbi.nlm.nih.gov/pubmed/19151093
- 審稿人:亞瑟·普林西比
- 本文綜述了一種使用18O同位素進行蛋白質組學研究的質譜(MS)標記技術。文章對該技術的歷史和原理進行了詳盡的背景介紹,然後解釋了不同的具體技術應用。文章最後對最佳實踐情況進行了評估。該技術應用的領域包括:全域性蛋白質組學研究、靶向蛋白質組學研究和翻譯後修飾。
- 18O標記
- 使用氧同位素18O作為標記,透過摻入蛋白質或肽中。
- (http://pubs.acs.org/doi/abs/10.1021/ac010043d)
- 酶介導的同位素摻入
- 使用酶作為催化劑來引發導致同位素摻入的化學反應。
- (http://en.wikipedia.org/wiki/Enzyme_kinetics)
- 穩定同位素標記
- 使用尚未觀察到衰變的同位素作為標記。
- (http://en.wikipedia.org/wiki/Stable_isotope)
- 基於MS的蛋白質組學
- 透過向分析物中新增穩定同位素並觀察質量位移來區分蛋白質的相對數量。
- (http://en.wikipedia.org/wiki/Quantitative_proteomics#Mass_spectrometry-based_proteomics)
- 無偏蛋白質組覆蓋
- 分析在給定時間段內針對給定環境(如組織或細胞)表達的完整蛋白質集。
- (http://en.wikipedia.org/wiki/Proteome)
- 翻譯後修飾
- 蛋白質翻譯後發生的化學修飾。
- (http://en.wikipedia.org/wiki/Post-translational_modifications)
- 蛋白質生物標誌物
- 在疾病狀態下產生的蛋白質,可用於檢測該疾病。
- (http://en.wikipedia.org/wiki/Proteomics#Biomarkers)

- 雖然18O標記不是最常用的同位素標記技術,但它具有一定的優勢。結果生成速度非常快,執行測定的所需材料相對便宜,並且所需的樣品量很少。第三點很重要,因為它允許有效地使用數量有限的樣品,例如透過臨床方法獲得的樣品。
- 全域性蛋白質組學研究:使用18O標記樣品在蛋白質組範圍內進行定量分析。由於可變切割,可能會導致結果出現錯誤。然而,蛋白質組的無偏覆蓋是優於基於二維凝膠電泳方法的主要優勢。
- 靶向蛋白質組學研究:使用18O標記技術識別低丰度蛋白質。可用於早期檢測疾病的生物標誌物或識別細胞器分選和運輸中使用的蛋白質。
- 翻譯後修飾:使用18O標記來識別用於過程調控的蛋白質組。定量翻譯前、翻譯後和翻譯後的蛋白質組丰度。
- 與其他技術相比:18O標記具有一定的優勢,使其在適當條件下非常有用。試劑比其他測定技術相對便宜。測定週轉時間短。這對於在臨床環境中生成所需快速結果非常有用。可以使用少量樣品進行測定。在處理供應有限的樣品時,使用更少的樣品非常重要。
- 結論,技術的選擇取決於實驗設計。雖然不總是最佳選擇,但18O標記在快速且廉價地生成某些型別的資訊方面非常有效。
- 本文概述了18O標記技術的多種應用。它對該技術和原理進行了非常全面的背景介紹。然後介紹了18O標記已應用和繼續應用的主要領域。分解了該技術的歷史,以及主要研究領域中的改進和突破。