感覺系統/神經感覺植入物/視網膜植入物
自20世紀後期以來,透過人工眼假體恢復盲人的視力一直是世界各地眾多研究小組和一些私營公司的目標。與人工耳蝸植入物類似,關鍵概念是利用電脈衝刺激視覺神經系統,繞過人類視網膜上受損或退化的感光細胞。在本章中,我們將描述視網膜植入物的基本功能,以及目前正在研究和開發的不同方法。視網膜植入物最常見的兩種方法稱為“視網膜上”和“視網膜下”植入物,分別對應於位於視網膜頂部或視網膜後面的眼假體。我們不會涵蓋任何與視網膜無關的恢復視力的方法,例如旨在從視覺輸入刺激舌頭的BrainPort視覺系統、圍繞視神經的袖套電極或初級視覺皮層的刺激植入物。
圖1描繪了人類視網膜的神經結構示意圖。我們可以區分三層細胞。第一層,位於最遠離眼球晶狀體的部位,由感光細胞(視杆細胞和視錐細胞)組成,其目的是將傳入的光線轉換為電訊號,然後進一步傳播到中間層,該層主要由雙極細胞組成。這些雙極細胞與感光細胞以及水平細胞和無長突細胞等細胞型別相連,將電訊號傳遞到視網膜神經節細胞(RGC)。有關雙極細胞功能的詳細描述,特別是關於其細分為ON和OFF雙極細胞,請參閱視覺系統章節。最上層由RGCs組成,收集來自水平細胞的電脈衝,並透過視神經將其傳遞到丘腦。從那裡,訊號傳播到初級視覺皮層。關於人類視網膜內的訊號處理,有一些關鍵方面值得一提。首先,雖然雙極細胞以及水平細胞和無長突細胞產生漸變電位,但RGCs反而產生動作電位。此外,每種細胞型別的密度在視網膜上並不均勻。雖然在中央凹區域存在極高密度的視杆細胞和視錐細胞,此外只有很少的感光細胞透過中間層連線到RGCs,但在視網膜的周邊區域發現的感光細胞密度要低得多,並且許多感光細胞連線到單個RGC。後者也對RGC的感受野有直接影響,因為它往往向視網膜的外側區域迅速增加,僅僅是因為感光細胞密度較低,並且連線到相同RGC的感光細胞數量增加。
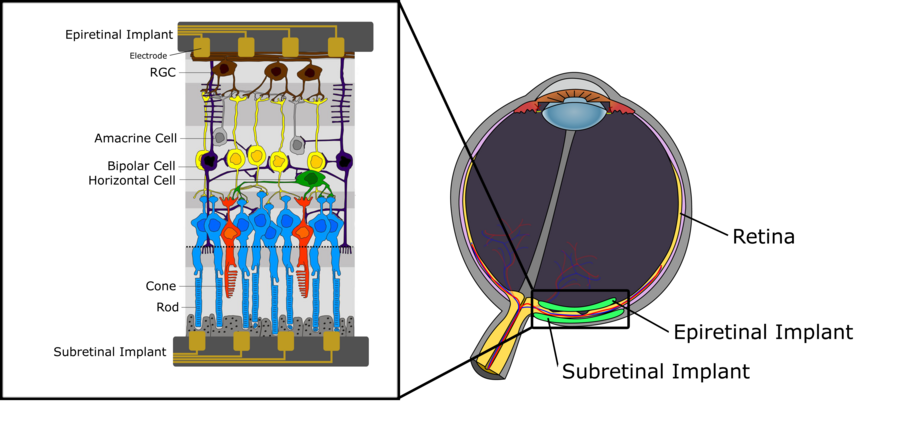
如本維基先前所述,視網膜是位於眼球后部的一種感光組織,由包含各種細胞型別的不同層組成。視網膜主要參與神經視覺處理,訊號起源於感光細胞,並透過神經節細胞的軸突傳遞到大腦。當這種分層組織退化時,可能會發生永久性視力喪失[1]。這通常是由視網膜退行性疾病引起的,例如年齡相關性黃斑變性 (AMD) 和視網膜色素變性 (RP),它們是兩種最普遍的疾病,會逐漸導致永久性視力障礙和喪失。目前,這兩種視網膜疾病還沒有治癒方法,並且現代療法只能減緩疾病進展,因此需要制定恢復患者視力的策略。目前正在研究的工具之一是視網膜假體技術,它可以刺激存活的視網膜組織以恢復視力,這將在後面的部分進行描述[2]。
顧名思義,黃斑變性是一種視網膜退行性疾病,主要發生在老年人身上。AMD圍繞著黃斑中視錐細胞的進行性退化,導致視野中心視力模糊。這可能會發展到患者視野中心完全喪失視力的程度,稱為盲點。雖然AMD可能影響一隻或兩隻眼睛,但它很少導致完全失明,因為患者的周邊視力仍然完好無損。AMD主要有兩種型別:乾性和溼性。乾性AMD佔該病病例的大多數,其特徵是在視網膜色素上皮和脈絡膜之間黃斑處出現小的黃色沉積物,稱為老年斑。這種形式的AMD的進展最初緩慢,症狀很少,只有當視網膜萎縮發生時才會加劇。溼性AMD的特點是脈絡膜新生血管形成,即容易破裂並導致血液、蛋白質洩漏和瘢痕形成的異常血管生長,最終導致視錐細胞永久性損傷,從而導致視力喪失。溼性AMD的進展和視力喪失的速度比干性AMD快得多[3]。


色素性視網膜炎是一種遺傳性退行性眼病,涉及視杆細胞,在年輕人中早期發病。在這種疾病中,視杆細胞逐漸退化,最終導致周邊視野和夜視力喪失。這種視力喪失首先發生在外部,然後逐漸向內發展,在患者中產生“隧道視野”的效果。視力損害對稱發生,雙眼在類似的時間範圍內受到影響。與年齡相關性黃斑變性不同,這種眼病可以擴充套件到周邊以外,並透過視錐細胞的退化開始影響中央視野。這導致患者持續視力喪失,最終可能導致完全失明,儘管這種情況非常罕見。色素性視網膜炎是遺傳性疾病,具有多種可導致RP表型的基因突變,導致多種遺傳模式。然而,當遺傳模式為常染色體顯性遺傳時,大多數病例與視紫紅質基因的突變有關。這種突變破壞了視杆蛋白的功能,視杆蛋白是光轉導級聯反應中必不可少的蛋白質。目前還沒有治癒色素性視網膜炎的方法[2]。然而,2008年,佐藤茂和他的同事發現了一種名為Pikachurin的細胞外基質樣視網膜蛋白,由於其參與光感受器細胞和雙極細胞之間的相互作用,因此可能導致潛在的疾病治療方法[4]。

如上所述,目前還沒有治癒黃斑變性和色素性視網膜炎引起的進行性視力損害的方法。然而,在這兩種疾病中,即使存在大量的光感受器細胞丟失,大量內視網膜神經元在疾病發病數年後仍然存活。這為透過電極對剩餘的、仍然正常運作的視網膜細胞進行人工刺激提供了機會,從而為人類患者恢復視覺資訊。微電極陣列利用電極透過緊密放置來刺激視網膜細胞外,從而允許在陣列和視網膜周圍發現的鹽水中形成電化學介面。電流被注入到陣列-視網膜介面,最終驅動神經元膜的去極化,從而導致動作電位。這種刺激可以是陰極的或陽極的。在陰極刺激中,負電荷出現在膜外,從而驅動正電荷進入細胞內,導致去極化梯度,該梯度在靠近電極的地方最強。在陽極刺激中,超極化發生在最靠近電極的區域,而去極化發生在較遠的距離。因此,陰極通常被認為更有效地用於刺激,因為它需要更低的電流注入。刺激的相位不是影響刺激有效性的唯一因素。波形可以採用多種形狀,例如單相和雙相,在視網膜神經元刺激的安全方面起著重要作用。例如,在猴子身上發現,僅具有陽極相位的單相電流會損害先前可存活的細胞。因此,使用視網膜刺激的植入物將使用電荷平衡的雙相波形。這種波形利用陰極相位進行刺激,利用陽極相位進行放電,從而平衡膜周圍的電荷。透過這種刺激能力,視網膜假體可以植入視網膜後方,然後被稱為視網膜下植入物。這使得電極最靠近受損的光感受器和仍然正常運作的雙極細胞,而雙極細胞是這裡的真正刺激目標。如果刺激電極穿透脈絡膜(包含視網膜的血液供應),則植入物有時被稱為“脈絡膜上”植入物。或者,植入物可以放置在視網膜頂部,最靠近神經節細胞層,目的是刺激RGC而不是光感受器細胞。這些植入物被稱為視網膜上植入物。這兩種方法目前正由多個研究小組進行研究。它們都具有明顯的優勢和缺點。在我們分別詳細介紹它們之前,我們先描述一些在這兩種情況下都需要考慮的關鍵挑戰[2]。
視網膜植入物面臨的一個巨大挑戰來自人視網膜中神經細胞的極高空間密度。人視網膜大約有1.25億個光感受器(視杆和視錐細胞)和150萬個神經節細胞,而人耳蝸中只有大約15000個毛細胞[5] [6]。在視網膜中央凹處,視覺敏銳度最高,每平方毫米有高達15萬個視錐細胞。雖然與光感受器相比,RGC的總數要少得多,但它們在中央凹區域的密度接近視錐細胞的密度,這給用人工電極以足夠高的空間解析度來定址神經細胞帶來了巨大挑戰。幾乎所有目前關於視網膜植入物的科學實驗都使用微電極陣列(MEA)來刺激視網膜細胞。高解析度MEA實現了大約50微米的電極間距,導致每平方毫米400個電極的電極密度。因此,在中央凹區域,用傳統的電極技術不可能實現電極與光感受器或RGC之間的一一對應關係。然而,光感受器和RGC的空間密度都迅速向視網膜外圍區域下降,使得電極與外周神經細胞之間的一一刺激變得更加可行[7]。另一個挑戰是在安全限值內操作電極。施加超過0.1 mC/cm²的電荷密度可能會損壞神經組織[7]。通常,細胞離刺激電極越遠,刺激細胞所需的電流幅度就越大。此外,刺激閾值越低,電極的設計就可以越小,電極在MEA上的放置就可以越緊湊,從而提高空間刺激解析度。刺激閾值定義為觸發至少50%的刺激脈衝中神經反應所需的最小刺激強度。出於這些原因,設計視網膜植入物的主要目標是在仍然保證可靠刺激(例如,在RGC的情況下產生動作電位)目標細胞的同時,使用盡可能低的刺激電流。這可以透過將電極儘可能靠近對施加的電場脈衝最敏感的目標細胞區域來實現,或者透過使細胞突起(即樹突和/或軸突)在電極上生長來實現,即使細胞體位於遠處,也能以非常低的電流刺激細胞。此外,固定在視網膜上的植入物會自動跟隨眼球的運動。雖然這帶來了一些顯著的好處,但也意味著任何與植入物的連線(用於調整引數、讀取資料或為刺激提供外部電源)都需要一根隨植入物一起移動的電纜。當我們每秒大約移動眼睛三次時,這會使電纜和相關的連線暴露在嚴重的機械應力下。對於一個應該在整個生命週期內無需外部干預就能保持功能的裝置來說,這對所涉及的材料和技術提出了嚴峻的挑戰。
除了電氣挑戰之外,視網膜植入物的關鍵挑戰在於它與生物組織的接觸。當異物(例如植入物)與生理物質接觸時,會觸發免疫反應。這種反應通常以炎症或物質隔離的形式出現,這通常會導致相關組織的瘢痕形成。這對視網膜植入物來說尤其是一個問題,因為假體必須穿過組織插入到適當的位置。如果使用的材料太鋒利或放置不當,可能會對組織造成損傷,從而進一步加劇免疫反應。此外,這些反應會導致電訊號隨著時間的推移而丟失,因為免疫系統會隨著時間的推移“包封”刺激區域,從而難以實現長期植入。到目前為止,一種視網膜上植入物Argus II已經能夠透過使視網膜植入物在患者體內3年後仍然發揮作用來規避生物相容性問題。這種植入物使用了矽膠,矽膠是一種具有良好長期生物相容性的材料,但它是一種剛性基材,不允許輕鬆修改裝置的配置。其他材料,如聚醯亞胺和金,也已被研究用於視網膜植入物的功能和生物相容性。聚醯亞胺是一種很有前途的用於未來植入物的聚合物,因為由這種材料製成的植入物在短期研究中對人眼有功能。這種材料的優點在於其高生物相容性、柔韌性和低成本。隨著技術進步產生更復雜的微電極陣列,需要不同的基材來實現最大功能,因此對適合視網膜植入物的材料的最佳化工作正在進行中[8] [9]。
正如其名稱所暗示的那樣,視網膜下植入物是位於視網膜後面的視覺假體。因此,植入物位於最靠近受損感光細胞的位置,旨在繞過視杆細胞和視錐細胞,並刺激視網膜下一神經層的雙極細胞。這種方法的主要優勢在於,在感光細胞和需要由植入物模擬的雙極細胞之間發生的視覺訊號處理相對較少。也就是說,原始視覺資訊(例如,由攝像機捕捉到的資訊)可以直接或僅經過相對基本的訊號處理分別轉發到刺激雙極細胞的MEA,從訊號處理的角度來看,該過程相當簡單。然而,這種方法也有一些嚴重的缺點。人眼視網膜中感光細胞的高空間解析度對開發和設計具有足夠高刺激解析度、因此具有較低電極間距的MEA提出了巨大挑戰。此外,神經層在z方向(x-y平面與視網膜曲率相切)上的堆疊在將電極放置靠近雙極細胞時增加了另一個困難。由於MAE位於視網膜後面,因此電極和目標細胞之間存在明顯的空間間隙需要克服。如上所述,電極到目標細胞距離的增加迫使MAE以更高的電流工作,從而增大電極尺寸、單個電極刺激範圍內的細胞數量以及相鄰電極之間的空間距離。所有這些都會導致刺激解析度降低,以及使視網膜面臨因電荷密度過高而導致組織損傷的風險。如下所示,克服電極與目標細胞之間大距離的一種方法是使細胞在其上直接生長出更長的突起,覆蓋在電極上。
2010年底,一個德國研究小組與德國私營公司“Retina Implant AG”合作,發表了涉及人體視網膜下植入物測試研究的結果[10]。一個3×3毫米的微光電二極體陣列(MPDA)包含1500個畫素,每個畫素包含一個獨立的光敏光電二極體和一個電極,被植入三名因黃斑變性而失明的患者的視網膜後。畫素彼此之間的距離約為70微米,產生大約160個電極/平方毫米的空間解析度——或者,如論文作者所指出的,每個電極的視覺錐角為15角分。需要注意的是,與使用外部攝像機生成視覺輸入的植入物不同,MPDA的每個畫素本身都包含一個光敏光電二極體,自主地從透過眼球接收到的光線中產生電流,供其自身關聯的電極使用。因此,每個MPDA畫素在完整的功能上都對應於一個感光細胞。這具有一個主要優勢:由於MPDA固定在人眼視網膜後面,因此在眼球移動時會自動隨之移動。並且,由於MPDA本身接收視覺輸入以產生用於刺激電極的電流,因此頭部或眼球的運動會自然地得到處理,無需人工處理。在一例患者中,MPDA直接放置在黃斑下方,與其他兩例患者(其MPDA植入在視網膜中心較遠的位置)相比,在實驗測試中取得了優異的結果。在黃斑後植入植入物的患者取得的結果非常出色。他能夠識別字母(5-8釐米大)和閱讀單詞,以及區分不同方向的黑白圖案[10]。
MPDA植入物的實驗結果也引起了人們對另一種視覺現象的關注,揭示了MPDA方法相對於使用外部成像裝置的植入物的額外優勢:視網膜細胞的後續刺激會迅速導致反應減少,表明視網膜神經元在短時間內反覆受到刺激後會受到抑制。這意味著投射到固定在視網膜上或視網膜後面的MEA上的視覺輸入將導致感知到的影像迅速消失,即使電極的電刺激保持不變。這是由於視網膜上的固定電極始終刺激視網膜上的相同細胞,導致細胞對恆定刺激的敏感性隨著時間的推移而降低。然而,該過程是可逆的,一旦刺激消失,細胞就會恢復其初始敏感性。那麼,完整的視覺系統如何處理這種效應?為什麼健康的人能夠長時間注視一個物體而不使其消失?如[11]中所述,人眼實際上會持續進行細微、不易察覺的眼球運動,導致相同的視覺刺激隨著時間的推移投射到略微不同的視網膜位置,即使我們傾向於將眼睛聚焦並固定在某個目標物體上。這成功地規避了細胞反應衰減現象。由於植入物既充當感光細胞又充當電極刺激器,就像MPDA一樣,自然的小眼球調整可以很容易地以簡單的方式處理這種效應。其他使用外部視覺輸入(即來自攝像機)的植入方法如果持續受到刺激,其投射影像將逐漸消失。攝像機影像的快速人工抖動可能無法解決問題,因為這種外部運動可能與眼球運動不一致,因此視覺皮層可能將其簡單地解釋為搖晃或模糊的場景,而不是所需的固定影像的穩定長期投射。視網膜下植入物的另一個優勢是視網膜上受刺激區域與人眼視場中刺激感知位置之間的精確相關性。與視網膜神經節細胞(RGC)相反,其在視網膜上的位置可能不直接對應於其各個感受野的位置,雙極細胞的刺激恰好被感知為與該雙極細胞所在的視網膜幾何位置相對應的視場中的那個點。視網膜下植入物的一個明顯的缺點是涉及侵入性手術過程。
視網膜上植入物
[edit | edit source]視網膜上植入物位於視網膜頂部,因此最靠近視網膜神經節細胞(RGC)。因此,視網膜上植入物的目標是直接刺激RGC,不僅繞過受損的感光細胞,還繞過雙極細胞、水平細胞和無長突細胞進行的任何中間神經視覺處理。這有一些優勢:首先,視網膜上植入物的手術過程遠沒有視網膜下植入物那麼關鍵,因為假體不需要從眼睛後面植入。此外,RGC的數量遠少於感光細胞或雙極細胞,允許更粗粒度的刺激,並增加電極間距(至少在視網膜的周邊區域),或者電極密度甚至高於實際RGC密度,從而在刺激細胞時提供更大的靈活性和準確性。一項關於獼猴視網膜上週邊傘狀細胞的視網膜上刺激的研究提供了定量細節[7]。傘狀細胞是一種RGC,形成視網膜中第二密集的視覺通路。它們的主要目的是編碼視覺場中物體的運動,從而感知運動。這些實驗是在體外進行的,將獼猴視網膜組織放置在61電極MEA(60微米電極間距)上。識別並電子刺激了25個獨立的傘狀細胞,同時分析了刺激閾值和最佳刺激位置等特性。閾值電流定義為在50%的刺激脈衝(脈衝持續時間:50毫秒)中觸發目標細胞尖峰的最低電流,並透過逐步增加刺激強度直至記錄到足夠的尖峰響應來確定。請注意兩個方面:首先,傘狀細胞作為RGC表現出動作電位行為,而雙極細胞則使用漸變電位。其次,MAE上的電極既用於刺激脈衝,也用於記錄目標細胞的尖峰響應。25個傘狀細胞位於61電極MAE上,電極密度明顯高於傘狀細胞密度,有效地使單個傘狀細胞的感受野內有多個電極。除了測量觸發可靠細胞響應所需的刺激閾值外,還確定了最佳刺激位置。最佳刺激位置是指相對於目標細胞的刺激電極的位置,在該位置實現了最低的刺激閾值。令人驚訝的是,發現它不在細胞體上,正如人們所預期的那樣,而是在軸突路徑向下大約13微米處。從那裡開始,實驗表明刺激閾值電流相對於電極到細胞體距離的增加呈預期的二次方增加。研究結果還表明,所有刺激閾值都遠低於安全限值(約0.05mC/cm²,而0.1mC/cm²是(低)安全限值),並且細胞對刺激脈衝的反應很快(平均延遲0.2毫秒)且精確(延遲變化小)。此外,電極密度優於傘狀細胞密度,允許透過刺激適當的電極可靠地定址單個細胞,同時防止相鄰細胞也引起尖峰。
在本節中,我們將簡要概述一些目前正在研究的替代方法和技術。
傳統的微電極陣列(MEA)使用氮化鈦或氧化銦錫製成的電極,這導致植入物在長期生物相容性方面面臨嚴重問題[12]。碳奈米管(CNT)是一種很有前景的金屬電極替代材料,它結合了許多非常有利的特性。首先,它們完全生物相容,因為它們由純碳製成。其次,它們的穩健性使其適用於長期植入,這是視覺假體的一個關鍵特性。此外,良好的導電性使其能夠作為電極工作。最後,它們的多孔性導致極大的接觸表面積,促使神經元在CNT上生長,從而改善神經元與電極的接觸並降低引發細胞反應所需的刺激電流。然而,CNT電極只是最近才出現,目前只有很少的科學研究成果。
視網膜植入物的主要技術挑戰之一是連線MEA與外部刺激、電源以及控制訊號的電纜。電纜上的機械應力會影響其長期穩定性和耐久性,這對所用材料提出了很大的挑戰。無線技術可以作為一種方法來避免實際視網膜植入物與外部裝置之間的任何電纜連線。入射光透過眼睛產生的能量不足以觸發神經反應。因此,要使無線植入物工作,必須向植入物提供額外的能量。斯坦福醫學院提出的一種方法是使用紅外LCD顯示器將攝像機捕獲的場景投射到護目鏡上,將紅外脈衝反射到視網膜上的晶片上。該晶片還使用光伏可充電電池來提供將紅外光轉換為足夠強度的刺激脈衝所需的能量。類似於視網膜下植入方法,這也允許眼睛自然地將焦點固定在場景中的物體上,因為眼睛可以自由移動,從而允許護目鏡上的不同部分的紅外影像投射到視網膜上晶片上的不同區域。除了使用紅外光之外,還可以使用感應線圈將電能和資料訊號從外部裝置傳輸到視網膜上的植入物。這項技術已成功應用於EPIRET3視網膜植入物[13]。然而,這些測試更多的是概念驗證,因為只測試了患者在對電極施加刺激時感知視覺訊號的能力。
一種透過極低的電流甚至在更長的距離上實現非常精確的神經刺激的方法是使神經元將其突起生長到電極上。透過在視網膜組織上應用正確的化學溶液,可以促進神經生長。這可以透過在MEA表面塗覆一層層粘連蛋白來實現。為了控制神經通路,層粘連蛋白不是均勻地塗覆在整個MEA表面,而是在形成特定圖案的狹窄路徑上塗覆,這些圖案對應於神經元應該形成的連線。這種以精確、圖案化的方式塗覆層粘連蛋白的過程稱為“微接觸印刷”。圖5顯示了這些層粘連蛋白路徑的示意圖。透過這種方法實現的成功定向神經生長使得與傳統的電極刺激相比,可以應用顯著更低的刺激電流,同時仍然能夠可靠地觸發神經反應[14]。此外,刺激閾值不再遵循相對於電極-胞體距離的二次增長,而是在較長距離(>200微米)時保持恆定在同一低水平。
如前面視網膜植入物挑戰部分所述,許多微電極陣列存在間距大、電極數量少的問題,這影響了它們在神經網路中對神經元的特異性和靶向性。這是能夠觀察神經元群體網路動態和功能的限制因素。具體來說,許多細胞細節,如軸突傳播速度和軸突資訊處理,在低密度陣列中丟失。最近,研究人員利用互補金氧半導體(CMOS)技術製造了具有高空間解析度的高密度微電極陣列,這些陣列可以檢測這些細胞資訊,並透過鉑黑沉積獲得高信噪比。此類陣列在3.85 x 2.10 mm²的感測陣列上可以擁有26400個微電極。間距為17.5 μm,電極密度為每μm² 3265個電極,以配合1024個讀出通道[15]。電極下方有許多開關,可以使用各種電極配置來評估晶片上的神經元群體。使用這種靈敏且密集的微電極晶片,可以從神經細胞記錄單細胞識別、網路水平分析和軸突資訊。這項技術為確定疾病建模和組織功能的電生理表型“生物標誌物”打開了大門,因為可以解剖視網膜並在微電極陣列上進行培養和記錄[16]。
光訊號在視網膜中被解釋,並且這些資訊儲存在神經節細胞層的神經元中,稱為視網膜神經節細胞(RGCs)。然後,這些細胞透過動作電位傳送這些資訊,這些資訊可以透過微電極陣列記錄下來,以瞭解視網膜迴路、發育和視覺場景的編碼。這些體外實驗通常首先從其天然組織中分離視網膜,將組織與視網膜神經節細胞向下朝向陣列培養,並使用光刺激進行記錄。之後,使用稍後將解釋的尖峰排序來分析資料。藥物阻斷劑和不同的光刺激可以用來確定光感受器的反應並評估功能。此外,研究人員可以評估視網膜突變對RGC尖峰行為的影響,以確定電生理生物標誌物。在一個實驗中,研究人員使用微電極陣列對野生型小鼠視網膜和FRMD7基因敲除小鼠進行記錄。FMRD7是一種與受影響個體水平、注視依賴性快速眼球運動相關的突變。微電極陣列記錄會話的資料表明,視網膜中對水平方向選擇性細胞的反應有所喪失。野生型小鼠在水平或垂直方向選擇性細胞中都沒有反應喪失。這一發現表明,在未來的研究中,可以使用微電極陣列技術來確定視網膜疾病的電生理生物標誌物[17]。

隨著最新微電極技術的出現,可以從數千個電極記錄神經活動,可以分析來自神經組織和網路的大量同步電生理資料,以揭示關於神經系統的重要電資訊。當使用微電極陣列進行神經科學研究時,神經元(動作電位)的電訊號被細胞外記錄。這意味著在這些記錄中獲得的訊號與膜片鉗相反;動作電位的幅度為負,而不是膜片鉗。這些細胞外特徵不僅包含有關動作電位的資訊,還包含突觸機制(區域性場電位)的資訊,這些資訊可以透過濾波和分析來識別。分析並將這些電生理資訊分配給單個神經元的過程稱為尖峰排序。


在微電極記錄中分析的主要記錄方面是尖峰序列。神經元可以透過其尖峰活動來識別,因為每個事件的時間取決於神經元相對於電極的大小、形狀和位置。當從數千個神經元記錄時,尖峰排序變得具有挑戰性,類似於雞尾酒會現象。當多個神經元彼此靠近時,電極很容易記錄來自多個神經元的訊號。因此,尖峰排序必須透過其電“雜音”來識別單個神經元,即使存在大量的背景“雜音”。尖峰排序是一個多步驟的過程,它獲取神經元群體原始資料,並儘管存在這種背景噪聲,仍然將尖峰分配給單個神經元。
尖峰排序過程的概述可以包括以下步驟:原始資料預處理 → 尖峰檢測 → 尖峰提取和對齊 → 特徵提取 → 聚類 → 分類。在這個通用工作流程中,尖峰排序演算法獲取神經群體中的原始資料,並首先透過濾除動作電位(噪聲)的低頻部分對其進行預處理。然後透過設定電壓閾值來檢測尖峰。之後,需要根據動作電位的一般特徵(例如其位置)對提取的尖峰波形進行時間對齊。然後,透過使用主成分分析或小波從每個單獨的波形中提取特徵,這對於將資料減少到包含感興趣資訊必要的維度是必要的。然後對尖峰進行聚類,以便為單個神經元建立模板。這針對資料中的單個神經元完成。沒有一種“一刀切”的尖峰排序演算法,因為多電極記錄在不同細胞型別、物種和記錄型別之間可能存在差異。因此,必須調整和最佳化演算法以產生能夠準確表示原始資料的結果。但是,一旦資料經過尖峰排序,就可以從資料中獲取大量資訊,例如尖峰間期、不應期,以及能夠將單個神經元的資料彼此繪製以檢測差異[18]。
- ↑ Larry Squire;等(2012)。《基礎神經科學第4版》。
{{cite book}}: 在“|author=”中明確使用等。(幫助) - ↑ a b c Lan Yue,James D. Weiland,Botond Roska,Mark S. Humayun(2016)。“恢復視力的視網膜刺激策略:基礎和系統”。
{{cite journal}}: 引用期刊需要“|journal=”(幫助)CS1維護:作者列表中有多個名稱(連結) - ↑ Jackson,G.R.,Owsley,C.,Curcio,C.A(2002)。“衰老和年齡相關性黃斑病變中感光細胞的退化和功能障礙”。
{{cite journal}}: 引用期刊需要“|journal=”(幫助)CS1維護:作者列表中有多個名稱(連結) - ↑ Shigeru Sato,Yoshihiro Omori;等(2008)。“Pikachurin,一種dystroglycan配體,對於感光細胞帶狀突觸的形成至關重要”。
{{cite journal}}: 引用期刊需要“|journal=”(幫助); 在“|author=”中明確使用等。(幫助) - ↑ Jost B. Jonas,UlrikeSchneider,Gottfried O.H. Naumann(1992)。“人視網膜感光細胞的數量和密度”。施普林格。
{{cite journal}}: 引用期刊需要“|journal=”(幫助)CS1維護:作者列表中有多個名稱(連結) - ↑ Ashmore Jonathan(2008)。“耳蝸外毛細胞的運動性”。美國生理學會。
{{cite journal}}: 引用期刊需要“|journal=”(幫助) - ↑ a b c Chris Sekirnjak,PawelHottowy,Alexander Sher,Wladyslaw Dabrowski,Alan M. Litke,E.J. Chichilnisky(2008)。“用於視網膜植入物設計的靈長類動物視網膜高解析度電刺激”。神經科學學會。
{{cite journal}}: 引用期刊需要“|journal=”(幫助)CS1維護:作者列表中有多個名稱(連結) - ↑ Jong-Mo Seo;等(2004)。“用於視網膜刺激的聚醯亞胺微電極陣列的生物相容性”。
{{cite journal}}: 引用期刊需要“|journal=”(幫助); 在“|author=”中明確使用等。(幫助) - ↑ Eui Tae Kim;等(2009)。“基於矽-聚醯亞胺混合物的視網膜假體微電極陣列(MEA)的可行性”。
{{cite journal}}: 引用期刊需要“|journal=”(幫助); 在“|author=”中明確使用等。(幫助) - ↑ a b Eui Ta Eberhart Zrenner,KarlUlrich Bartz-Schmidt,Heval Benav,Dorothea Besch,Anna Bruckmann,Veit-Peter Gabel,Florian Gekeler,Udo Greppmaier,Alex Harscher,Steffen Kibbel,Johannes Koch,Akos Kusnyerik,tobias Peters,Katarina Stingl,Helmut Sachs 等。Kim;等(2010)。“視網膜下電子晶片使盲人能夠閱讀字母並將它們組合成單詞”。
{{cite journal}}: 引用期刊需要“|journal=”(幫助); 在“|author=”中明確使用等。(幫助)CS1維護:作者列表中有多個名稱(連結) - ↑ Pritchard Roy。“視網膜上的穩定影像”。
{{cite journal}}: Cite journal 需要|journal=(幫助) - ↑ Asaf Shoval,ChrisopherAdams,Moshe David-Pur,Mark Shein,Yael Hanein,Evelyne Sernagor (2009)。“用於與視網膜組織有效連線的碳奈米管電極”。
{{cite journal}}: Cite journal 需要|journal=(幫助)CS1 維護:作者列表使用了多重名稱 (連結) - ↑ Susanne Klauke,Michael Goertz,Stefan Rein,Dirk Hoehl,Uwe Thomas,Reinhard Eckhorn,Frank Bremmer,Thomas Wachtler (2011)。“使用無線眼內視網膜植入物刺激在失明人群中引起視覺感知”。視覺和眼科研究協會。
{{cite journal}}: Cite journal 需要|journal=(幫助)CS1 維護:作者列表使用了多重名稱 (連結) - ↑ Neville Z. Mehenti,GrehS. Tsien,Theodore Leng,Harvey A. Fishman,Stacey F. Bent (2006)。“基於定向神經元生長用於單細胞刺激的模型視網膜介面”。施普林格。
{{cite journal}}: Cite journal 需要|journal=(幫助)CS1 維護:作者列表使用了多重名稱 (連結) - ↑ Jan Muller;等 (2015)。“用於在亞細胞、細胞和網路水平研究神經元的 高解析度 CMOS MEA 平臺”。
{{cite journal}}: Cite journal 需要|journal=(幫助); 在|author=中明確使用等 (幫助) - ↑ Fiscella M;等 (2012)。“使用具有即時可切換電極選擇的 高密度 CMOS 整合微電極陣列記錄視網膜神經節細胞的特定群體”。
{{cite journal}}: Cite journal 需要|journal=(幫助); 在|author=中明確使用等 (幫助) - ↑ Fiscella M,Yonehara K,Drinnenberg A,Franke F,Müller J,Roska B 和 Hierlemann A (2016)。“使用 CMOS 高密度微電極陣列篩選人類眼部疾病的轉基因小鼠模型”。
{{cite journal}}: Cite journal 需要|journal=(幫助)CS1 維護:作者列表使用了多重名稱 (連結) - ↑ Gaute T Einevoll,Felix Franke,Espen Hagen,Christophe Pouzat 和 Kenneth D Harris (2012)。“利用多電極從數千個神經元獲得可靠的脈衝序列記錄”。
{{cite journal}}: Cite journal 需要|journal=(幫助)CS1 維護:作者列表使用了多重名稱 (連結)


