感覺系統/神經感覺植入物
自 20 世紀後期以來,利用人工眼假體恢復盲人的視力一直是世界各地許多研究小組和一些私人公司的目標。與人工耳蝸類似,其關鍵概念是利用電脈衝刺激視覺神經系統,繞過人類視網膜上受損或退化的感光細胞。本章將描述視網膜植入物的基本功能,以及目前正在研究和開發的不同方法。視網膜植入物的兩種最常見方法被稱為“視網膜上”和“視網膜下”植入物,分別對應於位於視網膜頂部或後面的眼假體。我們不會涵蓋任何與視網膜無關的恢復視力的方法,例如旨在從視覺輸入刺激舌頭的 BrainPort 視覺系統、視神經周圍的袖狀電極,或初級視覺皮層的刺激植入物。
圖 1 描述了人類視網膜的示意圖神經結構。我們可以區分三層細胞。第一層,位於最遠離眼球晶狀體的位置,由感光細胞(桿狀細胞和錐狀細胞)組成,其作用是將入射光轉換為電訊號,然後將電訊號進一步傳播到中間層,該層主要由雙極細胞組成。這些雙極細胞連線到感光細胞以及水平細胞和無長突細胞等細胞型別,將電訊號傳遞到視網膜神經節細胞 (RGC)。有關雙極細胞功能的詳細說明,特別是在其細分為 ON 雙極細胞和 OFF 雙極細胞方面的說明,請參閱視覺系統的章節。最上層由 RGC 組成,收集來自水平細胞的電脈衝,並透過視神經將其傳遞到丘腦。從那裡,訊號被傳播到初級視覺皮層。關於人類視網膜內訊號處理的一些關鍵方面值得一提。首先,雖然雙極細胞以及水平細胞和無長突細胞產生等級電位,但 RGC 反而產生動作電位。此外,每種細胞型別的密度在整個視網膜中並不均勻。雖然在中央凹區域有非常高的桿狀細胞和錐狀細胞密度,並且只有很少的感光細胞透過中間層連線到 RGC,但在視網膜的周邊區域發現了遠低於的感光細胞密度,而許多感光細胞連線到單個 RGC。後者也對 RGC 的感受野有直接影響,因為它傾向於向視網膜的外圍區域快速增加,僅僅因為感光細胞密度較低以及連線到相同 RGC 的感光細胞數量增加。
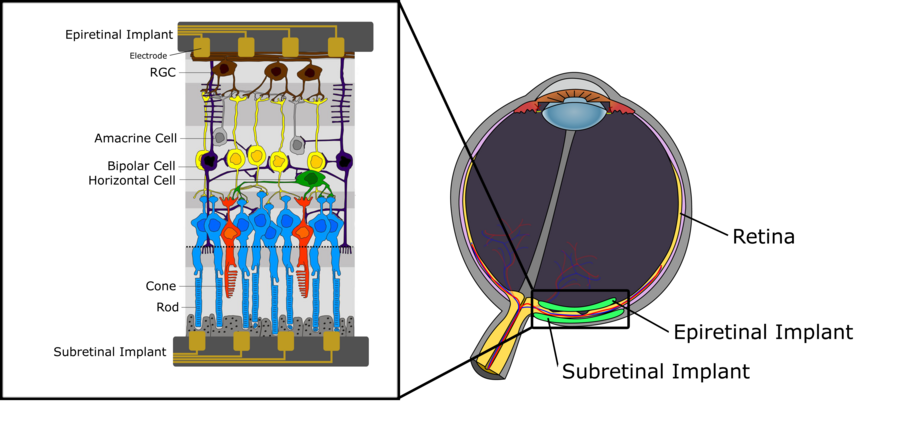
如本維基中先前所述,視網膜是位於眼球后部的感光組織,由包含各種細胞型別的不同層組成。視網膜主要參與神經視覺處理,訊號起源於感光細胞,並透過神經節細胞的軸突傳遞到大腦。當這種分層組織退化時,可能會發生永久性視力喪失[1]。這通常是由視網膜退行性疾病引起的,例如年齡相關性黃斑變性 (AMD) 和視網膜色素變性 (RP),它們是兩種最普遍的導致逐漸發生永久性視力障礙和視力喪失的疾病。目前,這兩種視網膜疾病沒有治癒方法,現代療法只能減緩疾病進展,因此需要採取策略來恢復患者的視力。正在研究的一種工具是視網膜假體技術,該技術刺激可存活的視網膜組織以恢復視力,這將在後面的部分中進行描述[2]。
正如其名稱所暗示的,黃斑變性是一種視網膜退行性疾病,主要發生在老年人。AMD圍繞著黃斑中視錐細胞的進行性退化,導致視野中心出現模糊。這可能會發展到患者在視野中心完全失明的程度,被稱為盲點。儘管AMD可能影響一隻或兩隻眼睛,但它很少導致完全失明,因為患者的周邊視力仍然完好。AMD主要有兩種型別:乾性和溼性。乾性AMD佔該疾病病例的大多數,其特徵是在視網膜色素上皮和脈絡膜之間的黃斑處出現稱為脂蛋白的小黃斑沉積物。這種形式的AMD的進展最初是緩慢的,症狀很少,只有在視網膜萎縮發生時才會加劇。溼性AMD的特徵是脈絡膜新生血管,即容易破裂並導致血液、蛋白質滲漏和瘢痕形成的異常血管生長,最終導致視錐細胞永久性損傷,從而導致視力喪失。溼性AMD的進展和視力喪失比干性AMD快得多[3]。
視網膜色素變性(RP)
[edit | edit source]

視網膜色素變性是一種遺傳性退行性眼病,涉及桿狀感光細胞,在年輕人中早期發病。在這種疾病中,桿狀感光細胞逐漸退化,最終導致周邊視野和夜視力的喪失。這種損失首先發生在外部,然後向內發展,對患者造成“隧道視野”的影響。視力障礙對稱發生,兩隻眼睛在類似的時間範圍內受到影響。與AMD不同,這種眼病可以擴充套件到周邊以外,並透過視錐細胞的退化開始影響中央視野。這會導致患者持續視力喪失,最終可能導致完全失明,儘管這種情況非常罕見。視網膜色素變性是遺傳的,並且有各種各樣的基因突變會導致RP表型,從而導致多種遺傳模式。然而,當遺傳模式為常染色體顯性遺傳時,大多數病例與視紫紅質基因的突變有關。這種突變會破壞視杆蛋白的功能,視杆蛋白是光轉導級聯反應中的一種必需蛋白。目前還沒有治療視網膜色素變性的方法[2]。然而,2008年,佐藤茂和他的同事發現了一種叫做Pikachurin的細胞外基質樣視網膜蛋白,由於它參與光感受器細胞和雙極細胞之間的相互作用,因此可能導致潛在的疾病治療[4]。
用於視網膜刺激的微電極陣列
[edit | edit source]
如上所述,黃斑變性和視網膜色素變性導致的進行性視力障礙目前還沒有治療方法。然而,在這兩種疾病中,儘管存在大量的光感受器細胞損失,但在疾病發病後數年,大量的內視網膜神經元仍然存活。這為透過電極對剩餘的、仍然正常工作的視網膜細胞進行人工刺激提供了一個機會,從而為患者恢復視覺資訊。微電極陣列使用電極透過緊密放置來刺激視網膜細胞外,從而允許電化學介面在陣列和視網膜周圍發現的鹽水中形成。電流透過陣列-視網膜介面注入,最終驅動神經元膜的去極化,從而產生動作電位。這種刺激可以是陰極的也可以是陽極的。 在陰極刺激中,負電荷出現在膜外,從而將正電荷驅入細胞內,導致去極化梯度,在靠近電極的地方最強。在陽極刺激中,超極化發生在最靠近電極的區域,去極化發生在更遠的地方。因此,陰極通常被認為更有效,因為它需要更低的電流注入。刺激的相位不是影響刺激效果的唯一因素。波形,它可以呈現多種形狀,如單相和雙相,在視網膜神經元刺激的安全方面起著重要作用。例如,在猴子身上發現,只有陽極相位的單相電流會損害先前存活的細胞。因此,使用視網膜刺激的植入物將使用電荷平衡的雙相波形。這種波形利用陰極相位進行刺激,利用陽極相位進行放電,從而平衡膜周圍的電荷。有了這種刺激能力,視網膜假體可以植入視網膜後,稱為視網膜下植入物。這將電極最靠近受損的光感受器細胞和仍然正常工作的雙極細胞,而雙極細胞是這裡真正的刺激目標。如果刺激電極穿透脈絡膜,脈絡膜包含視網膜的血液供應,那麼植入物有時被稱為“脈絡膜上”植入物。或者,植入物可以放置在視網膜頂部,最靠近神經節細胞層,目標是刺激RGC而不是光感受器細胞。這些植入物被稱為視網膜上植入物。兩種方法目前都正在由多個研究小組進行研究。它們都具有明顯的優點和缺點。在我們更詳細地分別處理它們之前,我們將描述兩種情況下需要考慮的一些關鍵挑戰[2]。
挑戰
[edit | edit source]電極技術挑戰
[edit | edit source]視網膜植入物面臨的一個重大挑戰是人眼中神經細胞的極高空間密度。人眼視網膜中大約有1.25億個光感受器(桿狀和錐狀)和150萬個神經節細胞,而人耳蝸中只有大約1.5萬個毛細胞[5][6]。在中央凹,視覺銳度最高的地方,在一個平方毫米內有15萬個錐狀細胞。雖然與光感受器相比,RGC的總數要少得多,但它們在中央凹區域的密度接近錐狀細胞的密度,這對用人工電極以足夠高的空間解析度來定位神經細胞提出了巨大挑戰。實際上,所有當前使用視網膜植入物的科學實驗都使用微電極陣列 (MEA) 來刺激視網膜細胞。高解析度MEA實現了大約50微米的電極間距,導致每個平方毫米的電極密度為400個電極。因此,在中央凹區域,用傳統的電極技術不可能實現電極與光感受器或RGC之間的OneToOne關聯。然而,光感受器和RGC的空間密度都迅速下降到視網膜的外圍區域,使得電極與外周神經細胞之間的OneToOne刺激更加可行[7]。另一個挑戰是在安全範圍內操作電極。施加大於0.1 mC/cm²的電荷密度可能會損壞神經組織[7]。通常,細胞距離刺激電極越遠,刺激細胞所需的電流幅度就越大。此外,刺激閾值越低,電極的設計就可以越小,電極在MEA上的放置就可以越緊密,從而提高空間刺激解析度。刺激閾值定義為觸發至少50%的刺激脈衝中神經反應所需的最小刺激強度。由於這些原因,設計視網膜植入物的主要目標是在仍然保證可靠的刺激(即在RGC的情況下產生動作電位)目標細胞的情況下,使用盡可能低的刺激電流。這可以透過將電極儘可能靠近對施加的電場脈衝最敏感的目標細胞區域來實現,或者透過使細胞突起,即樹突和/或軸突,生長在電極上,即使細胞體位於很遠的地方,也能以非常低的電流刺激細胞。此外,固定在視網膜上的植入物會自動跟隨眼球的運動。雖然這帶來了許多顯著的好處,但也意味著與植入物的任何連線(用於調整引數、讀取資料或為刺激提供外部電源)都需要一根隨植入物一起移動的電纜。由於我們每秒大約移動眼睛三次,這會使電纜和涉及的連線暴露在嚴重的機械應力下。對於一個應該在整個生命週期內無需外部干預就能正常工作的裝置來說,這對所涉及的材料和技術提出了嚴峻的挑戰。
生物相容性挑戰
[edit | edit source]除了電氣挑戰之外,視網膜植入物的一個關鍵挑戰是它與生物組織的接觸。當外來物質(如植入物)與生理物質接觸時,會觸發免疫反應。這種反應通常表現為炎症或對該物質的隔離,這通常會導致相關組織的瘢痕形成。對於視網膜植入物來說,這是一個特別的問題,因為假體必須透過組織插入到適當的位置。如果使用的材料過於尖銳或放置不當,可能會損傷組織,從而進一步加劇免疫反應。此外,隨著時間的推移,這些反應會導致電訊號的丟失,因為免疫系統會隨著時間的推移“包裹”受刺激的區域,從而難以實現長期植入。迄今為止,有一種上皮視網膜植入物,Argus II,能夠透過在患者體內植入3年後仍然能夠正常工作來規避生物相容性問題。該植入物利用矽膠,矽膠是一種具有良好長期生物相容性的材料,但它是一種剛性基材,無法輕鬆修改裝置的配置。其他材料如聚醯亞胺和金也已被研究用於視網膜植入物的功能和生物相容性。聚醯亞胺是一種很有前途的聚合物,用於未來的植入物,因為在短期研究中,用這種材料製成的植入物已在人眼上發揮作用。這種材料的優點是生物相容性高、柔韌性好、成本低。隨著技術進步產生更復雜的神經電極陣列,需要不同的基材來實現最大功能,適合視網膜植入物的材料最佳化正在進行中 [8] [9]。
顧名思義,視網膜下植入物是位於視網膜後方的視覺假體。因此,植入物位於最靠近受損感光細胞的位置,旨在繞過視杆和視錐細胞,刺激視網膜中下一層神經層的雙極細胞。這種方法的主要優勢在於,在感光細胞和需要被植入物模擬的雙極細胞之間發生的視覺訊號處理相對較少。也就是說,原始視覺資訊(例如由攝像機捕獲)可以直接轉發,或者分別進行相對簡單的訊號處理,到刺激雙極細胞的 MEA,從訊號處理的角度來看,該過程相當簡單。但是,這種方法也有一些嚴重的缺點。人眼視網膜中感光細胞的高空間解析度,給開發和設計具有足夠高刺激解析度(因此電極間距低)的 MEA 帶來了巨大挑戰。此外,神經層在 z 方向(x-y 平面與視網膜曲率相切)的堆疊,在將電極放置在靠近雙極細胞的位置時增加了另一個困難。由於 MAE 位於視網膜後方,電極和目標細胞之間存在顯著的空間間隙需要克服。如上所述,電極到目標細胞距離的增加迫使 MAE 以更高的電流執行,從而增大了電極尺寸、單個電極刺激範圍內的細胞數量以及相鄰電極之間的空間分離。所有這些都導致刺激解析度降低,以及使視網膜面臨因電荷密度過高而導致組織損傷的風險。如下圖所示,克服電極和目標細胞之間較大距離的一種方法是讓細胞在更長距離上直接在電極頂部生長突起。
2010 年底,一個德國研究小組與德國私營公司“Retina Implant AG”合作,公佈了對人類受試者進行視網膜下植入物測試的研究結果 [10] 。一個 3x3 毫米的微型光電二極體陣列 (MPDA) 包含 1500 個畫素,每個畫素都包含一個獨立的光敏光電二極體和一個電極,被植入三名因黃斑變性而失明的患者的視網膜後方。畫素之間的距離大約為 70 微米,產生大約 160 個電極每平方毫米的空間解析度——或者,正如論文作者所指出的,每個電極的視覺錐角為 15 角分。需要注意的是,與使用外部攝像機生成視覺輸入的植入物不同,MPDA 的每個畫素本身都包含一個光敏光電二極體,它透過眼球接收的光線自主地為其自身的相關電極產生電流。因此,每個 MPDA 畫素在其全部功能上相當於一個感光細胞。這有一個主要優勢:由於 MPDA 固定在人眼視網膜後方,因此當眼球移動時,它會自動隨之移動。並且由於 MPDA 本身接收視覺輸入來生成刺激電極的電流,因此頭部或眼球的運動可以自然地處理,不需要人工處理。在其中一名患者中,MPDA 被放置在黃斑的正下方,導致實驗測試的結果優於另外兩名患者,他們的 MPDA 被植入離視網膜中心較遠的地方。在植入物位於黃斑後方的患者身上取得的結果相當非凡。他能夠識別字母(5-8 釐米大)並閱讀單詞,以及區分不同方向的黑白圖案 [10]。
使用 MPDA 植入物的實驗結果也引起了人們對另一種視覺現象的關注,揭示了 MPDA 方法相對於使用外部成像裝置的植入物的一個額外優勢:隨後的視網膜細胞刺激會迅速導致反應減弱,這表明視網膜神經元在短時間內反覆受到刺激後會受到抑制。這意味著投射到固定在視網膜上或視網膜後方的 MEA 上的視覺輸入將導致感知到的影像快速消失,即使電極的電刺激保持不變。這是因為固定在視網膜上的電極一直在刺激視網膜上的相同細胞,導致細胞隨著時間的推移對持續刺激的敏感性越來越低。然而,這個過程是可逆的,一旦刺激消失,細胞就會恢復其初始敏感性。那麼,完整的視覺系統是如何處理這種效應的呢?為什麼健康的人能夠長時間地固定一個物體而不會消失?如 [11] 中所述,人眼實際上會持續進行小的、不明顯的 眼部運動,導致即使我們傾向於將眼睛集中在某個目標物體上,相同的視覺刺激也會隨著時間的推移投射到視網膜上稍微不同的位置。這成功地規避了細胞反應衰減現象。由於植入物既充當感光細胞又充當電極刺激器,正如 MPDA 的情況一樣,自然的小眼部調整可以很容易地以直接的方式來處理這種效應。其他使用外部視覺輸入(即來自攝像機)的植入方法,如果持續刺激,其投射的影像會消失。快速的人工抖動相機影像可能無法解決問題,因為這種外部運動可能與眼部運動不一致,因此,視覺皮層可能會將其簡單地解釋為一個搖晃的或模糊的場景,而不是期望的固定影像的穩定長期投射。視網膜下植入物的另一個優勢是,視網膜上受刺激的區域與人眼視覺場中感知到的刺激位置之間存在精確的關聯。與 RGC 不同,RGC 在視網膜上的位置可能與它們各自感受野的位置不直接對應,刺激雙極細胞會在與該雙極細胞所在的視網膜幾何位置相對應的視覺場中的那個點被感知到。視網膜下植入物的一個明顯的缺點是,它需要進行侵入性的手術。
視網膜植入物位於視網膜頂部,因此最靠近視網膜神經節細胞 (RGCs)。 因此,視網膜植入物旨在直接刺激 RGCs,繞過受損的光感受器,以及雙極細胞、水平細胞和無長突細胞的任何中間神經視覺處理。 這有一些優勢:首先,視網膜植入物的外科手術程式遠沒有亞視網膜植入物那麼關鍵,因為義肢不需要從眼睛後面植入。 此外,RGCs 的數量遠少於光感受器或雙極細胞,這使得可以用更寬的間距 (至少在視網膜的外周區域)進行更粗粒度的刺激,或者用比實際 RGC 密度更高的電極密度,從而在刺激細胞時獲得更大的靈活性和準確性。 一項關於獼猴視網膜外周傘狀細胞的視網膜刺激研究提供了定量細節 [7]。 傘狀細胞是形成視網膜中第二密集的視覺通路的一種 RGCs。 它們的 主要目的是對視野中物體的運動進行編碼,從而感知運動。 實驗在體外進行,將獼猴視網膜組織放置在 61 電極 MEA (60 微米電極間距) 上。 識別了 25 個獨立的傘狀細胞,並在分析刺激閾值和最佳刺激位置等特性時對它們進行電子刺激。 閾值電流被定義為在 50% 的刺激脈衝 (脈衝持續時間:50 毫秒) 中觸發目標細胞尖峰的最低電流,並透過逐步增加刺激強度來確定,直到記錄到足夠的尖峰響應。 請注意兩個方面:首先,作為 RGCs 的傘狀細胞表現出動作電位行為,而雙極細胞則使用分級電位。 其次,MAE 上的電極既用於刺激脈衝,也用於記錄目標細胞的尖峰響應。 25 個傘狀細胞位於 61 電極 MAE 上,其電極密度明顯高於傘狀細胞密度,有效地在單個傘狀細胞的感受野內產生了多個電極。 除了測量觸發可靠細胞反應所需的刺激閾值外,還確定了最佳刺激位置。 最佳刺激位置是指刺激電極相對於目標細胞的位置,在該位置實現了最低刺激閾值。 令人驚訝的是,發現它不在細胞體上,如預期的那樣,而是在軸突路徑下方約 13 微米處。 從那裡開始,實驗表明刺激閾值電流隨電極到細胞體距離的增加而預期地呈二次方增長。 研究結果還表明,所有刺激閾值都遠低於安全限值 (約 0.05mC/cm²,而 0.1mC/cm² 則是 (低) 安全限值),並且細胞對刺激脈衝的反應很快 (平均 0.2 毫秒的延遲) 且精確 (延遲變化小)。 此外,傘狀細胞密度更高的電極密度允許透過刺激適當的電極來可靠地定址單個細胞,同時防止相鄰細胞也引發尖峰。
替代技術方法概述
[edit | edit source]在本節中,我們將簡要概述一些目前正在研究的替代方法和技術。
奈米管電極
[edit | edit source]傳統的 MAEs 含有由氮化鈦或氧化銦錫製成的電極,這使得植入物面臨長期生物相容性的嚴重問題 [12]。 一種有希望的金屬電極替代品是碳奈米管 (CNT),它結合了許多非常有利的特性。 首先,它們完全生物相容,因為它們是由純碳製成的。 其次,它們的穩固性使它們適合長期植入,這是視覺義肢的關鍵特性。 此外,良好的導電性使它們能夠作為電極執行。 最後,它們的高度多孔性導致極大的接觸表面,鼓勵神經元在 CNT 上生長,從而改善神經元與電極的接觸,降低引發細胞反應所需的刺激電流。 然而,CNT 電極只是最近才出現,目前只有很少的科學結果可用。
無線植入方法
[edit | edit source]視網膜植入物的主要技術挑戰之一是連線 MEA 與外部刺激、電源以及控制訊號的電纜。 電纜上的機械應力會影響其長期穩定性和耐用性,對所用材料提出了巨大挑戰。 無線技術可以繞過實際視網膜植入物與外部裝置之間的任何電纜。 透過眼睛進入的光的能量不足以觸發神經反應。 因此,要使無線植入物發揮作用,必須為植入物提供額外的電源。 斯坦福醫學院提出的一種方法使用紅外 LCD 顯示器將影片攝像頭捕獲的場景投影到護目鏡上,並將紅外脈衝反射到位於視網膜上的晶片上。 該晶片還使用光伏可充電電池為將紅外光轉換為足夠強的刺激脈衝所需的電力提供動力。 與亞視網膜方法類似,這也允許眼睛自然地固定並聚焦到場景中的物體上,因為眼睛可以自由移動,從而使護目鏡上的紅外影像的不同部分投影到位於視網膜上的晶片上的不同區域。 除了使用紅外光外,還可以使用感應線圈將電力和資料訊號從外部裝置傳輸到視網膜上的植入物。 這種技術已在 EPIRET3 視網膜植入物中成功實施和測試 [13]。 然而,這些測試更多的是概念驗證,因為只測試了患者在對電極施加刺激後感知視覺訊號的能力。
定向神經生長
[edit | edit source]使神經元能夠以極低的電流甚至在更長的距離內進行非常精確的神經刺激的一種方法是讓神經元將其突起生長到電極上。 透過將正確的化學溶液應用於視網膜組織,可以鼓勵神經生長。 這可以透過在 MEA 的表面上應用一層層粘連蛋白來實現。 為了控制神經路徑,層粘連蛋白不是均勻地應用於整個 MEA 表面,而是在形成對應於連線的圖案的狹窄路徑中應用,神經元應該形成這些路徑。 這種以精確、圖案化的方式應用層粘連蛋白的過程稱為“微接觸印刷”。 圖 5 顯示了這些層粘連蛋白路徑的外觀。 使用這種方法獲得的成功的定向神經生長使得能夠應用比傳統電極刺激低得多的刺激電流,同時仍然能夠可靠地觸發神經反應 [14]。 此外,刺激閾值不再隨電極-細胞體距離的增加而呈二次方增長,而是在更長的距離 (>200 微米) 內保持恆定在同一低水平。
用於表徵視網膜功能的微電極陣列:基於 CMOS 的技術
[edit | edit source]如視網膜植入物挑戰部分所述,許多微電極陣列的間距很大,電極數量很少,這影響了它們在神經網路中對神經元的特異性和靶向性。 這是能夠觀察神經群體網路動態和功能的限制因素。 具體來說,許多細胞細節,如軸突傳播速度和軸突資訊處理,在低密度陣列中會丟失。 近年來,研究人員利用互補氧化物半導體 (CMOS) 技術建立了具有高空間解析度的高密度微電極陣列,透過鉑黑沉積,這些陣列可以檢測到這種細胞資訊以及高信噪比。 這種陣列可以在 3.85 x 2.10 毫米² 的感測陣列上擁有 26400 個微電極。 隨著 17.5 μm 的間距,電極密度為 3265 個電極/μm²,以配合 1024 個讀出通道 [15]。 由於電極下方有許多開關,因此可以使用各種電極配置來評估晶片上的神經群體。 使用這種靈敏且密集的微電極晶片,可以從神經細胞記錄單細胞識別、網路級分析和軸突資訊。 這種技術為疾病建模和組織功能的電生理表型“生物標誌物”的確定打開了大門,因為解剖後的視網膜可以在微電極陣列上進行培養和記錄 [16]。
視網膜記錄
[edit | edit source]光訊號在視網膜中被解釋,並將該資訊儲存在神經節層的稱為視網膜神經節細胞 (RGC) 的神經元中。然後,這些細胞透過動作電位傳送該資訊,該動作電位可以透過微電極陣列記錄下來,以瞭解視網膜迴路、發育和視覺場景的編碼。這些體外實驗通常首先透過將視網膜從其原生組織中分離出來、將視網膜神經節細胞朝下鋪設在陣列上並使用光刺激進行記錄來進行。之後,使用稍後將解釋的尖峰排序分析資料。可以使用藥物阻滯劑和不同的光刺激來確定光感受器響應和評估功能。此外,研究人員可以評估視網膜突變對 RGC 尖峰行為的影響,以確定電生理生物標誌物。在一個實驗中,研究人員使用微電極陣列用於野生型小鼠視網膜和具有 FRMD7 敲除的小鼠。FMRD7 是一種與受影響個體水平、注視依賴性快速眼球運動相關的突變。微電極陣列記錄會議的資料表明,視網膜中對水平方向選擇性細胞的響應發生了損失。野生型小鼠在水平或垂直方向選擇性細胞中都沒有響應損失。這種發現表明能夠在未來的研究中使用微電極陣列技術來確定視網膜疾病的電生理生物標誌物[17]。

憑藉最新的微電極技術,可以從數千個電極中記錄神經活動,可以分析來自神經組織和網路的大量同步電生理資料,以揭示有關神經系統的相關電氣資訊。在神經科學中使用微電極陣列時,神經元(動作電位)的電訊號是在細胞外記錄的。這意味著在這些記錄中獲取的訊號與膜片鉗相反;動作電位的幅度為負,而不是膜片鉗。這些細胞外特徵不僅包含有關動作電位的資訊,還包含有關突觸機制(區域性場電位)的資訊,可以透過過濾和分析來識別。將這些電生理資訊分配給單個神經元的過程稱為尖峰排序。


微電極記錄中分析的主要記錄方面是尖峰序列。神經元可以透過其尖峰活動來識別,因為每個事件的時機取決於神經元的大小、形狀和相對於電極的位置。在從數千個神經元中記錄時,尖峰排序變得具有挑戰性,類似於雞尾酒會現象。當多個神經元彼此靠近時,電極很容易記錄來自多個神經元的訊號。因此,尖峰排序必須透過其電“喋喋不休”來識別單個神經元,即使存在大量的背景“喋喋不休”。尖峰排序是一個多步驟過程,它採用神經群體中的原始資料並將尖峰分配給單個神經元,即使存在這種背景噪聲。
尖峰排序過程的概述可以包括以下步驟:預處理原始資料→尖峰檢測→尖峰提取和對齊→特徵提取→聚類→分類。在這個一般工作流程中,尖峰排序演算法首先透過過濾掉動作電位(噪聲)的低頻部分來預處理神經群體中的原始資料。然後透過設定電壓閾值檢測尖峰。之後,需要根據動作電位的普遍特徵(例如其位置)將提取的尖峰波形與時間對齊。然後,使用主成分分析或小波從每個單獨的波形中提取特徵,這對於將資料簡化為包含感興趣資訊的必要維度是必要的。然後對尖峰進行聚類,以便為單個神經元建立模板。這對資料中的單個神經元進行。沒有一種“一刀切”的尖峰排序演算法,因為多電極記錄可能因不同的細胞型別、物種和記錄型別而異。因此,必須調整和最佳化演算法才能產生能夠準確表示原始資料的結果。但是,一旦對資料進行尖峰排序,就可以從資料中獲取大量資訊,例如尖峰間隔、不應期,以及能夠將單個神經元的資料彼此繪製以檢測差異的能力[18]。
除了刺激視網膜之外,還可以刺激視覺系統的其他元素
使用套管電極,通常只有幾個部分。
優點
- 對眼睛的創傷很小。
挑戰
- 不太具體。

Mohamad Sawan 博士,蒙特利爾理工學院 Polystim 神經技術實驗室 的教授和研究員,一直在研究一種視覺假體,該假體將被植入人類大腦皮層。Sawan 博士技術的基本原理是透過在由生物相容性材料製成的一系列電極網路上植入一個矽微晶片來刺激視覺皮層,其中每個電極注入一個刺激電流,以在失明者的視野中出現一系列發光點(畫素陣列)。該系統由兩個不同的部分組成:植入物和外部控制器。植入在視覺皮層中的植入物透過無線方式從外部控制器接收專用資料和能量。這種可植入部分包含所有必要的電路,用於產生電刺激並監督變化的微電極/生物組織介面。另一方面,電池供電的外部控制器包含一個捕獲影像的微型攝像頭,以及一個處理器和一個命令生成器,用於處理影像資料以選擇和轉換捕獲的影像,以及生成和管理電刺激過程並監督植入物。外部控制器和植入物透過強大的經皮射頻 (RF) 連結雙向交換資料。植入物也是以相同的方式供電。(維基百科 [1])
優點
- 更大的刺激區域:中央視網膜視野 2° 半徑對應於視網膜上的 1 mm²,但在視覺皮層中對應於 2100 mm²。
挑戰
- 植入更具侵入性。
- 視野的一部分位於溝中,很難到達。
- 刺激可能引發癲癇發作。

人工耳蝸 (CI) 是一種植入的電子裝置,透過直接刺激耳蝸內電極的聽神經纖維來替代聽覺系統的機械部分。人工耳蝸的候選人是雙耳嚴重至極重感音神經性聽力損失且聽覺神經系統正常的人。它們被後天失聰者用於恢復對語音和其他聲音的一些理解,以及被先天失聰的兒童使用,以使他們能夠獲得口語技能。(新生兒和嬰兒聽力損失的診斷使用耳聲發射和/或聽覺誘發電位記錄。)最近一個相當重要的演變是使用雙側植入物,使接受者能夠進行基本的聲音定位。
植入物透過手術放置在耳朵後面的皮膚下。該裝置的基本部分包括
外部
- 一個麥克風,拾取環境中的聲音
- 一個語音處理器,選擇性地過濾聲音以優先考慮可聽語音,並將電聲訊號透過一根細電纜傳送到發射器,
- 一個發射器,它是一個由磁鐵固定在耳廓後面的線圈,透過電磁感應將處理後的聲音訊號傳輸到內部裝置,
內部

- 一個安裝在皮膚下骨骼中的接收器和刺激器,它將訊號轉換為電脈衝,並透過一根內部電纜將電脈衝傳送到電極,
- 一個由多達 24 個電極組成的陣列,纏繞在耳蝸中,它將脈衝傳送到鼓階中的神經,然後透過聽覺神經系統直接傳送到大腦
在正常聽力者中,語音訊號的主要資訊載體是包絡,而音樂則是細微結構。這與像普通話這樣的聲調語言也相關,其中詞語的含義取決於它們的聲調。研究還發現,細微結構中編碼的雙耳時間延遲決定了聲音從哪裡傳來,而不是包絡中編碼的雙耳時間延遲,儘管人們仍然可以感知到包絡中編碼的語音訊號。
人工耳蝸中的語音處理器將麥克風輸入訊號轉換為一系列平行電極訊號,這些訊號將被髮送到耳蝸。這些訊號之間最佳傳遞函式的演算法仍然是研究的活躍領域。第一批人工耳蝸是單通道裝置。原始聲音經過帶通濾波,只包含語音的頻率範圍,然後調製到 16 kHz 波上,以使電訊號能夠與神經進行電耦合。這種方法能夠提供非常基礎的聽力,但非常有限,因為它完全無法利用耳蝸的頻率-位置對映。
多通道植入的出現為嘗試多種不同的語音處理策略打開了大門,以促進聽力。這些策略可以大致分為波形策略和特徵提取策略。
這些策略通常涉及對聲音進行非線性增益(因為具有約 30 dB 動態範圍的輸入音訊訊號必須壓縮成具有約 5 dB 動態範圍的電訊號),然後透過平行濾波器組。第一個嘗試的波形策略是壓縮模擬方法。在這個系統中,原始音訊最初使用增益控制放大器進行濾波(增益控制降低了訊號的動態範圍)。然後將訊號透過平行帶通濾波器,這些濾波器的輸出繼續在適當的位置刺激電極。
壓縮模擬方法的一個問題是,相鄰電極之間存在很強的相互作用效應。如果由兩個濾波器驅動的電極碰巧在同一時間進行刺激,則疊加的刺激會導致來自這兩個電極範圍內毛細胞的訊號產生不必要的失真。解決這個問題的方法是連續交錯取樣方法 - 其中由相鄰濾波器驅動的電極在略微不同的時間進行刺激。這消除了相鄰電極之間的干擾效應,但引入了由於交錯導致時間解析度下降的問題。
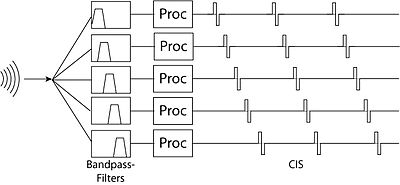
這些策略不太關注傳輸音訊訊號的濾波版本,而更多地關注提取訊號的更抽象的特徵並將它們傳輸到電極。最初的特徵提取策略尋找語音中的共振峰(能量最大的頻率)。為此,它們會應用寬頻濾波器(例如,F0(基共振峰)的 270 Hz 低通濾波器,F1 的 300 Hz-1 kHz 濾波器,F2 的 1 kHz-4 kHz 濾波器),然後使用每個濾波器輸出的過零點計算共振峰頻率,並透過檢視每個濾波器訊號的包絡來計算共振峰幅度。只有對應於這些共振峰頻率的電極會被啟用。這種方法的主要限制是,共振峰主要識別母音,而主要存在於較高頻率的子音資訊則傳輸效果不佳。MPEAK 系統後來透過加入高頻濾波器改進了這種設計,這些濾波器可以透過刺激高頻電極和隨機間隔的共振峰頻率電極來更好地模擬清音(子音)。[19][20][21]

目前,領先的策略是 SPEAK 系統,它結合了波形策略和特徵檢測策略的特性。在這個系統中,訊號透過一個由 20 個帶通濾波器組成的平行陣列。從每個濾波器中提取包絡,並選擇幾個最強頻率(具體數量取決於頻譜形狀),其餘的頻率被丟棄。這被稱為“n-of-m”策略。然後對這些幅度進行對數壓縮,以使聲音的機械訊號範圍適應毛細胞的窄得多的電訊號範圍。
在最新的植入物中,Cochlear 公司使用 3 個麥克風而不是 1 個。額外的資訊用於波束形成,即從正前方提取更多聲音資訊。這可以將與他人交談時的信噪比提高多達 15 dB,從而顯著增強噪聲環境中的語音感知。
透過細緻的手術技巧和仔細的電極設計,可以保留人工耳蝸植入後的低頻聽力。對於保留了低頻聽力的患者,MedEl 公司提供人工耳蝸(用於高頻)和傳統助聽器(用於低頻)的組合。這種被稱為 EAS(電聲刺激)的系統使用 18 毫米的導線,而完整的 CI 則使用 31.5 毫米的導線。(耳蝸的長度約為 36 毫米。)這顯著改善了音樂感知,並改善了聲調語言的語音識別。

對於高頻,人類聽覺系統僅使用音調編碼來獲取資訊。但是,對於低頻,還會使用時間資訊:聽覺神經會同步於訊號的相位而放電。相比之下,最初的人工耳蝸僅使用傳入訊號的功率譜。在其新模型中,MedEl 將低頻的時間資訊(稱為細微結構)納入到刺激脈衝的時間確定中。這改善了音樂感知,以及像普通話這樣的聲調語言的語音感知。
在數學上,可以使用希爾伯特變換優雅地獲得訊號的包絡和細微結構(見圖)。相應的 Python 程式碼可在以下位置獲得:[22]
可用電極的數量受到電極尺寸(以及由此產生的電荷和電流密度)以及沿內淋巴的電流擴散的限制。為了提高頻率特異性,可以刺激兩個相鄰的電極。受試者報告他們感知到一個頻率位於兩個電極之間的單個音調。
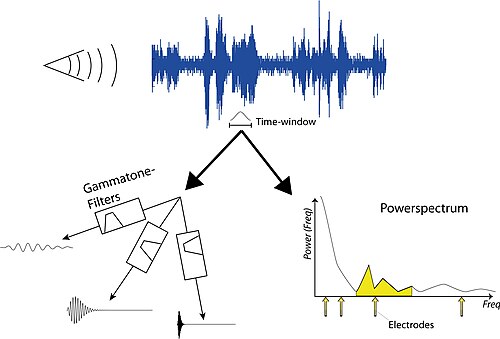
人工耳蝸中的聲音處理仍然是研究的重點,也是製造商之間主要的產品差異之一。但是,基本的聲音處理相當簡單,可以實現以獲得使用人工耳蝸患者感知到的聲音質量的印象。該過程的第一步是對一些聲音進行取樣並分析其頻率。然後選擇一個時間視窗,在此期間我們希望找到 CI 電極的刺激強度。有兩種方法可以實現這一點:i) 透過使用線性濾波器(參見伽馬音濾波器);或 ii) 透過計算功率譜(參見頻譜分析)。
全球已植入超過150,000臺的人工耳蝸 (CI) 現已成為治療重度至極重度聽力損失的標準方法。由於人工耳蝸的益處越來越明顯,支付方也越來越願意支援人工耳蝸,並且由於大多數工業化國家對新生兒的篩查專案,許多患者在嬰兒期就接受了人工耳蝸植入,並且很可能會在一生中一直使用。他們中的一些人可能需要在一生中進行診斷性掃描,而磁共振成像 (MRI) 可以幫助他們進行成像檢查。對於大部分人口,包括中風、背痛或頭痛患者,MRI 已成為診斷的標準方法。MRI 使用磁場脈衝來生成影像,當前的 MRI 機器使用的是 1.5 特斯拉磁場。0.2 到 4.0 特斯拉的裝置很常見,並且射頻功率在 1.5 特斯拉機器中可以達到 6 kW 的峰值。
人工耳蝸在歷史上被認為與大於 0.2 T 的磁場不相容。裝置的外部部件必須始終移除。對於裝置的內部部件,有不同的規定。現行美國食品藥品監督管理局 (FDA) 指南允許在人工耳蝸植入後有限制地使用 MRI。Pulsar 和 Sonata (MED-EL Corp, Innsbruck, Austria) 裝置獲准在磁體到位的情況下進行 0.2 T MRI。Hi-res 90K (Advanced Bionics Corp, Sylmar, CA, USA) 和 Nucleus Freedom (Cochlear Americas, Englewood, CO, USA) 獲准在手術移除內部磁體後進行高達 1.5 T 的 MRI。每次移除和更換磁體都可以使用區域性麻醉下的小切口進行,但該手術可能會削弱磁體的囊袋,並可能導致患者感染。
屍體研究表明,在 1.5 T MRI 掃描器中,植入物可能從內部裝置中移位。然而,當使用加壓敷料時,可以消除這種風險。然而,人工耳蝸會產生偽影,這可能會降低掃描的診斷價值。偽影的大小相對於患者頭部的大小更大,這對於兒童的 MRI 掃描來說可能特別具有挑戰性。Crane 等人 2010 年的一項研究發現,人工耳蝸周圍區域的偽影平均前後尺寸為 6.6 +/- 1.5 cm(平均值 +/- 標準差),左右尺寸平均為 4.8 +/- 1.0 cm(平均值 +/- 標準差)(Crane 等人,2010)。([23])
前庭系統受損的人會經歷一系列症狀,包括聽覺和視覺障礙、眩暈、頭暈和空間定向障礙。目前,對於前庭系統薄弱或受損的患者沒有有效的治療方法。在過去十年中,科學家開發了一種與人工耳蝸類似的電刺激裝置,可以恢復半規管的功能。前庭植入旨在恢復前庭系統受損患者的平衡。圖[24] 顯示了一個前庭植入原型,它是 MED-EL (Innsbruck, Austria) 設計的改進型人工耳蝸。

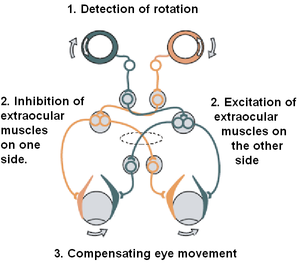
這種前庭神經假體原型包含四個主要元件:一個電刺激器、三個放置在每個半規管壺腹的耳蝸外電極,以及一個耳蝸內陣列。當前庭植入開啟時,以電荷平衡雙相脈衝形式的電刺激序列會沿著每個耳蝸外電極傳送到相應的 vestibular nerve [24]。最終,電刺激透過穩定透過前庭-眼反射 (VOR) 的注視,從而恢復患者的平衡。朝植入式假體方向的進展表明,有效地恢復頭部旋轉的正常前庭感覺傳導取得了令人鼓舞的結果。然而,在不引起不必要的 neuronal activity 的情況下,實現對三維頭部運動進行慢性編碼的準確刺激正規化仍然是幾個關鍵挑戰之一。
1963 年,Cohen 和 Suzuki [25] 透過證明可以透過電刺激前庭神經的壺腹支來誘發眼球運動,從而引入了前庭假體的概念。隨後的研究致力於設計一種連續而準確的刺激模型,用於康復患有不同型別的前庭疾病的患者,例如雙側前庭功能喪失 (BVL) 和美尼爾氏病 [24] [26]。在 Cohen 和 Sukui 開創性工作的四十年後,Merfeld 及其同事開發了首個前庭裝置,透過電刺激前庭神經來產生平滑的眼球運動 [27] [28]。神經電子前庭裝置的可行性進一步激發了研究人員將運動檢測系統整合到一起,以測量頭部運動。Santina 及其同事 [29] [30] [31] [32] 使用陀螺儀感測器來測量三維空間中的運動,並對這些資訊進行編碼以生成訊號,這些訊號透過前庭神經控制每隻眼睛的肌肉。截至 2012 年底,全球只有兩個小組對人類進行了前庭植入研究:華盛頓大學 Jay Rubinstein 領導的團隊,以及由荷蘭馬斯特裡赫特大學醫學中心 Herman Kingma 領導的團隊和由瑞士日內瓦大學醫院 Jean-Phillippe Guyot 領導的第二個團隊的聯合努力 [24]。Jay Rubinstein 在 2010 年領導了第一項前庭臨床研究。Rubinstein 及其同事已成功安裝了前庭起搏器,以減少或停止診斷為美尼爾氏病的患者的自發性眩暈發作 [26]。該裝置與手持控制器相結合,可以啟動和停止可以定向到任何一個或所有電極的一系列電刺激,但不能對運動進行編碼 [26]。不幸的是,植入患者的前庭起搏器導致聽覺和前庭功能都明顯下降 [33] [26] [24]。該小組正在探索不同的電刺激正規化,方法是將有關運動的資訊納入其中 [33]。第二次人類臨床研究是由 Kingma、Guyot 及其同事在 2012 年進行的。本研究中使用的前庭植入由 MED-EL 原型製作。Perez-Fornos 及其同事 [24] 表明,患者獲得了令人滿意的功能性恢復水平,使他們能夠進行日常活動,例如步行。
目前正在透過持續的大學與行業之間的合作取得進展。有四個領先的大學和/或行業合作伙伴正在努力將前庭假體用於臨床應用。這些團隊包括:華盛頓大學的 Rubinstein 和 Cochlear Ltd (Lane Cove, Australia),Della Santina 的團隊在 Johns Hopkins 醫學院 [Baltimore, MD, USA] 的前庭神經工程實驗室,Daniel Merfeld 的團隊在哈佛大學的 Jenks 前庭生理實驗室 [Massachusetts Eye and Ear Infirmary, Boston, MA, USA],以及 Herman Kingma、Jean-Philippe Guyot 和 MED-EL 的聯合努力。
最先進的前庭植入技術是一個兩步式系統,該系統會產生電刺激,以響應圍繞相應軸 (前、後或水平管) 的旋轉,從而刺激三個壺腹神經。然而,假體神經刺激的生物物理學仍然是模擬正常感覺傳導的一個挑戰。儘管我們已經瞭解了前庭神經傳入如何對頭部運動進行編碼,但我們尚未了解如何為多通道假體設計非侵入性刺激編碼策略。積極的研究一直在繼續,重點是克服設計和訊號傳導方面的限制。
目前的腦神經假體旨在刺激植入的腦神經組織,但持續的興奮性刺激會導致神經功能缺損 [26]。最終,人們非常需要一種既能激發一個方向的頭動,又能抑制相反方向的運動的裝置。Santina 及其同事開發的最新原型系統 SCSD1 已證明直流刺激可以引起興奮性和抑制性 VOR 反應 [34]。他們的結果表明,將前庭系統引入人工基線可能會以不可預測的方式改變興奮性和抑制性閾值的動態範圍。另一方面,臨床研究表明,人類可以在合理的時間內(幾分鐘)適應人工神經活動的缺失和存在 [35]。一旦適應完成,就可以調整刺激的幅度和頻率調製,以引發不同速度和方向的平滑眼球運動 [35]。
電假體的另一種設計侷限性是電流會擴散到目標神經組織之外,並引起錯誤的通道刺激 [36] [37]。因此,這種電流擴散會導致眼軸和頭部旋轉之間的錯位 [38]。因此,方向性神經可塑性的機制可以為人類提供對齊良好的反應。其他研究表明,紅外神經刺激對於靶向特定神經元有利,並且對附近的神經元群體侵入性較小 [36] [38]。光學的使用將允許更高的空間選擇性和改善的手術通路 [36]。
此外,前庭假體開發面臨的一個基本挑戰是考慮前庭末端器官的資訊如何引發特定運動。研究表明,反射和感知反應取決於刺激哪些前庭傳入輸入 [33]。對手術方法進行了檢查,以準確地放置電極相對於傳入神經,最終這可能會極大地影響刺激所需反應的能力。
由於內耳的聽覺區和前庭區是相連的,因此電流擴散到目標壺腹神經之外,以及/或手術風險可能會干擾耳蝸神經活動。人類植入後可能會出現聽力損失的風險,正如在恆河猴身上觀察到的那樣 [39]。Santina 及其同事 [39] 發現,電極植入會導致高達 14 dB 的聽力損失,而電刺激的傳遞會進一步降低聽力 0.4-7.8 dB。這項研究表明,電流擴散到耳蝸毛細胞可能會導致附近耳蝸區域的隨機活動。
嗅覺植入
[edit | edit source]
嗅覺喪失(嗅覺喪失)約佔總人口的 5%。完整的嗅覺系統是感知飲酒和進食時的風味的核心部分。大多數出現味覺喪失的問題都是由嗅覺障礙引起的。此外,對氣味的感知也是我們生活質量的核心。許多體驗,如春雨、鮮花或家的氣味,都會增添任何事件,即使難以描述。雖然用區域性和全身類固醇可以解決嗅覺喪失的炎症原因,但針對其他常見嗅覺喪失原因的許多治療方法,包括上呼吸道感染 (URI)、頭部外傷和衰老,尚未被證明有效。

可行性研究
[edit | edit source]Eric H. Holbrook、Sidharth V. Puram 等人進行了一項研究,以確定透過對人類嗅球進行人工電刺激誘發嗅覺的可行性。招募了五名受試者(年齡 43-72 歲)。三名受試者報告在電刺激下感覺到氣味。所有受試者都耐受了這項研究,只有輕微的不適。測試受試者都能夠感知氣味,這已透過市售的 40 項刮嗅識別測試得到證實。在內鏡引導下,無需區域性麻醉,將單極或雙極電極放置在篩板外側薄板與顱底交界處的 3 個區域:(1) 額竇開口後方的前篩板;(2) 蝶骨面前方的後篩板;(3) 中篩板,近似於前點和後點之間距離的一半 [40]。在 0.2-0.3ms 內,對植入物進行刺激,強度範圍為 1 到 20 mA。5 名受試者中的 3 人報告有嗅覺體驗,但無法清楚地說明該氣味類似於什麼,並且彼此之間存在差異。氣味的感知不會隨著不同的強度或電極位置而發生重大變化,但有報道稱微小的偏差被描述為“甜”、“酸”或“壞”。單極或雙極電極之間沒有差異。感知到的氣味被描述為“洋蔥味”、“消毒劑味”或“酸味”,以及“水果味”或“難聞”。當被要求在 1 到 10 的範圍內對感知到的氣味強度進行排名時,結果範圍為 2 到 4。所有受試者還體驗到裝置造成的一些不適,表現為位於接地電極、眼內眥或鼻樑、鼻尖或在一種情況下眼後深處的一種跳動、刺痛或搏動感。放置在嗅裂的電極會導致四名受試者打噴嚏或不適,並且在唯一一名能夠忍受它的人身上沒有出現嗅覺感知。總之,這項研究首次透過嗅球的電刺激實現了嗅覺感知。作者計劃進一步探索此類植入物的使用,並指出“未來的工作將擴充套件試驗,納入沒有嗅覺的受試者,並開發更一致的嗅覺感知客觀測量方法。”這項研究僅旨在作為未來研究嗅覺喪失的嗅覺恢復電刺激技術的可能性概念驗證 [41]。
未來方向
[edit | edit source]氣味的電子測量
[edit | edit source]如今,氣味可以透過多種不同的方式進行電子測量,例如:質譜法、氣相色譜法、拉曼光譜法,以及最近的電子鼻。一般而言,它們假設不同的嗅覺受體對特定分子理化性質具有不同的親和力,並且這些受體的不同啟用會產生反映氣味的時空活動模式。
電子鼻
[edit | edit source]
電子鼻是一種基於化學感測器陣列和模式識別的仿生氣味感測裝置。它們用於識別和量化溶解在空氣(或其他載體物質)中的物質。電子鼻由取樣裝置(類似於鼻子)、感測器陣列(類似於嗅覺受體神經元)和計算單元(類似於大腦)組成。
感測器陣列
[edit | edit source]與動物鼻子一樣,使用非特異性感測器。這不僅是因為很難找到非常特異的感測器,而且還因為人們希望覆蓋巨大的可能化合物範圍,而無需針對每種化合物使用感測器。此外,如果處理基於多個感測器的資訊,則會更加穩健、精確和高效。當這些感測器與化合物接觸時,它們的電效能會發生變化(例如,電阻變大)。這種改變會導致電壓變化,電壓變化會被數字化(AD 轉換器)。
最常用的感測器型別包括金氧半導體 (MOS)、石英晶體微天平 (QCM)、導電聚合物 (CP) 和表面聲波 (SAW) 感測器。另一種很有前途的技術是使用蛋白質作為感測器的生物電子鼻。還可以結合使用不同的感測器來獲得更精確的結果,並結合幾種感測器型別的優點,例如更好的時間響應速度與更好的靈敏度。
示例:導電聚合物感測器的執行原理
[edit | edit source]導電聚合物感測器由約 2 到 40 種不同導電聚合物(長鏈有機分子)陣列組成。一些氣味分子滲透到聚合物薄膜中,導致薄膜膨脹,從而增加其電阻。許多聚合物型別的電阻增加可以用滲流理論來解釋。[42] 由於材料的化學性質,不同的聚合物對相同的氣味反應不同。
感測器訊號必須與模式識別演算法匹配的氣味混合物。可以使用多元統計方法建立潛在組合的資料庫,並在出現氣味時找到最佳匹配,或者可以訓練神經網路來識別模式。通常也使用主成分分析來降低感測器資料的維度。
電子鼻有許多應用。它們被用於航空航天和其他工業領域,以檢測和監測有害或危險物質,以及用於質量控制。安全方面的可能應用包括毒品或炸藥檢測。電子鼻可能有一天能夠取代警犬。一種非常強大的應用可能是診斷改變呼吸或排洩物或血液化學成分的疾病,從而可能取代侵入性診斷技術。它還可以用於診斷癌症,因為某些癌細胞可以透過其揮發性有機化合物譜來識別。透過嗅覺診斷癌症已被發現對狗、蒼蠅有效,[43] 但具有高靈敏度和特異性的實用方法仍在開發中。另一種醫療應用是透過基於電子鼻的嗅覺植入物治療嗅覺缺失症(無法感知氣味)。這同樣仍在開發中。相比之下,電子鼻已用於環境監測和保護。在機器人技術中,電子鼻可用於跟蹤空氣中的氣味或地面的氣味。特別是對於機器人技術而言,更好地瞭解昆蟲的嗅覺系統將非常有趣,因為為了利用氣味導航或定位氣味來源,往往被忽視的時間刺激資訊必須被利用。
昆蟲可以跟蹤氣味,因為它們可以對大約 150 毫秒內的變化做出反應,並且它們的一些受體能夠描繪出至少 10 赫茲以上的頻率發生的快速氣味濃度變化。相比之下,導電聚合物以及金屬氧化物電子鼻的響應時間範圍從幾秒到幾分鐘,[42] 只有少數報道在幾十毫秒範圍內。
- ↑ Larry Squire; et al. (2012). Fundamental Neuroscience 4th edition.
{{cite book}}: Explicit use of et al. in:|author=(help) - ↑ a b c Lan Yue, James D. Weiland, Botond Roska, Mark S. Humayun (2016). "Retinal stimulation strategies to restore vision: Fundamentals and Systems".
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Jackson, G.R., Owsley, C., Curcio, C.A (2002). "Photoreceptor degeneration and dysfunction in aging and age-related maculopathy".
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Shigeru Sato, Yoshihiro Omori; et al. (2008). "Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation".
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Jost B. Jonas, UlrikeSchneider, Gottfried O.H. Naumann (1992). "Count and density of human retinal photoreceptors". Springer.
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Ashmore Jonathan (2008). "Cochlear Outer Hair Cell Motility". American Physiological Society.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ a b c Chris Sekirnjak, PawelHottowy, Alexander Sher, Wladyslaw Dabrowski, Alan M. Litke, E.J. Chichilnisky (2008). “用於人工視網膜植入物設計的靈長類視網膜高解析度電刺激”。神經科學學會。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Jong-Mo Seo; 等 (2004). “用於視網膜刺激的聚醯亞胺微電極陣列的生物相容性”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Eui Tae Kim; 等 (2009). “基於矽樹脂-聚醯亞胺混合材料的人工視網膜微電極陣列 (MEA) 的可行性”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ a b Eui Ta Eberhart Zrenner, KarlUlrich Bartz-Schmidt, Heval Benav, Dorothea Besch, Anna Bruckmann, Veit-Peter Gabel, Florian Gekeler, Udo Greppmaier, Alex Harscher, Steffen Kibbel, Johannes Koch, Akos Kusnyerik, tobias Peters, Katarina Stingl, Helmut Sachs 等.e Kim; 等 (2010). “視網膜下電子晶片讓失明患者能夠閱讀字母並將字母組合成單詞”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ↑ Pritchard Roy. “視網膜上的穩定影像”。
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Asaf Shoval, ChrisopherAdams, Moshe David-Pur, Mark Shein, Yael Hanein, Evelyne Sernagor (2009). “用於有效與視網膜組織連線的碳奈米管電極”。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Susanne Klauke, Michael Goertz, Stefan Rein, Dirk Hoehl, Uwe Thomas, Reinhard Eckhorn, Frank Bremmer, Thomas Wachtler (2011). “使用無線眼內人工視網膜植入物進行刺激在失明人群中引起視覺感知”。視覺與眼科研究協會。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Neville Z. Mehenti, GrehS. Tsien, Theodore Leng, Harvey A. Fishman, Stacey F. Bent (2006). “基於定向神經元生長的單細胞刺激模型視網膜介面”。施普林格。
{{cite journal}}: Cite journal requires|journal=(help)CS1 maint: multiple names: authors list (link) - ↑ Jan Muller; 等 (2015). “用於在亞細胞、細胞和網路水平上研究神經元的 CMOS 高解析度 MEA 平臺”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Fiscella M; 等 (2012). “使用具有即時可切換電極選擇的 CMOS 整合高密度微電極陣列從定義的視網膜神經節細胞群體中記錄”。
{{cite journal}}: Cite journal requires|journal=(help); Explicit use of et al. in:|author=(help) - ↑ Fiscella M, Yonehara K, Drinnenberg A, Franke F, Müller J, Roska B 和 Hierlemann A (2016)。“使用 CMOS 高密度微電極陣列篩選人類眼部疾病的轉基因小鼠模型”。
{{cite journal}}: 引用期刊需要|journal=(幫助)CS1 維護:多個名稱:作者列表 (連結) - ↑ Gaute T Einevoll, Felix Franke, Espen Hagen, Christophe Pouzat 和 Kenneth D Harris (2012)。“使用多電極從數千個神經元獲得可靠的尖峰序列記錄”。
{{cite journal}}: 引用期刊需要|journal=(幫助)CS1 維護:多個名稱:作者列表 (連結) - ↑ http://www.utdallas.edu/~loizou/cimplants/tutorial/tutorial.htm
- ↑ www.ohsu.edu/nod/documents/week3/Rubenstein.pdf
- ↑ www.acoustics.bseeber.de/implant/ieee_talk.pdf
- ↑ T. Haslwanter (2012)。“希爾伯特變換 [Python]”。 私人通訊。
- ↑ Crane BT, Gottschalk B, Kraut M, Aygun N, Niparko JK (2010) 磁共振成像在人工耳蝸植入後 1.5 T 下。Otol Neurotol 31:1215-1220
- ↑ a b c d e f Perez Fornos, A.; Guinand, N.; Van De Berg, R.; Stokroos, R.; Micera, S.; Kingma, H.; Pelizzone, M.; 和 Guyot, J. (2014)。“人工平衡:使用原型前庭神經假體恢復人類前庭眼反射”。神經病學前沿。5。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Cohen, B. 和 Suzuki, J. (1963)。“壺腹神經刺激誘發的眼球運動”。美國生理學雜誌。204: 347–351。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ a b c d e Golub, J. S.; Ling, L.; Nie, K.; Nowack, A.; Shepherd, S. J.; Bierer, S. M.; Jameyson, E.; Kaneko, C. R.; Phillips, J. O.; 和 Rubinstein, J. T. (2014)。“人類前庭系統的假體植入”。耳鼻喉科與神經病學。1: 136–147。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Gong, W. 和 Merfeld, D. M. (2000)。“使用模式化電刺激的原型神經半規管假體”。生物醫學工程年鑑。28: 572–581。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Lewis, R. F.; Haburcakova, C.; Gong, W.; Makary, C.; 和 Merfeld, D. M. (2010)。“使用半規管傳入神經的慢性運動調製電刺激研究前庭眼反射適應”。神經生理學雜誌。103: 1066–1079。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Dai, C.; Fridman, G. Y.; Chiang, B.; Davidovics, N.; Melvin, T.; Cullen, K. E. 和 Della Santina, Charles C. (2011)。“交叉軸適應在使用頭部安裝的多通道前庭假體進行慢性刺激期間改善了 3D 前庭眼反射對準”。實驗腦研究。210: 595–606。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Dai, C.; Fridman, G. Y.; Davidovics, N.; Chiang, B.; Ahn, J. 和 Della Santina, C. C. (2011)。“使用多通道前庭假體恢復恆河猴的 3D 前庭感覺”。聽力研究。281: 74–83。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Dai, Chenkai 和 Fridman, Gene Y. 和 Chiang, Bryce 和 Rahman, Mehdi A. 和 Ahn, Joong Ho 和 Davidovics, Natan S. 和 Della Santina, Charles C. (2013)。“方向可塑性使用多通道前庭假體快速改善了猴子 3D 前庭眼反射對準”。耳鼻喉科研究協會雜誌。14: 863–877。
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Davidovics, Natan S. 和 Rahman, Mehdi A. 和 Dai, Chenkai 和 Ahn, JoongHo 和 Fridman, Gene Y. 和 Della Santina, Charles C. (2013). "利用脈衝速率和電流調製結合預補償對準的多通道前庭假體在猴子中提高了VOR效能". 耳鼻喉研究協會雜誌. 14: 233–248.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ a b c Phillips, Christopher 和 DeFrancisci, Christina 和 Ling, Leo 和 Nie, Kaibao 和 Nowack, Amy 和 Phillips, James O. 和 Rubinstein, Jay T. (2013). "人類受試者前庭末端器官電刺激的姿勢反應". 實驗腦研究. 229: 181–195.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ Fridman, Gene Y. 和 Della Santina, Charles C. (2013). "安全直流電刺激擴充套件神經假體功能". IEEE 神經系統與康復工程學報. 21: 319–328.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ a b Guyot, Jean-Philippe 和 Sigrist, Alain 和 Pelizzone, Marco 和 Kos, Maria I. (2011). "人類前庭系統穩態電刺激的適應". 耳鼻喉年鑑. 120: 143–149.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ a b c Harris, David M. 和 Bierer, Steven M. 和 Wells, Jonathon D. 和 Phillips, James O. (2009). "前庭假體的光神經刺激". SPIE 論文集. 5.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ Della Santina, Charles C. 和 Migliaccio, Americo A. 和 Patel, Amit H. (2007). "使用電刺激恢復三維前庭感覺的多通道半規管神經假體". IEEE 生物醫學工程學報. 54: 1016–1030.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ a b Lumbreras, Vicente 和 Bas, Esperanza 和 Gupta, Chhavi 和 Rajguru, Suhrud M. (2014). "脈衝紅外輻射透過調節線粒體鈣迴圈激發培養的新生耳蝸和前庭神經節神經元". 神經生理學雜誌.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ a b Dai, Chenkai 和 Fridman, Gene Y. 和 Della Santina, Charles C. (2011). "前庭假體電極植入和刺激對恆河猴聽力的影響". 聽力研究. 277: 204–210.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ Holbrook EH,Puram SV,See RB,Tripp AG,Nair DG。(2019)。“透過經篩骨電刺激嗅球誘發嗅覺”。國際過敏與鼻科論壇. 2019, 9: 158–164.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ Holbrook EH,Puram SV,See RB,Tripp AG,Nair DG。(2019)。“透過經篩骨電刺激嗅球誘發嗅覺”。國際過敏與鼻科論壇. 2019, 9: 158–164.
{{cite journal}}: CS1 maint: 多個姓名:作者列表 (link) - ↑ a b Arshak, K.;Moore, E.;Lyons, G.M.;Harris, J.;Clifford, S. (2004 年 6 月)。“電子鼻應用中氣體感測器的綜述”。感測器綜述. 24 (2): 181–198. doi:10.1108/02602280410525977.
- ↑ Strauch, Martin; Lüdke, Alja; Münch, Daniel; Laudes, Thomas; Galizia, C. Giovanni; Martinelli, Eugenio; Lavra, Luca; Paolesse, Roberto; Ulivieri, Alessandra; Catini, Alexandro; Capuano, Rosamaria; Di Natale, Corrado (2014年1月6日). "不僅僅是蘋果和橘子——用果蠅的觸角檢測癌症". 科學報告. 4. doi:10.1038/srep03576.
神經元的光刺激是一個新興的研究領域。透過將聚焦的光源照射到神經細胞上,使其去極化來實現神經元的發射。實現這一目標主要有兩種方法:用雷射照射神經元,產生區域性溫度梯度;以及將對光敏感的通道或受體匯入神經細胞,使其對光敏感,類似於人眼視網膜中的視杆細胞和視錐細胞。與傳統的電刺激相比,光刺激的優勢在於更高的精確度和更少的組織損傷或沒有組織損傷。[1]
與光刺激相比,電刺激存在著固有的侷限性。為了引發可靠的神經元發射,電極必須與目標組織物理接觸或非常靠近目標組織。將電極植入神經組織會導致神經組織及其周圍組織的損傷。
在許多情況下,電極陣列被植入導電組織中,這會導致電流擴散,進一步降低了可以達到的空間解析度。
誘發的神經元活動的測量結果往往會被比測量的腦活動大得多的刺激偽影汙染。在靠近興奮部位進行測量時,尤其如此。
相比之下,光刺激可以可靠地實現單個細胞或小群細胞的興奮。它不需要直接接觸目標組織,從而減少了組織損傷。最後,靠近興奮部位的神經元反應的電生理記錄不會被興奮刺激汙染。[1] [2] [3] 儘管電刺激存在上述缺點,但它仍然是患者神經刺激中最成熟、最可靠的方法。
紅外刺激是基於紅外雷射在神經元內部產生區域性溫度梯度。它不需要在刺激前對細胞進行任何改造。低能量雷射不會對組織造成損傷,並能引發無偽影的刺激。導致神經元放電的確切機制尚不清楚。然而,研究表明,這種現象很可能是由於區域性光熱過程造成的。因此,紅外輻射會產生侷限在很小空間內的溫度梯度,並在輻射停止後迅速消失。高達 9°C 的區域性溫度升高被認為會導致分子構象發生變化,最終導致神經元放電。在高輻射頻率下,熱量會疊加,導致受照射的組織逐漸升溫,最終損害細胞。[2][3]
視光遺傳學是指透過匯入外源基因使細胞對光敏感,從而能夠以高時空解析度地改變神經元發射模式。這些基因可以在動物的基因改造過程中表達,也可以透過病毒等載體匯入。如今,大多數用於光敏基因的基因最初是在單細胞生物體如藻類或古細菌中發現的。這些基因可以編碼光敏離子通道或受體,產生對光刺激的不同反應。

對於神經元啟用,通常使用天然視紫紅質通道(ChR)或其基因工程改造的變體。ChRs 是對光敏感的非特異性陽離子通道,當用藍光(480nm)激發時,通道會開啟。在神經細胞中,ChR 開放會導致鈉離子湧入和膜去極化。[4] [5] 光敏成分是全反式視黃醛,它也存在於人眼視網膜中。光誘導全反式視黃醛到 13-順式視黃醛的構象變化,從而允許陽離子穿過通道。[4][5][6][7] 在視黃醛結合位點附近引入特定的點突變可以改變通道的動力學特性和特異性。[8] 將 ChR 與其他蛋白質連線可以產生具有多種功能的工具,例如對匯入構建體的體內監測。[9]
視紫紅質鹵素(HR)是用於光啟用的神經元抑制的光控氯離子泵。在敏感的神經元中,黃光(570nm)的光學激發會導致氯離子進入細胞併發生超極化。[10][11] 與 ChR 一樣,光敏分子也是全反式視黃醛。由於 HR 和 ChR 中視黃醛的穩定性不同,以及由此產生的波長敏感性差異,它們可以在同一個細胞中使用,並分別進行靶向。這使得能夠對神經迴路中的活動進行非常精確的控制。[11][12]
為了光學控制細胞通路,開發了 Opto-XR 蛋白質,[13] 其中 X 代表目標訊號通路。Opto-XRs 由動物視紫紅質(牛、大鼠等)組成,其胞內結構域被細胞的訊號序列替換。[14] 這使得能夠對細胞的訊號通路進行光學調節。訊號序列可以透過光落在視紫紅質上誘導的構象變化來啟用或失活。這使得能夠特異性地啟用某些受體通路,如血清素或腎上腺素訊號通路。[13][15]
在神經假體中,電刺激長期以來一直被用於誘發神經元放電。然而,電流的擴散和電場的產生限制了可以實現的空間解析度。這限制了傳輸訊號的保真度。[16] 在聽覺假體的情況下,最多可以使用大約二十個電極,這使得所獲得的音質遠遠低於預期目標。轉向光學技術可以實現更小區域的啟用,從而增加潛在感知音調的數量。最近光學刺激技術的發展為克服這些障礙並改善假體裝置和患者的生活質量提供了希望。
人工耳蝸
[edit | edit source]在各種動物模型(如齧齒動物和貓)中,已經測試了耳蝸和聽覺神經的紅外線刺激。光學變體在雷射刺激的區域方面顯示出顯著的精度,該區域的大小與中等響度音調啟用的區域大小大致相同。研究還表明,使用低能量紅外輻射,可以實現持續刺激,而不會造成組織的逐漸升溫或損傷。這使得植入物可以在一天內使用,而不會損壞耳蝸系統。紅外刺激的主要缺點是與電刺激相比,能量消耗要高得多。[2]
為了克服上述能量問題,研究人員開始在齧齒動物中測試光遺傳學方法。他們對小鼠進行了基因改造,使之在脊髓神經節神經元中表達通道視紫紅質。神經細胞的敏感性降低了誘發放電所需的能量,與紅外輻射相比降低了七倍(紅外:15 μJ,光遺傳學:2 μJ,電刺激:0.2 μJ)。因此,可以使用 μLED 而不是雷射進行刺激。儘管取得了這些進展,但在不久的將來將該技術應用於人類仍存在疑問。這主要是因為將遺傳物質引入生物體中可能存在病毒感染的風險。到目前為止,只有極少數基因療法獲得批准。必須實施並批准一種安全且有效的方式來特異性感染耳蝸器官。[17]
已經註冊了描述針對人類的潛在光學耳蝸植入物的首批專利。這些植入物的功能類似於傳統的電學植入物。但是,它們使用的是垂直腔面發射雷射器 (VCSEL),而不是電極,這些雷射器由植入物的輸入裝置驅動。VCSEL 是可以安裝在植入物小型管中的雷射發射二極體。雷射器指向 Corti 器官,並且可以比電極更緊密地間隔,從而使植入物輸出通道的數量增加了一倍以上。雷射二極體用於更高音調的訊號傳遞,而電極驅動較低振幅的神經細胞。[18]
前庭假體
[edit | edit source]前庭假體旨在恢復因前庭系統功能障礙而引起的不平衡問題。由於半規管相互連線,電流擴散是電刺激傳遞中的一個主要問題。電流擴散會導致對不需要的半規管的額外刺激,從而導致傳送到大腦的平衡訊號錯誤。已經研究了使用紅外輻射的可能性。對壺腹的照射沒有誘發動作電位。刺激失敗的原因可能在於毛細胞對紅外輻射不敏感。然而,前庭神經的光學刺激可能是可行的。目前尚不清楚以這種方式是否可以單獨刺激來自不同壺腹的神經。[2][19]
參考文獻
[edit | edit source]- ↑ a b Szobota, Stephanie; Isacoff, Ehud Y (2010). "Optical control of neuronal activity". Annual review of biophysics. 39: 329–348.
{{cite journal}}: Cite has empty unknown parameter:|1=(help) - ↑ a b c d Richter, Claus-Peter; Matic, Agnella Izzo; Wells, Jonathon D; Jansen, E Duco; Walsh, Joseph T (2011). "Neural stimulation with optical radiation". Laser & photonics reviews. 5 (1): 68–80.
- ↑ a b Wells, Jonathon D; Cayce, Jonathan M; Mahadevan-jansen, Anita; Konrad, Peter E; Jansen, E Duco (2011). "Infrared Nerve Stimulation: A Novel Therapeutic Laser Modality". Optical-Thermal Response of Laser-Irradiated Tissue (2 ed.). Dordrecht: Springer Netherlands. pp. 915–939.
- ↑ a b Berthold, Peter; Tsunoda, Satoshi P; Ernst, Oliver P; Mages, Wolfgang; Gradmann, Dietrich; Hegemann, Peter (2008). "Channelrhodopsin-1 initiates phototaxis and photophobic responses in chlamydomonas by immediate light-induced depolarization". The Plant cell. 20 (6): 1665–1677.
- ↑ a b Nagel, Georg; Szellas, Tanjef; Huhn, Wolfram; Kateriya, Suneel; Adeishvili, Nona; Berthold, Peter; Ollig, Doris; Hegemann, Peter; Bamberg, Ernst (2003). "Channelrhodopsin-2, a directly light-gated cation-selective membrane channel". Proceedings of the National Academy of Sciences. 100 (24): 13940–13945.
- ↑ Bamann, Christian; Kirsch, Taryn; Nagel, Georg; Bamberg, Ernst (2008). "Spectral characteristics of the photocycle of channelrhodopsin-2 and its implication for channel function". Journal of Molecular Biology. 375 (3): 686–694.
- ↑ Ernst, Oliver P; Sánchez Murcia, Pedro a; Daldrop, Peter; Tsunoda, Satoshi P; Kateriya, Suneel; Hegemann, Peter (2008). "通道視紫紅質的光活化". 生物化學雜誌. 283 (3): 1637–1643.
- ↑ Gunaydin, Lisa; Yizhar, Ofer; Berndt, André; Sohal, Vikaas S; Deisseroth, Karl; Hegemann, Peter (2010). "超快光遺傳學控制". 自然神經科學. 13 (3): 387–392.
- ↑ Lin, John Y; Lin, Michael Z; Steinbach, Paul; Tsien, Roger Y (2009). "具有改進效能和動力學的工程化通道視紫紅質變體的表徵". 生物物理學雜誌. 96 (5): 1803–1814.
- ↑ Duschl, A; Lanyi, JK; Zimanyi, L (1990). "來自嗜鹽鹼菌,法拉奧嗜鹽菌的滷視紫紅質的性質和光化學". 生物化學雜誌. 265: 1261–1267.
- ↑ a b Zhang, Feng; Wang, Li-Ping; Brauner, Martin; Liewald, Jana F; Kay, Kenneth; Watzke, Natalie; Wood, Phillip G; Bamberg, Ernst; Nagel, Georg; Gottschalk, Alexander; Deisseroth, Karl (2007). "神經迴路的多模式快速光學詢問". 自然. 446 (7136): 633–639.
- ↑ Han, Xue; Boyden, Edward S (2007). "神經活動的多色光學啟用、沉默和去同步,具有單脈衝時間解析度". Plos one. 2 (3): e299.
- ↑ a b Kim, Jong-myoung; Hwa, John; Garriga, Pere; Reeves, Philip J; Rajbhandary, Uttam L; Khorana, H Gobind (2005). "包含β2腎上腺素受體胞質環的嵌合視紫紅質的光碟機動啟用β2腎上腺素受體訊號傳導". 生物化學. 44 (7): 2284–2292.
- ↑ Airan, Raag D; Thompson, Kimberly R; Fenno, Lief E; Bernstein, Hannah; Deisseroth, Karl (2009). "細胞內訊號傳導的時間精確體內控制". 自然. 458 (7241): 1025–1029.
- ↑ Oh, Eugene; Maejima, Takashi; Liu, Chen; Deneris, Evan; Herlitze, Stefan (2010). "透過光啟用的G蛋白偶聯受體替代5-HT1A受體訊號傳導". 生物化學雜誌. 285 (40): 30825–30836.
- ↑ McGill, K C; Cummins, K L; Dorfman, L J; Berlizot, B B; Leutkemeyer, K; Nishimura, D G; Widrow, B (1982). "關於使用表面電極誘發和記錄的神經訊號中刺激偽影的性質和消除". IEEE 生物醫學工程學報. 29 (2): 129–137.
- ↑ Hernandez, VH; Gehrt, Anna; Reuter, Kirsten; Jing, Zhizi; Jeschke, Marcus; Schulz, Alejandro Mendoza; Hoch, Gerhard; Bartels, Matthias; Vogt, Gerhard; Garnham, Carolyn W.; Yawo, Hiromu; Fukazawa, Yugo; Augustine, George J.; Bamberg, Ernst; Kügler, Sebastian; Salditt, Tim; Hoz, Livia de; Strenzke, Nicola; Moser, Tobias (2014). "聽覺通路的 optogenetic 刺激". 臨床研究雜誌. 124 (3): 1114–1129.
- ↑ 具有頂端電極的光刺激人工耳蝸,用於耳蝸頂端螺旋神經節細胞的電刺激, 2013年1月24日
{{citation}}: Check date values in:|publication-date=(help); Unknown parameter|country-code=ignored (help); Unknown parameter|inventor-first=ignored (help); Unknown parameter|inventor-last=ignored (help); Unknown parameter|inventor2-first=ignored (help); Unknown parameter|inventor2-last=ignored (help); Unknown parameter|issue-date=ignored (help); Unknown parameter|patent-number=ignored (help) - ↑ Harris, DM; Bierer, SM (2009). "用於前庭假體的光學神經刺激". SPIE 會議論文集. 5: 71800R.


