感覺系統/非靈長類動物
| 一位華夏公益教科書使用者認為此頁面應該拆分為更小的頁面,具有更窄的子主題。 您可以透過將此大頁面拆分為更小的頁面來提供幫助。請確保遵循命名策略。將書籍劃分為更小的部分可以提供更多重點,並允許每個部分專注於一項任務,這對每個人都有益。 |
靈長類動物是屬於哺乳動物綱的動物。靈長類動物包括人類和非人靈長類動物,即猿類、猴類、狐猴類、樹鼩、懶猴、眼鏡猴和跗猴。它們的特徵是前腦體積大且結構複雜。大多數靈長類動物的視力極佳,並且高度適應樹棲生活,包括某些物種擁有抓握的尾巴。另一方面,非靈長類動物通常擁有更小的腦。但隨著我們對動物界的其他成員瞭解越來越多,越來越明顯的是,非靈長類動物也非常聰明。一些例子包括豬、章魚和烏鴉。[1]
在許多神話分支中,烏鴉扮演著狡猾的騙子角色,而在現實世界中,烏鴉被證明是一個非常聰明的物種。人們發現烏鴉會進行諸如使用工具、季節性儲存食物、類似情景記憶以及根據個人經驗預測未來情況等行為。
事實證明,成為一隻豬其實是一種非常聰明的策略。豬可能是地球上最聰明的家養動物。儘管它們的原始智力可能與狗或貓相當,但它們的解決問題的能力超過了貓科動物和犬類朋友。
如果豬是最聰明的家養物種,那麼章魚則在無脊椎動物中名列前茅。迷宮和解題實驗表明,章魚既有短期記憶,也有長期記憶。章魚可以開啟罐子,擠過狹窄的縫隙,從一個籠子跳到另一個籠子尋找零食。它們也可以接受訓練來區分不同的形狀和圖案。在一種類似遊戲的活動中(這是一種高階智力物種的標誌),人們觀察到章魚會反覆將瓶子或玩具釋放到水族館的環形水流中,然後捕捉它們。
在過去的四十年裡,鳴禽已成為神經科學家研究複雜順序行為和感覺引導運動學習的廣泛使用模型生物。像人類嬰兒一樣,年輕的鳴禽透過模仿成年鳥學習它們用來進行交流的許多聲音。斑胸草雀(Taeniopygia guttata)是一種鳴禽,因為它容易在人工環境中鳴叫和繁殖,並且成熟速度快,因此成為許多研究的焦點。成年雄性斑胸草雀的鳴聲是一系列定型的聲學訊號,其結構和調製跨越了從毫秒到幾秒的廣泛時間尺度。成年斑胸草雀的鳴聲由重複的聲序列組成,稱為主題,持續約一秒鐘。主題由更短的聲音爆發組成,稱為音節,音節通常包含更簡單聲學元素的序列,稱為音符,如圖 1 所示。鳴禽的學習系統是一個非常好的模型,可以研究感覺運動整合,因為幼鳥積極地傾聽導師並透過校正音調和偏移的錯誤來調節自己的鳴聲。鳴禽大腦的神經機制和結構在學習中起著至關重要的作用,與人類前額葉皮層中的語言處理區域相似。詳細研究參與學習過程的分層神經網路可以為深入瞭解人類言語學習的神經機制提供重要見解。

鳴禽的歌曲學習過程分為幾個階段,從感覺階段開始,幼鳥只是聽其導師(通常是其父親)發聲,通常自己不發出任何類似歌曲的叫聲。幼鳥利用這個階段記憶導師歌曲的特定結構,形成歌曲的神經模板。然後它進入感覺運動階段,開始模仿歌曲並利用聽覺反饋糾正錯誤。早期模仿導師歌曲的模板非常嘈雜、無結構且多變,稱為“雛歌”。圖 1 中的聲譜圖顯示了一個例子。在接下來的幾天裡,鳥兒進入“可塑階段”,此時負責生成高度結構化音節的神經網路具有很大的可塑性,歌曲的變異性也降低。到它們性成熟時,變異性基本上消失了——這個過程稱為“結晶”——幼鳥開始發出正常的成年歌曲,這可能是導師歌曲的驚人模仿(圖 1)。因此,從早期的雛歌到成年歌曲,歌曲變異性的逐漸降低,以及模仿質量的逐漸提高,是鳴禽發聲學習的一個重要方面。在接下來的部分中,我們將探討鳴禽大腦的幾個部分以及負責這些鳥類中觀察到的這種非凡的發聲模仿的潛在神經機制。
詳細瞭解鳴禽的神經解剖結構非常重要,因為它提供了關於各種運動和感覺整合通路中學習機制的重要資訊。這最終可以闡明人類的語言處理和發聲學習。目前尚不清楚人類語音處理系統的精確神經解剖學資料,鳴禽的解剖結構和生理學將使我們能夠提出合理的假設。本章最後一部分(圖 6)對哺乳動物大腦和鳴禽(鳥類)大腦進行了比較。在鳥類大腦中觀察到的通路可以大致分為運動控制通路和前腦通路,如圖 2 所示。聽覺通路提供誤差反饋訊號,導致參與運動通路的突觸連線的增強或抑制,這對發聲學習起著重要作用。運動控制通路包括腹側紋狀體,尾部(HVC),頂蓋核(RA),舌下神經核的喉氣管亞群(nXIIts)和鳴管。該通路對於產生產生高度結構化歌曲所需的運動控制訊號以及協調呼吸和唱歌至關重要。前腦通路包括前腦背側丘腦外側鉅細胞核(LMAN),X 區(X)以及背外側丘腦內側核(DLM)。該通路在幼鳥的歌曲學習、成鳥的歌曲變異性和歌曲表徵中起著至關重要的作用。聽覺通路包括黑質(SNc)和腹側被蓋區(VTA),它們在聽覺輸入處理和分析反饋誤差中起著至關重要的作用。鳴管的肌肉由來自 nXIIts 的運動神經元的一個子集支配。一個主要投射到 nXIIts 的來自前腦核 RA 中的神經元。RA 核接受來自另一個皮質類似物,HVC 核的運動相關投射,而 HVC 核又直接接受來自幾個腦區(包括丘腦 uva 核(Uva))的輸入。

HVC 核和 RA 核以層次化的方式參與歌曲的運動控制(Yu 和 Margoliash 1996)。對鳴唱的斑胸草雀的記錄表明,投射到 RA 的 HVC 神經元傳遞一種極其稀疏的突發模式:每個投射到 RA 的 HVC 神經元在歌曲中的某個特定時間生成一個持續時間約為 6 毫秒的單個高度定型突發(Hahnloser、Kozhevnikov 等,2002)。在鳴唱過程中,RA 神經元產生一系列複雜的、高頻的尖峰突發,其模式每次鳥兒鳴唱其歌曲主題時都會精確地複製(Yu 和 Margoliash 1996)。在主題期間,每個 RA 神經元產生一個相當獨特的模式,大約有 12 個突發,每個突發持續約 10 毫秒(Leonardo 和 Fee 2005)。基於投射到 RA 的 HVC 神經元在歌曲主題期間產生單個尖峰突發以及不同神經元似乎在主題中的許多不同時間突發這一觀察結果,人們假設這些神經元隨著時間推移產生連續的活動序列(Fee、Kozhevnikov 等,2004,Kozhevnikov 和 Fee 2007)。換句話說,在歌曲的每個時刻,都有一小組 HVC(RA)神經元在那個時間(僅在那個時間)處於活躍狀態(圖 3),並且每個小組會短暫地啟用(約 10 毫秒)由 HVC 神經元在 RA 中的突觸連線決定的 RA 神經元的一個子集(Leonardo 和 Fee 2005)。此外,在這個模型中,肌肉活動的向量(因此是聲帶器官的配置)由 RA 神經元在約 10 到 20 毫秒的短時間尺度上對運動神經元的收斂輸入決定。RA 神經元可能僅僅以某種有效權重短暫地影響聲帶肌肉活動的觀點與靈長類動物皮層控制手臂運動的一些模型一致(Todorov 2000)。許多研究表明,歌曲的時間是由穿過 HVC 神經元的一種稀疏傳播的活動波或鏈在毫秒級控制的。這一假設得到了對自然鳴唱過程中的時間變異性的分析(Glaze 和 Troyer 2007)以及對操縱 HVC 中電路動力學以觀察對歌曲時間的影響的實驗的支援。因此,在這個模型中,歌曲的時間由活動在 HVC 中的鏈中的傳播控制;這種 HVC 鏈的通用順序啟用透過 HVC 在 RA 中的連線轉化為特定精確的聲帶配置序列。

人們已經發現了許多與歌曲相關的鳴禽腦區(圖 4A)。歌曲產生區域包括 HVC(腹側紋狀體,尾部)和 RA(弓狀體核),它們產生一系列神經活動模式,並透過運動神經元控制鳴唱過程中發聲器官的肌肉(Yu 和 Margoliash 1996,Hahnloser、Kozhevnikov 等,2002,Suthers 和 Margoliash 2002)。HVC 或 RA 的損傷會導致歌曲的立即喪失(Vicario 和 Nottebohm 1988)。前腦通路(AFP)中的其他區域似乎對歌曲學習很重要,但至少對成鳥來說並不重要。AFP 被認為是哺乳動物基底神經節丘腦皮層環路的鳥類同源物(Farries 2004)。特別是,LMAN 區(前腦背側鉅細胞核)的損傷對成鳥的歌曲產生沒有立即影響,但會阻止幼鳥的歌曲學習(Doupe 1993,Brainard 和 Doupe 2000)。這些事實表明,LMAN 在驅動歌曲學習中起著作用,但可塑性的部位是在與歌曲產生相關的腦區,例如 HVC 和 RA。Doya 和 Senjowski 在 1998 年提出了一個三方模式,其中學習基於行為者和批評者之間的相互作用(圖 4B)。批評者評估行為者在所需任務中的表現。行為者使用這種評估進行改變,從而改進其表現。為了透過反覆試驗進行學習,行為者每次以不同的方式執行任務。它會產生好的和壞的變體,而批評者的評估用於加強好的變體。通常假設行為者會自己產生變體。但是,變體的來源來自行為者外部。我們稱此來源為實驗者。行為者被認為是 HVC、RA 和控制發聲的運動神經元。行為者透過 HVC 到 RA 的突觸的可塑性進行學習(圖 4C)。根據在歌曲學習過程中發生的 HVC 到 RA 投射中的軸突生長和退縮等結構變化的證據,這種觀點被廣泛認為是一種合理的機制。對於實驗者和批評者,Doya 和 Senjowski 認為是前腦通路,假設批評者是 X 區,而實驗者是 LMAN。

|
生物物理學上可行的模型
正引數 ,稱為學習率,控制突觸變化的整體幅度。資格跡 是一個存在於每個塑性突觸的假設量。它表示突觸是否“有資格”被強化修改,並且基於塑性突觸的最近啟用和經驗突觸到同一 RA 神經元的啟用 這裡 是經驗性(LMAN->RA)突觸到RA神經元的電導率。時間濾波器 *G(t)* 假設為非負數,其形狀決定了資格痕跡可以“記住”過去的時長。經驗性突觸的瞬時啟用取決於平均活動 。學習原則遵循 (圖5) 中顯示的兩個基本規則。第一條規則:如果可塑性 (HVC->RA) 突觸和經驗性 (LMAN->RA) 突觸到同一個 RA 神經元的同步啟用之後是正強化,那麼可塑性突觸就會增強。第二條規則:如果可塑性突觸啟用而沒有經驗性突觸到同一個 RA 神經元的啟用,之後是正強化,那麼可塑性突觸就會減弱。這些基於執行器神經元的動態電導率擾動的規則對強化訊號的期望值進行隨機梯度上升。這意味著由評價者評估的鳴叫表演平均而言肯定會得到改善。
|
哺乳動物和鳴禽大腦結構的比較
[edit | edit source]鳥類 X 區與哺乳動物基底神經節 (BG) 同源,包括紋狀體和蒼白球細胞型別。BG 形成一個高度保守的解剖學回路,經過多個站,從皮層到 BG(紋狀體和蒼白球),然後到丘腦,再回到皮層。在鳴禽中也觀察到類似的迴路:皮質類似物核 LMAN 投影到 X 區,其紋狀體成分投影到丘腦核 DLM,然後投射回 LMAN。紋狀體成分解釋了基於獎勵的學習和強化學習。如 (圖6) 所示,鳥類 X 區的神經元型別及其功能與人類基底神經節完全相當。這種緊密的解剖學相似性促使我們更詳細地瞭解鳴禽大腦,因為有了它,我們終於可以對人類語言學習有了一些重要的理解,並能更精確地治療許多與語言相關的疾病。

參考文獻
[edit | edit source]Brainard, M. S. 和 A. J. Doupe (2000)。“聽覺反饋在學習和維持發聲行為中的作用”。Nat Rev Neurosci 1(1): 31-40。
Dembo, A. 和 T. Kailath (1990)。“無模型分散式學習”。IEEE Trans Neural Netw 1(1): 58-70。
Doupe, A. J. (1993)。“專門用於聲音學習的神經迴路”。Curr Opin Neurobiol 3(1): 104-111。
Farries, M. A. (2004)。“從比較角度看鳥類鳴叫系統”。Ann N Y Acad Sci 1016: 61-76。
Fee, M. S.、A. A. Kozhevnikov 和 R. H. Hahnloser (2004)。“鳴禽發聲序列產生的神經機制”。Ann N Y Acad Sci 1016: 153-170. Glaze, C. M. 和 T. W. Troyer (2007)。“鳴叫鳥類時間精確運動程式碼的行為測量”。J Neurosci 27(29): 7631-7639。
Hahnloser, R. H.、A. A. Kozhevnikov 和 M. S. Fee (2002)。“超稀疏程式碼是鳴禽神經序列產生的基礎”。Nature 419(6902): 65-70。
Kozhevnikov, A. A. 和 M. S. Fee (2007)。“斑胸草雀已識別 HVC 神經元中與鳴叫相關的活動”。J Neurophysiol 97(6): 4271-4283。
Leonardo, A. 和 M. S. Fee (2005)。“鳴禽發聲控制的整體編碼”。J Neurosci 25(3): 652-661。
Seung, H. S. (2003)。“透過增強隨機突觸傳遞進行尖峰神經網路學習”。Neuron 40(6): 1063-1073。
Suthers, R. A. 和 D. Margoliash (2002)。“鳴叫鳥類鳴叫的運動控制”。Curr Opin Neurobiol 12(6): 684-690。
Todorov, E. (2000)。“隨意手臂運動中肌肉啟用的直接皮質控制:模型”。Nat Neurosci 3(4): 391-398。
Vicario, D. S. 和 F. Nottebohm (1988)。“斑胸草雀鳴叫控制系統的組織:I. 舌下神經核中鳴管肌肉的表示”。J Comp Neurol 271(3): 346-354。
Yu, A. C. 和 D. Margoliash (1996)。“鳥類鳴叫的時間層次控制”。Science 273(5283): 1871-1875。
章魚
[edit | edit source]介紹
[edit | edit source]最有趣的非靈長類動物之一是章魚。關於這種非靈長類動物最有趣的特點是它的手臂運動。在這些無脊椎動物中,手臂的控制特別複雜,因為手臂可以向任何方向移動,具有幾乎無限的自由度。在章魚中,大腦只需要向手臂發出一個指令來執行動作——如何執行的完整方案本身就嵌入在手臂中。觀察表明,章魚透過將手臂運動保持在設定的、刻板的模式中,降低了控制手臂的複雜性。為了找出章魚手臂是否擁有自己的意識,研究人員切斷了章魚手臂中的神經與身體中其他神經的連線,包括大腦。然後,他們觸碰並刺激手臂上的皮膚。手臂的行為與健康章魚的行為完全相同。這意味著大腦只需要向手臂發出一個單一的移動指令,手臂就會完成剩下的動作。
本章詳細討論了章魚的感覺系統,並重點關注這種非靈長類動物的感覺運動系統。
章魚 - 聰明的非靈長類動物
[edit | edit source]
章魚有兩眼和四對手臂,它們是雙側對稱的。章魚有一個堅硬的喙,其嘴巴位於手臂中心的交匯點。章魚沒有內骨骼或外骨骼(儘管某些物種在斗篷內有退化的殼遺蹟),這使它們能夠擠過狹窄的地方。章魚是所有無脊椎動物中最聰明、行為最靈活的動物之一。
章魚最有趣的特徵是它們的手臂運動。為了進行有目標的手臂運動,章魚的神經系統會生成一系列運動指令,使手臂朝向目標移動。手臂的控制特別複雜,因為手臂可以向任何方向移動,具有幾乎無限的自由度。隨意運動的基本運動程式嵌入在手臂本身的神經迴路中。[2]
章魚手臂運動
[edit | edit source]在章魚的層次結構中,大腦只需要向手臂發出一個指令來執行動作。如何執行的完整方案本身就嵌入在手臂中。透過使用手臂,章魚可以行走,抓住獵物,或者拒絕不需要的物體,還可以從其周圍環境中獲取各種機械和化學資訊。
章魚手臂與人類手臂不同,它們的運動範圍不受肘部、腕部和肩部關節的限制。然而,為了完成諸如伸手抓食物或游泳等目標,章魚必須能夠控制其八條附肢。章魚手臂可以利用幾乎無限的自由度向任何方向移動。這種能力源於章魚手臂上密集排列的靈活肌肉纖維。
觀察表明,章魚透過將手臂運動保持在設定的、刻板的模式中,降低了控制手臂的複雜性。[3] 例如,伸展動作總是由沿著手臂向尖端傳播的彎曲組成。由於章魚總是使用相同型別的運動來伸展其手臂,因此生成該模式的指令儲存在手臂本身中,而不是儲存在中樞大腦中。這種機制進一步降低了控制靈活手臂的複雜性。這些靈活的手臂由一個複雜的周圍神經系統控制,該神經系統包含 5 × 107 個神經元,分佈在每條手臂上。其中有 4 × 105 個是運動神經元,它們支配手臂的內在肌肉並區域性控制肌肉活動。
每當需要時,章魚的神經系統會生成一系列運動指令,這些指令反過來會產生力和相應的速度,使肢體到達目標。透過使用向量疊加和基本運動的疊加所形成的最優軌跡,可以簡化運動。這要求肌肉相當靈活。
手臂的神經系統
[edit | edit source]章魚的八條手臂是細長、逐漸變細的肌肉器官,從頭部伸出並規則地排列在嘴巴周圍。每條手臂的內表面都有兩排吸盤,每個吸盤都與對側排的吸盤交替排列。每條手臂上大約有 300 個吸盤。[4]
手臂同時執行運動和感覺功能。章魚手臂的神經系統由神經節代表,負責運動和相互連線功能。周圍神經細胞代表感覺系統。神經節和周圍神經細胞之間存在密切的功能關係。
手臂的肌肉可以分為三個獨立的組,每個組在解剖和功能上都有一定的獨立性。
- 手臂的內在肌肉,
- 吸盤的內在肌肉,以及
- 髖臼臂肌肉(連線吸盤到手臂肌肉)。
這三個肌肉群中的每一個都包含三個互相垂直的肌肉束。每個束都從周圍的單位獨立接收神經支配,並表現出顯著的自主性。儘管沒有骨骼或軟骨骨架,章魚可以利用不同肌肉的收縮和放鬆來產生手臂運動。從行為上看,縱向肌肉縮短手臂,在抓住物體並將其送入口中方面起主要作用,而斜向和橫向肌肉則伸長手臂,章魚用它來拒絕不需要的物體。

手臂中有六個主要的神經中樞,負責執行這些肌肉群的功能。軸向神經索是手臂中最重要、最主要的運動和整合中樞。八條神經索,每條手臂一條,總共包含3.5 × 108 個神經元。每條軸向神經索透過連線神經束與五個更周圍的神經中樞相連,即四條肌內神經索(位於手臂的內在肌肉中)和吸盤的節(位於每個吸盤的髖臼杯下的柄中)。
所有這些小的周圍神經都包含運動神經元,並接收來自深部肌肉受體的傳入纖維,這些受體充當區域性反射中樞。因此,手臂肌肉的運動神經支配不僅由軸向神經索的運動神經元提供(這些運動神經元接收來自大腦的節前纖維),還由這些更周圍的運動中樞提供。
手臂包含一個複雜而廣泛的感覺系統。手臂三個主要肌肉系統中的深部受體為動物提供了一個廣泛的感覺器官,用於從肌肉收集資訊。許多初級受體位於覆蓋手臂表面的上皮組織中。吸盤,尤其是吸盤邊緣,擁有最多的這些感覺細胞,而手臂的皮膚則比較不敏感。每個吸盤中有數萬個受體。
在章魚的手臂中發現了三種主要型別的受體。分別是圓形細胞、不規則的多極細胞和錐形纖毛細胞。所有這些元素都將它們的突觸向心性地送往神經節。這三種受體的功能意義目前還不十分清楚,只能推測。有人認為,圓形和多極受體可能記錄機械刺激,而纖毛受體可能是化學受體。
纖毛受體不會直接將它們的軸突送往神經節,而是將軸突與位於上皮組織下方的包囊神經元相遇,並與這些神經元的樹突突觸連線。這種連線有助於減少初級神經細胞之間的輸入。另一方面,圓形和多極受體直接將它們的軸突送往包含運動神經元的神經節。
行為實驗表明,關於肌肉運動的資訊不會到達大腦的學習中樞,而形態學觀察證明,深部受體將它們的軸突送往周圍中樞,例如吸盤神經節或肌內神經索。[5] 關於肌肉拉伸或運動的資訊只用於區域性反射。
當包含來自大腦的軸突束的軸向神經索背側被電訊號刺激時,仍然會注意到整條手臂的運動。運動是由提供的刺激觸發的,而不是直接由來自大腦的刺激驅動。因此,手臂伸展是由軸向神經索背側的刺激引起的。相反,刺激同一區域內的肌肉或神經索的節段部分,只會引起區域性肌肉收縮。這意味著大腦只需要向手臂傳送一個單一的移動命令,手臂就會完成剩下的工作。
一個背側方向的彎曲沿著手臂傳播,導致吸盤指向運動方向。當彎曲傳播時,彎曲近端的臂部分保持伸展。為了進一步確認章魚手臂有它自己的想法,章魚手臂中的神經被切斷,與身體的其他神經(包括大腦)隔絕。透過對神經索進行電刺激或對皮膚或吸盤進行觸覺刺激,在被截肢的手臂中引發了類似於正常手臂伸展的運動。
已經注意到,在刺激之前手動建立彎曲時,彎曲傳播更容易啟動。如果完全放鬆的手臂受到刺激,初始運動將由刺激觸發,隨後是相同的彎曲傳播。因此,手臂的神經系統不僅驅動區域性反射,還控制涉及整條手臂的複雜運動。
這些誘發的運動在運動學上幾乎與自由活動章魚的運動相同。當受到刺激時,被切斷的手臂表現出與自然手臂伸展相同的肌肉活動主動傳播。從相似的初始手臂姿勢引發的運動會導致相似的路徑,而不同的起始姿勢會導致不同的最終路徑。
由於在去神經章魚手臂中誘發的伸展在質量上和運動學上與自然手臂伸展相似,因此似乎有一個潛在的運動程式控制著嵌入在手臂神經肌肉系統中的運動,這不需要中樞控制。
魚是水生動物,種類繁多。魚類超過 32000 種,是脊椎動物中最大的類群。

大多數魚類都擁有高度發達的感覺器官。大多數白天活動的魚類都具有顏色視覺能力。有些魚甚至可以看到紫外線。魚類也有很強的嗅覺。例如,鱒魚的頭上有特殊的洞,叫做“鼻孔”,用來感知水中微量的化學物質。從海洋遷徙的鮭魚利用這種感覺找到返回家鄉河流的路,因為它們記得自己聞起來的味道。尤其是底棲魚類,嘴唇和觸鬚的觸覺非常靈敏。它們的味蕾也位於那裡。它們利用這些感覺在地面和渾濁的水域中尋找食物。
魚類還擁有側線系統,也稱為側線系統。它是一種位於頭部和身體兩側的觸覺感覺器官系統。它用於檢測周圍水中的運動和振動。
魚類利用側線感覺器官感知獵物和捕食者,感知水流的變化及其方向,並利用它來避免在群體中發生碰撞。
Coombs 等人已經證明 [1],側線感覺器官對於魚類檢測獵物並朝向獵物定向是必要的。即使魚類被矇蔽,它們也能檢測並朝向獵物或振動金屬球體產生的運動定向。當側線的訊號轉導被氯化鈷的應用抑制時,靶向獵物的能力會大大降低。
Pitcher 等人在 1976 年證明了魚類依賴側線器官來避免在群體魚類中發生碰撞,他們表明,即使被矇蔽的魚類也能在魚群中游泳,而那些側線器官失靈的魚類則不能 [2]。
側線看起來像是兩條微弱的線,從魚的頭部到尾部沿著魚的身體兩側延伸。它們由一系列稱為神經毛的機械感受器細胞組成。這些神經毛要麼位於皮膚表面,要麼更常見地嵌入側線管內。側線管是一種充滿粘液的結構,位於皮膚下方,透過外部通往內部神經毛的開口來傳導外部水位移。神經毛本身由具有精細毛細胞的感覺細胞組成,這些感覺細胞被一個圓柱形的凝膠狀鐘罩包裹著。這些毛細胞要麼直接到達開闊的水域(常見於深海魚類),要麼到達側線管的淋巴液中。變化的水壓會彎曲鐘罩,進而彎曲內部的毛細胞。與所有脊椎動物耳朵中的毛細胞類似,向較短的纖毛方向的偏轉會導致超極化(放電速率下降),而相反方向的偏轉會導致去極化(放電速率上升)的感覺細胞。因此,壓力資訊透過速率編碼轉換為數字資訊,然後沿著側線神經傳遞到大腦。透過透過傳入和傳出連線整合多個神經毛,可以形成複雜的迴路。這使得它們能夠響應不同的刺激頻率,從而編碼不同的引數,例如加速度或速度 [3]。

鯊魚和鰩魚身上的一些神經丘經歷了有趣的進化,演變成稱為羅倫茲壺腹的電感受器。它們主要集中在魚的頭部周圍,可以檢測到小至 0.01 微伏的電刺激變化 [4]。藉助這種靈敏的器官,這些魚能夠檢測到肌肉收縮產生的微弱電勢,從而在遠距離、渾濁的水域甚至隱藏在沙子下的情況下找到獵物。有人認為鯊魚也利用這種感覺進行遷徙和定向,因為羅倫茲壺腹足夠靈敏,可以檢測到地球的磁場。
頭足類動物
魷魚、章魚和烏賊等頭足類動物在頭部和觸手上都有排列成行的纖毛表皮細胞,類似於魚類的側線。對普通烏賊(Sepia officinalis)和短尾魷魚(Lolliguncula brevis)這些排成行的細胞進行的電生理記錄表明,它們是魚類和水生兩棲動物機械感受性側線的無脊椎動物類似物 [5]。
甲殼類動物
一些甲殼類動物也出現了與魚類側線相似的趨同進化。與魚類不同,它們體內沒有機械感覺細胞,而是將這些細胞以規則的間隔排列在長長的拖曳觸角上。這些觸角與身體平行。這形成了兩條與身體平行的“側線”,它們具有與魚類側線相似的特性,並且在機械上獨立於身體 [6]。
哺乳動物
在水生海牛中,顱後身體長有觸覺毛髮。它們類似於裸鼴鼠的機械感覺毛髮。這種毛髮的排列方式與魚類的側線相似,彌補了海牛糟糕的視覺能力。同樣,港海豹的鬍鬚可以探測微小的水流運動,充當流體動力學感受器系統。該系統遠不如魚類同類系統靈敏。[7]

平衡棒是許多飛行昆蟲身上存在的感官器官。人們普遍認為它是這些昆蟲後一對翅膀的進化改造,平衡棒提供陀螺儀感官資料,這對飛行至關重要。儘管蒼蠅還有其他相關的系統可以幫助飛行,但蒼蠅的視覺系統太慢,無法進行快速機動。此外,為了能夠在弱光條件下熟練地飛行,這是一個避免捕食的必要條件,因此需要這樣的感官系統。事實上,如果沒有平衡棒,蒼蠅就無法持續、受控地飛行。自 18 世紀以來,科學家們就意識到平衡棒在飛行中所起的作用,但直到最近,人們才更好地瞭解了它們的工作機制。 [6] [7]
平衡棒是由兩對翅膀中最後的一對進化而來的。雖然第一對仍然用於飛行,但後一對失去了飛行功能,並採用了略微不同的形狀。平衡棒從視覺上看由三個結構部分組成:一個球形末端、一個細長的柄和一個略寬的基部。球形末端包含大約 13 根神經支配的毛髮,而基部包含兩個絃音器,每個絃音器都由大約 20-30 根神經支配。絃音器是一種感覺器官,被認為只對伸展有反應,但它們仍然相對未知。基部也覆蓋著大約 340 個鐘形感覺器,它們是微小的纖維,優先對沿其拉伸方向的壓縮做出反應。這些纖維中的每一根也都被神經支配。相對於平衡棒的柄,絃音器和鐘形感覺器的方向都大約為 45 度,這對於測量作用在平衡棒上的彎曲力是最佳的。平衡棒在飛行時與翅膀反向(反相)運動。感官成分可以分為三組 [8]):對平衡棒垂直振動敏感的那些,包括背側和腹側柄板、背側和腹側希克斯乳突(板和乳突都是上述鐘形感覺器的子類別),以及小的絃音器。基底板(鐘形感覺器的另一種表現形式)和大的絃音器對作用在平衡棒上的陀螺力矩敏感,還有一些未分化的乳突對作用在平衡棒基部上的所有應變都有反應。這為蒼蠅提供了一種額外的機制來區分作用在平衡棒上的力的方向。
當人們首次發現和探索同源異形盒基因時,發現刪除或失活 Ultrabithorax (Ubx) 同源異形盒基因會導致平衡棒發育為一對正常的翅膀。這是一個非常引人注目的早期結果,說明了同源異形盒基因的本質。對 Antennapedia 基因的操縱同樣會導致腿部嚴重畸形,或者會導致頭部發育出一組腿而不是觸角。
平衡棒透過檢測科里奧利力來發揮作用,感知穿過可能旋轉的蒼蠅身體的空氣運動。研究表明,身體的角速度是由平衡棒測量的科里奧利力編碼的 [8]。活躍的平衡棒可以招募任何相鄰的單元,影響附近的肌肉並導致飛行動力學的巨大變化。平衡棒已被證明具有極快的響應時間,這使得這些飛行變化的執行速度遠遠快於蒼蠅依靠視覺系統。為了區分不同的旋轉分量,例如俯仰和滾動,蒼蠅必須能夠組合來自兩個平衡棒的訊號,而這兩個訊號必須不能重合(重合的訊號會削弱蒼蠅區分旋轉軸的能力)。平衡棒能夠有助於影像穩定,以及飛行姿態控制,這是由許多作者指出的,他們注意到頭部和翅膀對旋轉速率向量的各個分量的輸入的反應。平衡棒對頭部和頸部運動的貢獻已被注意到,解釋了它們在凝視穩定中的作用。因此,蒼蠅利用來自平衡棒的輸入來確定凝視的固定位置,這是一種有趣的感覺整合。
記錄表明,平衡棒能夠以與科里奧利力相同的頻率(雙翅拍頻率)響應刺激,這是該概念的證明,它允許人們進一步對這些測量是如何發生的進行數學分析。平衡棒的角速度和身體旋轉的向量叉積為蒼蠅提供了科里奧利力向量。這種力在俯仰和平面中與拍翅頻率相同,而在偏航平面上是兩倍的頻率。平衡棒能夠提供速率阻尼訊號來影響旋轉。這是因為科里奧利力與蒼蠅自身的旋轉速率成正比。透過測量科里奧利力,平衡棒可以向其關聯的肌肉傳送適當的訊號,使蒼蠅能夠適當地控制其飛行。平衡棒的大幅度運動允許計算垂直和水平的旋轉速率。由於平衡棒在垂直運動和水平運動之間的運動存在很大差異,Ω1,旋轉速率的垂直分量,產生的力是水平分量頻率的兩倍。人們普遍認為,這種兩倍的頻率差異是蒼蠅能夠區分垂直和水平分量的原因。如果我們假設平衡棒是正弦運動的,這是一個對其實際世界行為的合理準確的近似,那麼角位置 γ 可以建模為: 其中 ω 是平衡棒拍翅頻率,幅度為 180,這是對實際運動範圍的近似。已知速率(滾動、俯仰和偏航分量分別用 1、2 和 3 標記)可以計算出身體旋轉速度,分別來自兩個平衡棒(Ωb 為左平衡棒,Ωc 為右平衡棒)的參考系,分別對應於蒼蠅的身體,使用以下計算 [7]
α 代表平衡棒從身體平面旋轉的角度,Ω 項如前所述是平衡棒相對於身體的角速度。瞭解這一點,我們可以用平衡棒末端球體上的力方程來粗略模擬平衡棒的輸入
m 是平衡棒球體的質量,g 是重力加速度,ri,vi} 和 ai 是球體相對於蒼蠅身體在i 方向的位置、速度和加速度,aF 是蒼蠅的線加速度,Ωi 和 Ώi 分別是蒼蠅在空間中的i 方向的角速度和角加速度分量。科里奧利力由2mΩ × vi 項模擬。由於產生的感覺訊號與作用在平衡棒上的力成正比,因此可以模擬平衡棒訊號。如果嘗試將力方程與旋轉分量方程相協調,值得記住的是,必須分別計算兩個平衡棒的力方程。
蝴蝶
[edit | edit source]
蝴蝶和蛾子用約翰斯頓器官來保持平衡:這是一個位於蝴蝶觸角基部的器官,負責維持蝴蝶的平衡感和方向感,尤其是在飛行過程中。
約翰斯頓器官
[edit | edit source]介紹
[edit | edit source]對於某些昆蟲來說,聲音的感知對於交配行為很重要,例如果蠅[9]。昆蟲和甲殼類動物的聽覺能力是由絃音器官提供的:機械感受器,對機械變形做出反應[10]。這些絃音器官廣泛分佈在昆蟲的整個身體中,並且功能不同:本體感受器對昆蟲本身產生的力敏感,而外感受器對外力敏感。這些感受器可以透過聲音在空氣或水中等介質中傳播時粒子振動來檢測聲音。遠場聲音是指空氣粒子將振動作為來自聲源的長時間壓力變化傳播的現象。近場聲音是指靠近聲源的聲音,粒子速度可以移動輕質結構。一些昆蟲有可見的聽覺器官,比如夜蛾的耳朵,而另一些昆蟲則沒有可見的聽覺器官,但仍然能夠感知聲音。在這些昆蟲中,"約翰斯頓器官"在聽覺中起著重要作用。
約翰斯頓器官
[edit | edit source]約翰斯頓器官 (JO) 是大多數昆蟲都存在的絃音器官。克里斯托弗·約翰斯頓是第一個在蚊子中描述該器官的人,因此得名約翰斯頓器官[11]。顯微鏡科學季刊。1855 年,第 s1-3 卷,第 10 卷,第 97-102 頁。該器官位於昆蟲觸角的莖部。它在雙翅目 (雙翅目) 中發展出最高的複雜程度,對雙翅目來說,聽覺尤為重要[10]。JO 由稱為感覺體的有序基本感覺單元組成(SP)。感覺體的數量在不同的動物中有所不同。JO 具有各種機械感覺功能,例如檢測觸覺、重力、風和聲音,例如蜜蜂的 JO(約 300 個 SP)負責檢測來自另一個“跳舞”蜜蜂的聲音[12]。在雄性蚊子 (約 7000 個 SP) 中,JO 用於檢測和定位雌性飛行聲音以進行交配行為[13]。這些昆蟲的觸角專門用於捕獲近場聲音。它充當物理機械換能器。
約翰斯頓器官的解剖結構
[edit | edit source]典型的昆蟲觸角有三個基本部分:柄節 (基部)、梗節 (莖) 和鞭節[14]。一些昆蟲的第三部分有一個叫做剛毛的剛毛。圖 1 顯示了果蠅的觸角。對於果蠅來說,觸角節 a3 鬆散地插入節 a2 的窩中,當吸收聲能時可以旋轉[15]。這會導致感覺體的 JO 神經元伸展或壓縮。在雙翅目中,JO 感覺體位於第二個觸角節 a2 梗節(Yack, 2004)。JO 不僅與聲音感知 (外感受器) 相關聯,它還可以充當本體感受器,提供有關鞭節相對於梗節的方向和位置的資訊[16]。

感覺器是 JO 的基本感覺單位。一個感覺器包含四種細胞型別 [10]:(1)一個或多個雙極性感覺神經元,每個神經元都具有遠端的樹突;(2)包繞樹突的感覺器鞘細胞;(3)一個或多個與感覺器鞘細胞遠端區域相關的附著細胞;(4)一個或多個圍繞感覺神經元細胞體近端區域的神經膠質細胞。感覺器鞘細胞包圍著感覺樹突(纖毛),並與之一起形成感覺器腔/感受淋巴腔。感覺器腔是密封的。腔內充滿淋巴液,據推測淋巴液含有高鉀離子濃度和低鈉離子濃度,與哺乳動物耳蝸的內淋巴液非常相似。感覺器可根據不同的標準進行分類。頂端細胞產生一個包裹著纖毛尖端並將其連線到第三節(a3)的胞外頂端結構 [17]。
第一型和第二型感覺器在感覺神經元中纖毛節段的型別上有所不同。在第一型中,纖毛的直徑一致,除了在長度約為 2/3 處有一個遠端膨大。纖毛插入頂端結構而不是插入管狀結構。在第二型中,纖毛節段具有增加的直徑,形成一個遠端膨大,該膨大可以密集地填充微管。遠端部分以管狀結構結尾。單絲狀和雙絲狀感覺器在與感覺器鞘細胞和樹突纖毛相關的胞外結構上有所不同。單絲狀感覺器具有插入電子緻密結構頂端結構中的樹突尖端。在雙絲狀感覺器中,尖端被電子緻密的管狀結構包裹。單動性感覺器和異動性感覺器在感覺神經元的數量上有所區別。單動性感覺器具有單個感覺細胞,而異動性感覺器則具有多個感覺細胞。
果蠅 (Drosophila melanogaster) 中研究的 JO
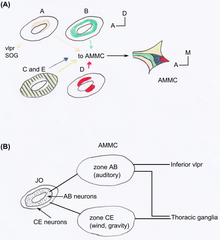
[edit | edit source]果蠅的 JO 由大約 277 個感覺器組成,這些感覺器位於 a2/a3 連線處和 a2 角質層(一種外部組織層)之間 [18]。果蠅的感覺器是單絲狀的 [15]。大多數是異動性的,包含兩個或三個神經元,因此 JO 包含大約 480 個神經元。它是果蠅最大的機械感覺器官 [9]。JO 對雄性果蠅求偶歌聲(由其翅膀發出)的感知使雌性果蠅減少運動,而雄性果蠅則互相追逐形成求偶鏈 [19]。JO 不僅對感知聲音很重要,而且對感知重力和風也很重要 [20] [21]。利用 JO 中的 GAL4 增強子陷阱品系表明,果蠅的 JO 神經元在解剖學上可以分為五個亞組,即 A-E [18]。每個亞組在大腦中的觸角機械感覺和運動中心 (AMMC) 都有不同的靶區(見圖 2)。Kamikouchi 等人表明,不同的亞組專門針對不同的觸角運動型別 [9]。不同的亞組用於聲音和重力的反應。
JO 中的神經活動
[edit | edit source]為了研究 JO 神經元的活動,可以觀察觸角運動引起的細胞內鈣訊號 [9]。此外,果蠅應該被固定(例如,透過將它們安裝在蓋玻片上並固定第二節觸角以防止肌肉造成的運動)。觸角可以用靜電場進行機械驅動。當果蠅行走時,觸角接收器在吸收聲音能量時會振動,並在前後擺動。彎曲和振動觸角會導致 JO 神經元產生不同的活動模式:以恆定力向後彎曲接收器會導致 JO 前部區域出現負訊號,而在後部區域出現正訊號。向前彎曲會產生相反的行為。求偶歌聲(脈衝歌聲,主頻率約為 200Hz)會引起廣泛分佈的訊號。向前和向後彎曲的相反模式反映了 JO 神經元的相反排列方式。它們的樹突連線到柄節的解剖學上不同的側面:接收器的前面和後面。向前彎曲接收器會拉伸前部區域的 JO 神經元,並壓縮後部區域的神經元。由此可以得出結論,JO 神經元被拉伸啟用(即去極化),被壓縮失活(即超極化)。
不同的 JO 神經元
[edit | edit source]一個 JO 神經元通常只靶向 AMMC 的一個區域,而靶向同一區域的神經元位於 JO 內的特徵性空間區域 [18]。類似的投射神經元被組織成同心圓環或成對的簇(見圖 2A)。
用於聲音感知的振動敏感神經元
[edit | edit source]A 和 B 神經元 (AB) 在 19Hz 到 952Hz 之間的接收器振動下被最大程度地啟用。這種反應與頻率相關。亞組 B 對低頻振動表現出更大的反應。因此,亞組 A 負責高頻反應。
用於重力和風感知的彎曲敏感神經元
[edit | edit source]C 和 E 對靜態接收器彎曲表現出最大的活動。因此,這些神經元提供了有關力方向的資訊。它們對觸角芒的位移閾值比 AB 神經元更高 [21]。儘管如此,CE 神經元仍可以對觸角芒的小位移做出反應(例如,重力):重力使觸角芒尖端位移 1 微米(見 [9] 的 S1)。它們還對氣流引起的大位移做出反應(例如,風) [21]。C 和 E 區域的神經元對氣流方向表現出不同的敏感度,這會導致觸角芒在不同方向上發生彎曲。作用於頭部前部的氣流會在 E 區域引起強烈的啟用,而在 C 區域引起微弱的啟用。作用於頭部後部的氣流則顯示出相反的結果。作用於頭部側面的氣流會在 C 區域引起同側啟用,而在 E 區域引起對側啟用。不同的啟用使果蠅能夠感知風來自哪個方向。目前尚不清楚相同的 CE 亞組神經元是否介導風和重力檢測,或者是否存在對重力檢測更敏感的 CE 神經元和對風檢測不太敏感的 CE 神經元 [9]。野生型果蠅能夠感知重力的一個證明是,果蠅在試管中被搖晃後,會傾向於向上飛行以對抗重力的力向量(負重力性)。當觸角芒被切除時,這種負重力性行為消失,但趨光性行為(果蠅向光源飛行)沒有消失。同樣地,去除第二節(即 JO 所在位置),負重力性行為再次出現。這表明,當 JO 消失時,果蠅仍然可以透過其他器官感知重力,例如頸部或腿部的機械感受器。這些感受器已被證明在其他昆蟲物種中負責重力感知 [22]。
沉默特定神經元
[edit | edit source]可以使用破傷風毒素結合亞組特異性 GAL4 驅動基因和微管-GAL80 選擇性地沉默 JO 神經元亞組。後者是溫度敏感的 GAL4 阻斷劑。利用這種方法可以確認 CE 亞組的神經元負責重力性行為。消除 CE 亞組的神經元不會損害聽覺能力 [21]。沉默 B 亞組會損害雄性果蠅對求偶歌聲的反應,而沉默 CE 或 ACE 亞組則不會 [9]。由於發現 A 亞組參與聽覺(見上文),因此該結果令人意外。從不同的實驗中,研究了聲音引起的複合動作電位(動作電位的總和),得出的結論是,A 亞組對於求偶雄性發出的微弱歌聲所施加的奈米級接收器振動是必需的。
如上所述,JO 神經元的解剖學上不同的亞群具有不同的功能 [9]。這些神經元附著在相同的觸角接收器上,但它們在接收器上的相反連線部位有所不同。因此,例如,在向前偏轉時,一些神經元會被拉伸,而另一些則會被壓縮,從而產生不同的反應特徵(相反的鈣訊號)。振動敏感和偏轉敏感神經元的差異可能來自不同的轉導分子機制(即適應或不適應通道以及 NompC 依賴性或非依賴性)。聲音敏感神經元表達機械轉導通道 NompC(無機械感受器電位 C,也稱為 TRPN1)通道,而 CE 亞群獨立於 NompC [9]。此外,AB 亞群的 JO 神經元轉導動態接收器振動,但對靜態接收器偏轉快速適應(即它們呈相位反應)[23]。CE 亞群的神經元在靜態偏轉期間顯示出持續的鈣訊號反應(即它們呈緊張反應)。兩種不同的行為表明存在具有不同適應特性的轉導通道,這在哺乳動物耳蝸或哺乳動物皮膚中也是已知的(即緊張啟用的默克爾細胞和快速適應的邁斯納氏小體)[21]。
A 和 B 亞群的神經元在一側靶向 AMMC 中的主要聽覺中心的區域,而在另一側靶向腹外側原腦(VLP)的下部(見圖 2B)。這些區域在其自身之間以及與 VLP 之間顯示出許多連合連線。對於 CE 亞群的神經元,幾乎沒有發現其目標區域之間的連合連線,也沒有發現與 VLP 的連線。與 CE 亞群區域相關的神經元從胸神經節下降或上升。AB 和 CE 神經元投射的這種差異強烈地提醒了哺乳動物聽覺和前庭通路的分離脊椎動物投射 [15]。

蜜蜂的 JO 也位於觸角的柄部,用於檢測近場聲音 [12]。在蜂巢中,一些蜜蜂會進行搖擺舞,據信這種舞蹈會告知同類食物來源的距離、方向和收益率。跟隨者必須在蜂巢的黑暗中破譯舞蹈的資訊,即視覺感知不參與此過程。聲音感知是獲取舞蹈資訊的一種可能方式。跳舞的蜜蜂的聲音載波頻率約為 260 Hz,是由翅膀振動產生的。蜜蜂有各種機械感受器,例如表皮上的毛髮或眼睛上的剛毛。Dreller 等人發現 JO 中的機械感受器負責蜜蜂的聲音感知 [12]。儘管如此,當振幅太低而無法振動鞭毛時,毛髮感測器仍可能參與檢測更遠的聲音源。Dreller 等人訓練蜜蜂將聲音訊號與蔗糖獎勵相關聯。訓練蜜蜂后,一些蜜蜂的不同機械感受器被去除。然後,再次測試蜜蜂將聲音與獎勵相關聯的能力。操縱 JO 會導致學習技能的喪失。訓練可以用 265 Hz 的頻率進行,也可以用 10 Hz 的頻率進行,這表明 JO 也參與低頻聽力。只有一根觸角的蜜蜂會犯更多錯誤,但仍然比切除了兩根觸角的蜜蜂好。每根觸角上的兩個 JO 可以幫助跟隨者計算跳舞的蜜蜂的方向。蜜蜂在其他情況下也可能使用聽覺,例如將蜂群聚集在一起。搖擺舞的解碼不僅透過聽覺感知進行,而且還透過電場感知進行,甚至更多。蜜蜂的 JO 允許檢測電場 [24]。如果身體部位一起移動,蜜蜂會在其表皮中積累電荷。昆蟲對電場有反應,例如透過改變的運動(Jackson,2011)。表面電荷被認為在授粉中起作用,因為花通常帶負電,而到達的花粉帶正電荷 [24]。這可以幫助蜜蜂收集花粉。透過訓練蜜蜂適應靜態和調製電場,Greggers 等人證明蜜蜂可以感知電場 [24]。跳舞的蜜蜂會產生電場,該電場會使鞭毛的運動比僅翅膀振動的機械刺激強 10 倍。蜜蜂鞭毛的振動由 JO 監控,JO 對帶電翅膀振動引起的位移幅度有反應。這透過在電場刺激期間記錄 JO 軸突的複合動作電位反應來證明。JO 的電場接收在沒有觸角的情況下無法工作。是否也有其他非觸角機械感受器參與電場接收尚未排除。Greggers 等人的研究結果表明,電場(以及 JO)與蜜蜂的社交交流相關。
索頓氏器,如 JO,僅存在於昆蟲和甲殼類動物中 [10]。索頓氏神經元是纖毛細胞 [25]。編碼功能纖毛所需蛋白質的基因在索頓氏神經元中表達。人類同源基因的突變會導致遺傳疾病。瞭解纖毛發生的機制有助於理解和治療由人類纖毛形成或功能缺陷引起的疾病。這是因為控制昆蟲和脊椎動物神經元特化的過程基於高度保守的轉錄因子,以下示例說明了這一點:無眼蛋白(Ato)是一種前神經元轉錄因子,它指定索頓氏器的形成。小鼠直系同源基因 Atoh1 是耳蝸毛細胞發育所必需的。表達突變 Atoh1 表型的聾鼠可以透過果蠅的無眼蛋白基因治癒。研究昆蟲中的索頓氏器可以更深入地瞭解機械感應和纖毛構建。果蠅是一個通用的模型,可以用來研究索頓氏器 [26]。果蠅易於培養且成本低廉,產生大量的胚胎,可以透過多種方式進行基因改造,並且生命週期短,這使得能夠在相對較短的時間內研究多個世代。此外,控制發育和生存的大多數基本生物機制和途徑在果蠅和其他物種(例如人類)之間是保守的。
儘管一些蜘蛛物種高度發達的視覺系統已經歷經數十年的廣泛研究,但“動物智力”或“認知”等術語通常不會出現在蜘蛛研究中。相反,蜘蛛傳統上被描繪為相當簡單的、受本能驅動的動物(Bristowe 1958,Savory 1928),以預程式設計的方式處理視覺輸入,而不是積極地解釋從其視覺器官接收到的資訊,以做出適當的反應。儘管這似乎仍然是大多數蜘蛛的情況,這些蜘蛛主要透過觸覺而不是視覺線索與世界互動,但一些蜘蛛物種卻表現出令人驚訝的智慧使用它們的眼睛。考慮到其在身體內的有限尺寸,蜘蛛的視覺器官和視覺處理能力極其出色。[27] 近期研究表明,當研究諸如視覺引導的跳蛛(Salticidae)的複雜狩獵方式(跳躍時可達自身身長的30倍)或狼蛛(Lycosidae)識別潛在配偶不對稱的能力等主題時,蜘蛛的世界中視覺線索得到了非常複雜的運用。即使是主要依靠其他感覺器官的夜行性杯狀蜘蛛(Cupiennius salei,Ctenidae)或透過編織小網並將其投擲到接近的獵物身上在夜間狩獵的食人魔面蛛(Dinopis),其視覺系統仍然高度發達。這些發現不僅令人著迷,而且還激勵了其他科學和工程領域,例如機器人技術和計算機引導影像分析。
蜘蛛視覺系統的總體結構
[edit | edit source]
蜘蛛的解剖結構主要由兩個主要的身體部分組成,即前體和後體,分別稱為頭胸部和腹部。所有肢體以及包括眼睛在內的感官器官都位於前體。除了節肢動物的視覺系統以複眼為特徵外,現代蛛形綱動物的眼睛是單眼(由覆蓋著充滿玻璃體液體的凹坑的透鏡組成的簡單眼睛,在底部有一個視網膜),蜘蛛有六或八個單眼,通常排列成三或四排,橫跨前體的外骨骼。總體而言,99% 的蜘蛛有八隻眼睛,其餘 1% 的蜘蛛幾乎都有六隻眼睛。只有六隻眼睛的蜘蛛缺少“主眼”,下面將詳細介紹這些眼睛。
這些眼睛被稱為前正中眼(AME)、前側眼(ALE)、後正中眼(PME)和後側眼(PLE)。向前看的較大主眼是前正中眼,它們為蜘蛛提供最高的空間解析度,但視野非常窄。較小的向前看的眼睛是前側眼,具有中等視野和中等空間解析度。後兩對眼睛是外周的次要眼睛,視野很廣。它們極其敏感,適合在低光照條件下使用。蜘蛛利用它們的後側眼睛來感知運動,而它們的主眼則可以識別形狀和物體。與昆蟲視覺不同,蜘蛛的基於視覺的大腦幾乎完全致力於視覺,因為它只接收視神經,並且僅包含視神經節和一些聯想中心。大腦顯然能夠識別物體運動,但更重要的是,它還能透過觀察腿(線條)相對於身體的特定角度來將對手分類為潛在配偶、競爭者或獵物。這種刺激會導致蜘蛛分別表現出求偶或威脅的跡象。
蜘蛛的眼睛
[edit | edit source]雖然蜘蛛的眼睛可以被描述為“照相機眼睛”,但它們在細節上與哺乳動物或任何其他動物的“照相機眼睛”有很大不同。為了將高解析度的眼睛安裝在如此小的身體中,既不是昆蟲的複眼,也不是像我們人類一樣的球形眼睛,都無法解決這個問題。蜘蛛身上的單眼是光學上更好的解決方案,因為它們的解析度不受透鏡處的折射效應的限制,而這在複眼中會發生。如果用具有相同解析度的複眼代替蜘蛛的眼睛,它根本無法裝入蜘蛛的前體。透過使用單眼,一些蜘蛛的空間視敏度更類似於哺乳動物,而不是昆蟲,體型差異很大,只有幾千個感光細胞,例如跳蛛的眼睛,而人類視網膜則擁有超過 1.5 億個感光細胞。
主眼
[edit | edit source]
存在於大多數蜘蛛物種中的前正中眼(AME)也被稱為主眼。下圖說明了主眼結構及其組成部分的細節,並透過分析跳蛛 Portia(跳蛛科)的 AME 來解釋,該物種以其高空間解析度的眼睛和視覺引導行為而聞名,儘管其體型非常小,只有 4.5-9.5 毫米。
當光束進入主眼時,它首先穿過一個大的角膜透鏡。這個透鏡具有很長的焦距,能夠放大甚至遠處的物體。兩隻主眼角膜透鏡的組合視野將覆蓋跳蛛前方約 90 度的範圍,但是,具有所需精度的視網膜太大,無法裝入蜘蛛的眼睛。令人驚訝的解決方案是一個小的、細長的視網膜,它位於一個長而窄的管子和其末端的一個第二個透鏡(凹坑)後面。角膜透鏡(具有長焦距)和長眼管(放大角膜透鏡產生的影像)的這種組合類似於遠攝系統,使一對主眼類似於一對雙筒望遠鏡。
跳蛛在四個視網膜受體層上依次捕捉光束,這些受體層彼此相鄰(相比之下,人類視網膜僅在一個平面上排列)。這種結構不僅允許在一個有限的區域內容納更多的感光細胞,而且還能夠實現色覺,因為光被透鏡系統分成不同的顏色(色差)。因此,不同波長的光會在不同的距離處聚焦,這些距離對應於視網膜層的的位置。跳蛛利用它們的主眼識別綠色(層 1 - 約 580 奈米,層 2 - 約 520-540 奈米)、藍色(層 3 - 約 480-500 奈米)和紫外線(層 4 - 約 360 奈米),但只有最靠後的兩層(層 1 和層 2)由於其緊密的受體間距,能夠識別形狀和形式。
與人類的眼睛一樣,在層 1 中有一箇中心區域稱為“中央凹”,其中受體間距被測量為約 1 微米。這被發現是最佳的,因為遠攝光學系統提供了足夠精確的影像,可以以這種解析度進行取樣,但任何更緊密的間距都會由於相鄰受體之間的量子級干擾而降低視網膜的取樣質量。憑藉這樣的眼睛,Portia 在視覺銳度方面遠遠超過了任何昆蟲:雖然蜻蜓 Sympetrum striolatus 擁有昆蟲中已知最高的銳度(0.4 度),但 Portia 的銳度是其十倍(0.04 度),而眼睛卻小得多。人類眼睛的銳度為 0.007 度,僅比 Portia 的銳度高五倍。憑藉如此精確的視覺,Portia 從理論上講能夠區分距離 200 毫米處相距 0.12 毫米的兩個物體。其他跳蛛眼睛的空間視敏度通常不會比 Portia 差太多。[28][29][30]
主眼視網膜運動
[edit | edit source]對於像跳蛛這樣的小動物來說,如此驚人的視覺能力是有代價的:Portia 每隻主眼中的視網膜視野只有 2-5 度,而它的中央凹甚至只捕捉到 0.6 度的視野。這是由於主視網膜呈細長的迴旋鏢形狀,垂直跨度約為 20 度,水平跨度僅為 1 度,對應於約六排受體。這種嚴重的限制透過使用眼部肌肉(跳蛛有六塊)來彌補,這些肌肉掃過場景的整個影像,從而將眼管掃過整個影像。這些肌肉附著在主眼管的外部,並允許與人類眼睛相同的三個自由度——水平、垂直和旋轉。主視網膜可以水平和垂直移動多達 50 度,並且繞光軸(扭轉)旋轉類似的量。
能夠複雜地利用視覺線索的蜘蛛會自發地移動它們的主眼視網膜,透過“掃視”將中央凹固定在移動的視覺目標上(“跟蹤”),或者透過“掃描”來實現,這可能用於模式識別。如今,蜘蛛似乎透過以複雜模式移動眼管來順序地掃描場景,儘管它們的大腦容量非常有限,但仍能夠處理大量視覺資訊。
所謂的“微眼跳”,即自發的視網膜運動,被認為是一種機制,可以防止前中眼的光感受器細胞適應靜止的視覺刺激。杯狀蜘蛛具有 4 塊眼肌,分別為兩塊背肌和兩塊腹肌,它們會持續進行 2° 到 4° 的背中向微眼跳,持續約 80 毫秒(當固定在支架上時)。2-4° 的微眼跳運動與杯狀蜘蛛受體細胞之間的約 3° 角非常吻合,支援了它防止適應功能的觀點。相比之下,由機械刺激引起的視網膜運動(將一股氣流吹向第二條步足的跗節)可能比自發的視網膜運動大得多,偏轉幅度可達 15°。這種刺激會使眼肌活動從靜止狀態下的 12 ± 1 Hz 自發活動增加到施加氣流刺激後的 80 Hz。然而,在這類實驗中,兩顆主要眼睛的主動視網膜運動永遠不會同時啟用,兩顆眼睛的方向之間也不存在相關性。這兩種機制,即自發的微眼跳以及主動視網膜運動帶來的主動“凝視”,似乎可以讓蜘蛛僅使用主要眼睛有效地追蹤和分析靜止的視覺目標,而不會透過身體運動加強眼跳運動。
然而,影響蜘蛛眼睛視覺能力的另一個因素是保持不同距離物體聚焦的問題。在人類的眼睛中,這是透過調節來解決的,即改變晶狀體的形狀,但跳蛛則採用不同的方法:它們視網膜第 1 層的受體排列在“階梯”上,距離晶狀體不同。因此,任何物體的影像,無論是距離眼睛幾釐米還是幾米,都將在第 1 層階梯的某一部分上聚焦。此外,跳蛛可以在不移動角膜晶狀體的情況下左右搖動眼管,從而將每隻視網膜的階梯在角膜晶狀體的影像上掃描,依次獲得物體的清晰影像。
由此產生的視覺效能令人印象深刻:跳蛛,例如波提亞跳蛛,可以準確地聚焦 2 釐米到無限遠之間的物體,在實踐中能夠看到大約 75 釐米。然而,由於需要複雜掃描過程才能從如此小的眼睛捕捉到高質量的影像,識別物體的所需時間相對較長(似乎在 10-20 秒範圍內)。由於這個限制,像波提亞跳蛛這樣的蜘蛛很難快速識別更大的捕食者,因為捕食者的體型較大,使得這種小型蜘蛛很容易成為鳥類、青蛙和其他捕食者的獵物。[31][32]
模糊視覺用於距離估計
[edit | edit source]一項意想不到的發現最近讓研究人員感到驚訝,他們發現跳蛛使用一種叫做模糊視覺的技術來估計它們在跳躍前與之前識別的獵物之間的距離。人類透過雙眼視覺實現深度感知,而其他動物則透過左右移動頭部或測量超聲波響應來實現深度感知,跳蛛則在它們的主要眼睛內執行這項任務。與其他跳蛛物種一樣,阿達松跳蛛的主要眼睛具有四層視網膜,其中最底部的兩層具有對綠色脈衝做出反應的光感受器。然而,由於綠色光線距離內部晶狀體較遠,因此只能在最底部的第 1 層上清晰聚焦。第 2 層會接收聚焦的藍色光線,但這些光感受器細胞對藍色不敏感,而是接收模糊的綠色影像。有趣的是,模糊程度取決於物體與蜘蛛眼睛的距離——物體越近,它在第二層視網膜上看起來越模糊。與此同時,由於第一層視網膜具有階梯結構,因此始終接收清晰的影像。因此,跳蛛能夠透過比較兩個最底層視網膜影像來使用一隻靜止的眼睛估計深度。這一點得到了證實,即讓蜘蛛在充滿綠色光線的競技場中跳躍攻擊獵物,而在相同亮度的紅色光線下則不能。如果沒有使用綠色視網膜層的能力,跳蛛會反覆無法準確判斷距離,錯過跳躍。
次要眼睛
[edit | edit source]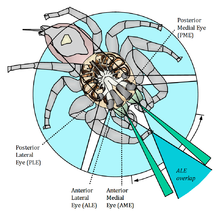
與負責物體分析和識別的主要眼睛不同,蜘蛛的次要眼睛充當運動檢測器,因此沒有眼肌來更廣泛地分析場景。根據它們在蜘蛛甲殼上的排列方式,次要眼睛使動物能夠擁有全景視野,幾乎可以檢測到身體周圍 360° 的移動物體。前外側眼和後外側眼(即次要眼睛)只具有單一型別的視覺細胞,對波長約為 535-540 奈米的綠色光具有最大光譜靈敏度。不同蜘蛛科之間甚至同一蜘蛛科內,次要眼睛的數量和排列方式差異很大,其結構也是如此:大型次要眼睛可以包含數千個感光體(視網膜的感光部分),並透過其對光的高靈敏度為獵食者或夜行蜘蛛提供支援,而小型次要眼睛最多包含幾百個感光體,只提供基本的運動檢測。與主要眼睛(感光體朝向光線)不同,蜘蛛的次要眼睛是倒置的,即它們的感光體背離光線,就像脊椎動物(例如人類的眼睛)一樣。例如,在被廣泛研究的杯狀蜘蛛中的次要眼睛的空間解析度在水平方向上最大,這使得蜘蛛即使使用次要眼睛也能很好地分析水平運動,而垂直運動在“平坦世界”中可能並不重要。
跳蛛的側眼反應時間比較慢,約為 80-120 毫秒,這是用一個大小為 3°(受體間角)的方形刺激經過動物眼睛測量得出的。蜘蛛做出反應的最小刺激移動距離為:在 1°/s 的刺激速度下為 0.1°,在 9°/s 的速度下為 1°,在 27°/s 的速度下為 2.5°。這意味著,即使物體以較慢的速度移動只有側眼受體間角的十分之一,跳蛛的視覺系統也能檢測到運動。如果刺激變得更小,僅為 0.5° 的大小,則只有在長時間延遲後才會出現響應,表明它們處於蜘蛛可感知運動的極限。
(夜行)蜘蛛的次要眼睛通常在感光體後面有一個反光層,這是一層將光線反射回受體以提高視覺靈敏度的晶體層。這使得夜間獵食的蜘蛛的眼睛具有 f/0.58 的光圈,即使在超低光照條件下也能捕捉到視覺資訊。因此,包含反光層的次要眼睛很容易在夜間被照亮(例如手電筒照射)時暴露蜘蛛的位置。[33][34]
中樞神經系統和大腦中的視覺處理
[edit | edit source]就像神經科學的任何領域一樣,我們對蜘蛛的中樞神經系統(CNS)知之甚少,特別是在它在視覺控制行為中的作用方面。在所有蜘蛛中,對杯狀蜘蛛的 CNS 研究最為廣泛,主要集中在 CNS 結構方面。迄今為止,我們對杯狀蜘蛛中樞神經元的電生理特性知之甚少,對於其他蜘蛛在這方面的瞭解就更少了。
蜘蛛神經系統的結構與其身體的細分密切相關,但神經組織並沒有分散在整個身體中,而是高度集中和集中化。CNS 由兩對相當簡單的 нервные клетки 簇(神經節)組成,這些神經節透過神經與蜘蛛的肌肉和感覺系統相連。大腦是由這些神經節融合在口前和口後頭節中形成的,並充滿著大量的 нервные клетки 組織,而腹部不存在神經節。從蜘蛛的大腦來看,它只接收來自一個感覺系統的直接輸入,即眼睛——這與任何昆蟲和甲殼類動物不同。八根視神經從正面進入大腦,它們的訊號在腦前部的兩個視葉中被處理。當蜘蛛的行為特別依賴於視覺時,就像跳蛛一樣,視神經節佔據了大腦體積的 31%,表明大腦幾乎完全致力於視覺。這個比例在杯狀蜘蛛中仍高達 20%,而其他蜘蛛,如金絲蛛和樹皮蛛,只有 2%。
主要眼睛和次要眼睛之間的區別在腦中仍然存在。這兩種型別的眼睛都有自己的視覺通路,有兩個獨立的神經纖維區域,執行不同的任務。因此,蜘蛛明顯地並行處理兩種眼睛型別提供的視覺資訊,次要眼睛專門用於檢測物體的水平運動,而主要眼睛用於檢測形狀和紋理。
雖然主要和次要視覺在蜘蛛的大腦中似乎是不同的,但兩個視覺系統之間的驚人相互關係也是眾所周知的。在視覺實驗中,當遮蓋主要或次要眼睛時,測量了捕鳥蛛主要眼睛肌肉的活動。當用移動的黑色短條序列刺激白色競技場中的動物時,只要次要眼睛檢測到其視野內的運動,主要眼睛就會不由自主地移動。與沒有呈現刺激相比,主要眼部肌肉的這種活動增加不會在用黑色油漆覆蓋主要眼睛時發生變化,但如果遮蔽次要眼睛,這種活動就會停止。因此現在很清楚,只有從次要眼睛接收到的輸入控制著主要眼睛肌肉的活動。此外,蜘蛛的主要眼睛似乎不參與運動檢測,這僅僅是次要眼睛的責任。
其他使用雙通道遙測記錄捕鳥蛛眼部肌肉活動的實驗表明,蜘蛛主動注視著行走方向:主要眼睛的同側視網膜在轉彎之前、期間和之後相對於行走方向發生偏移,而對側視網膜則保持在靜止位置。這與實際的光照條件無關,表明這是由蜘蛛的大腦發起的“自願”注視。

跳蛛被認為是透過對視覺區域的掃描過程來識別形狀和形式的,該過程包括一組複雜的旋轉(扭轉運動)和前正中眼部視網膜的平移。正如“主要眼睛視網膜運動”部分所述,蜘蛛的視網膜很窄,形狀像迴旋鏢,可以透過掃過視覺場景與直線特徵相匹配。當調查一個新的目標時,眼睛會以一種定型的方式掃描它:透過以每秒 3-10° 的速度緩慢地從一側移動到另一側,並旋轉 ± 25°,水平和扭轉視網膜運動允許檢測不同位置和旋轉的線。這種方法可以理解為模板匹配,其中模板具有細長的形狀,並且只要視網膜與場景中的直線特徵匹配,就會產生強烈的神經反應。這識別了一條直線,幾乎不需要任何進一步的處理。
一種將直線檢測作為最佳化問題的計算機視覺演算法(da Costa,da F. Costa)受到跳蛛視覺系統的啟發,並使用相同的方法,即使用模板匹配順序掃描場景。雖然眾所周知的霍夫變換允許在影像中魯棒地檢測直線視覺特徵,但由於在搜尋線時需要計算引數空間的很大一部分甚至全部,因此其效率受到限制。相反,跳蛛視覺系統中使用的另一種方法建議使用線性視窗搜尋視覺空間,這允許在直線搜尋過程中使用自適應搜尋方案,而無需系統地計算引數空間。此外,以這種方式解決直線檢測問題使其成為一個最佳化問題,這使得計算機能夠進行有效地處理。雖然需要透過實驗找到控制基於退火的掃描的適當引數,但採用跳蛛直線檢測路徑的方法被證明非常有效,尤其是在正確設定引數的情況下。[35]

捕鳥蛛已被證明具有區分略微不同的視覺目標的能力,儘管該物種在捕食或交配行為中主要依靠其機械感覺系統。當將兩個目標呈現在距離蜘蛛 2 米處時,其行走路徑取決於其視覺外觀:當必須在兩個相同的目標(如垂直條)之間進行選擇時,捕鳥蛛沒有表現出任何偏好。但是,該動物強烈偏好垂直條而不是傾斜條或 V 形目標。
不同目標的辨別已被證明只有在主要眼睛未遮蓋的情況下才有可能,而蜘蛛能夠使用任何眼睛檢測目標。這表明許多蜘蛛的前外側(次要)眼睛能夠完成比簡單物體運動檢測更多的功能。當所有眼睛都被遮蓋時,蜘蛛會表現出完全無方向的行走路徑。
然而,將捕鳥蛛放置在完全黑暗中不僅會導致無方向的行走,還會引起步態的變化:蜘蛛不會使用所有八條腿,而只會用六條腿行走,並將第一條腿用作觸角,類似於盲人的柺杖。為了感知周圍環境,伸出的前肢會上下左右移動。這僅針對第一對腿,僅受視覺輸入的影響,當普通房間燈光切換到不可見的紅外光時,就會發生這種情況。
跳蛛在用眼睛檢測到運動後的行為取決於三個因素:目標的大小、速度和距離。如果它的大小是蜘蛛的兩倍以上,則不會靠近該物體,如果該物體向它移動,蜘蛛會試圖逃脫。如果目標大小合適,則會使用次要眼睛視覺分析其速度。速度超過 4°/s 的快速移動目標會受到跳蛛的追逐,並由其前外側眼睛引導。會仔細地靠近速度較慢的物體,並用前正中(即主要)眼睛進行分析,以確定它是獵物還是同一物種的另一隻蜘蛛。這似乎是透過應用上述直線檢測來實現的,以找出視覺目標是否有腿。雖然跳蛛已被證明只要物體移動就會靠近具有適當特徵的潛在獵物,但雄性在決定其當前的配偶是否可能是潛在的伴侶時會更加挑剔。
實驗表明,中心點周圍有類似腿的附屬物的圖紙會導致求愛展示,這表明跳蛛使用視覺特徵提取來檢測目標中線性結構的存在和方向。此外,蜘蛛對被認為是同種蜘蛛的行為取決於不同的因素,例如兩隻參與蜘蛛的性別和成熟度,以及是否是交配時間。雌性狼蛛(Schizocosa ocreata)在選擇伴侶時甚至能辨別雄性次要性徵的非對稱性,可能是為了避免後代出現發育不穩定。雄性前肢上醒目的毛簇,用於視覺求愛訊號,似乎會影響雌性的伴侶選擇,而這些身體部位的非對稱性則會導致腿部損失和再生,顯然會降低雌性對這些雄性蜘蛛的接受度。[36]
跳蛛在獵捕昆蟲獵物時的潛行行為類似於貓潛行捕鳥。如果次要眼睛的視野內有東西在移動,它們就會啟動轉動,將更大、面向前方的一對主要眼睛移至適當位置,以便將物體的形狀分類為配偶、對手或獵物。即使是非常小的、低對比度的點刺激,以慢速或快速的速度移動,也會引起這種定向行為。與捕鳥蛛一樣,跳蛛也能夠使用它們的次要眼睛完成比運動檢測更復雜的任務:向跳蛛呈現視覺獵物線索,只有次要眼睛的視覺資訊可用,而兩隻主要眼睛被遮蓋,會導致動物表現出完整的狩獵序列。這表明跳蛛的前外側眼睛可能是其視覺系統中最通用的部分。除了檢測運動之外,次要眼睛顯然還具有足夠好的空間辨別能力,可以指導完整的視覺引導狩獵序列。
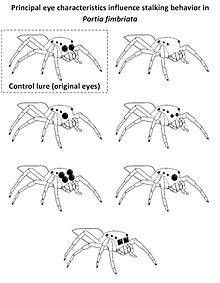
視覺線索在跳蛛(跳蛛科)利用主要視力區分跳蛛科獵物和非跳蛛科獵物時也起著重要作用。為此,跳蛛科獵物的大型主要眼睛提供了關鍵線索,跳蛛 Portia fimbriata 會對這些線索做出反應,在攻擊前表現出隱秘的潛行策略(非常緩慢地行走,觸鬚收縮,面對獵物時會凍結)。這種行為只在識別獵物為跳蛛科時才會使用。在實驗中,向 Portia fimbriata 展示了經過修改的主要眼睛的計算機渲染的逼真三維誘餌,利用了這一點。雖然完整的虛擬誘餌會導致隱秘的潛行,但沒有主要眼睛或主要眼睛比平時小的誘餌(如右圖所示)會引發不同的行為。向虛擬的跳蛛科獵物展示只有單眼或兩個放大的次要眼睛的普通誘餌,會引發隱秘的潛行行為,表明成功識別了跳蛛科,而 P. fimbriata 面對獨眼怪誘餌(單眼位於兩個次要眼睛之間)時,凍結的頻率較低。具有方形邊緣的主要眼睛的誘餌通常不會被歸類為跳蛛科,表明主要眼睛邊緣的形狀是識別同類跳蛛科的重要線索。[37]

在對 Phidippus 屬蜘蛛進行的一項研究中,研究人員在障礙物開口的另一側放置了視覺目標,以測試蜘蛛穿越不適宜的開放空間的意願。研究發現,蜘蛛是否冒險穿越空曠的地面主要取決於諸如目標距離、目標相對大小與距離之比以及目標顏色和形狀等因素。在獨立的測試執行中,蜘蛛移動到高遠的目標的頻率與移動到矮近的目標的頻率相同,這兩個物體在蜘蛛的視網膜上看起來大小相同。當提供選擇移動到白色或綠色草狀目標的選擇時,蜘蛛始終選擇綠色目標,無論其與背景的對比度如何,從而證明了它們在狩獵情境中使用顏色辨別的能力。[38]
Psecas chapoda(一種生活在鳳梨科植物上的跳蛛)能夠透過視覺分析寄主植物葉片和蓮座的結構特徵來檢測有利的微生境,研究人員向它們展示了經過處理的真實植物和植物照片。透過使用黑白照片,在研究中可以排除其他線索(如顏色和氣味)對蜘蛛選擇寄主植物的潛在影響,只留下形狀和形式作為辨別特徵。即使僅根據照片做出決定,Psecas chapoda 也始終偏好蓮座狀植物(龍舌蘭科),其葉片窄而長,而不是其他型別的植物,這證明某些蜘蛛物種能夠僅根據植物性狀的視覺線索(形狀)來評估和區分微生境的物理結構。[39]
- ↑ K. Gammon, Life’s Little Mysteries (http://www.lifeslittlemysteries.com/1647- smartest-non-primates.html) . TechMediaNetwork.
- ↑ G. S. et al., Control of Octopus Arm Extension by a Peripheral Motor Program . Science 293, 1845, 2001.
- ↑ Y. Gutfreund, Organization of octopus arm movements: a model system for study- ing the control of flexible arms. Journal of Neuroscience 16, 7297, 1996.
- ↑ P. Graziadei, The anatomy of the nervous system of Octopus vulgaris, J. Z. Young. Clarendon, Oxford, 1971.
- ↑ M. J. Wells, The orientation of octopus. Ergeb. Biol. 26, 40-54, 1963.
- ↑ J. L. Fox and T. L. Daniel (2008), "A neural basis for gyroscopic force measurement in the halteres of Holorusia.", J Comp Physiol, 194: 887–897
- ↑ a b Rhoe A. Thompson (2009), "Haltere Mediated Flight Stabilization in Diptera: Rate Decoupling, Sensory Encoding, and Control Realization.", PhD thesis, University of Florida
- ↑ a b J. W. S. Pringle (1948), "The gyroscopic mechanism of the halteres of diptera.", Phil Trans R Soc Lond B, 233 (602): 347–384
- ↑ a b c d e f g h i Kamikouchi A, Inagaki HK, Effertz T, Hendrich O, Fiala A, Gopfert MC, Ito K (2009). "The neural basis of Drosophila gravity-sensing and hearing". Nature. 458 (7235): 165–171.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ a b c d Yack JE (2004). "The structure and function of auditory chordontonal organs in insects". Microscopy Research and Technique. 63 (6): 315–337.
- ↑ Johnston, Christopher. 1855. Original Communications: Auditory Apparatus of the Culex Mosquito
- ↑ a b c Dreller C and Kirchner WH (1993). "Hearing in honeybees: localization of the auditory sense organ". Journal of Comparative Physiology A. 173: 275–279.
- ↑ McIver, S.B. 1989. Mechanoreception, In Comprehensive Insect Physiology, Biochemistry, and Pharmacology. Pergamon Press. 1989, Vol. 6, pp. 71-132.
- ↑ Keil, Thomas A. 1999. Chapter 1 - Morphology and Development of Peripheral Olfactory Organs. [book auth.] B.S. Hansson. Insect Olfaction. s.l. : Springer, 1999, pp. 5-48
- ↑ a b c d e Jarman, Andrew P. 2014. Chapter 2 - Development of the Auditory Organ (Johnston's Organ) in Drosophila. Development of Auditory and Vestibular Systems (Fourth Edition). San Diego : Academic Press, 2014, pp. 31-61
- ↑ Baker, Dean Adam and Beckingham, Kathleen Mary and Armstrong, James Douglas. 2007. Functional dissection of the neural substrates for gravitaxic maze behavior in Drosophila melanogaster. Journal of Comparative Neurology. 2007, Vol. 501, 5, pp. 756-764
- ↑ Nadrowski, Björn 和 Albert, Jörg T. 以及 Göpfert, Martin C (2008). "基於換能器的力生成解釋了果蠅聽覺中的主動過程". 當代生物學. 18 (18): 1365–1372.
{{cite journal}}: CS1 維護:作者列表中有多個名稱 (link) - ↑ a b c Kamikouchi A, Shimada T 和 Ito K (2006). "果蠅黑腹果蠅腦中聽覺感覺投射的全面分類". J. 比較神經. 499 (3): 317–356.
- ↑ Tauber, Eran 和 Eberl, Daniel F. 2003. 果蠅的聲學交流. 行為過程. 2003, 第 64 卷, 第 2 期, 第 197-210 頁
- ↑ Baker, Dean Adam 和 Beckingham, Kathleen Mary 和 Armstrong, James Douglas. 2007. 果蠅黑腹果蠅重力迷宮行為神經基礎的功能性解剖. 比較神經學雜誌. 2007, 第 501 卷, 第 5 期, 第 756-764 頁
- ↑ a b c d e Yorozu S, Wong A, Fischer BJ, Dankert H, Kernan MJ, Kamikouchi A, Ito K 和 Anderson DJ (2007). "果蠅腦中風和近場聲音的不同感覺表徵". 自然. 458 (7235): 201–205.
{{cite journal}}: CS1 維護:作者列表中有多個名稱 (link) - ↑ Beckingham, Kathleen M. 和 Texada, Michael J. 以及 Baker, Dean A. 以及 Munjaal, Ravi 和 Armstrong, J. Douglas. 2005. 動物的重力感知遺傳學. 學術出版社. 2005, 第 55 卷, 第 105-145 頁
- ↑ Nadrowski, Björn 和 Albert, Jörg T. 以及 Göpfert, Martin C. 2008. 基於換能器的力生成解釋了果蠅聽覺中的主動過程. 當代生物學. 2008, 第 18 卷, 第 18 期, 第 1365-1372 頁
- ↑ a b c Greggers U, Koch G, Schmidt V, Dürr A, Floriou-Servou A, Piepenbrock D, Göpfert MC 和 Menzel R (2013). "蜜蜂對電場的接收和學習". 英國皇家學會學報B: 生物科學. 280: 1759.
{{cite journal}}: CS1 維護:作者列表中有多個名稱 (link) - ↑ Kavlie, Ryan G. 和 Albert, Jörg T. 2013. 索頓器官. 當代生物學. 2013, 第 23 卷, 第 9 期, 第 334-335 頁
- ↑ Jennings, Barbara H. 2011. 果蠅,生物學和醫學中的通用模型. 材料今日. 2011, 第 14 卷, 第 5 期, 第 190-195 頁
- ↑ F. G. Barth: 蜘蛛的世界:感覺和行為. ISBN 978-3-642-07557-5, 施普林格出版社柏林,海德堡. (2002)
- ↑ D. P. Harland, R. R. Jackson: '八條腿的貓' 以及它們如何看到 - 對跳蛛 (Araneae: Salticidae) 的最新研究綜述. 坎特伯雷大學動物學系 (2000)
- ↑ A. Schmid: 蜘蛛 杯狀腹毛蛛 (Cupiennius salei) 不同眼型別的不同功能. 實驗生物學雜誌 201, 221–225 (1998)
- ↑ S. Yamashita, H. Tateda: 跳蛛眼睛的光譜敏感度. J. comp. Physiol. 105, 29-41 (1976)
- ↑ D. P. Harland, R. R. Jackson: 虛擬獵物前內側眼線索對食蛛跳蛛 (Portia fimbriata) 的影響. 實驗生物學雜誌 205, 1861–1868 (2002)
- ↑ A. Schmid, C. Trischler: 自由行走的蜘蛛的主動感官: 看哪裡去. 昆蟲生理學雜誌 57 第 494–500 頁 (2011)
- ↑ D. B. Zurek, X. J. Nelson: 跳蛛側眼的超敏運動檢測. 視覺研究 66 第 26–30 頁 (2012)
- ↑ D. B. Zurek, A. J. Taylor, C. S. Evans, X. J. Nelson: 前側眼在基於視覺的跳蛛行為中的作用. 實驗生物學雜誌 213, 2372-2378 (2010)
- ↑ F. M. G. da Costa, L. da F. Costa: 直線檢測作為最佳化問題: 一種受跳蛛視覺系統啟發的思路. 在: 生物啟發的計算機視覺, 第一個 IEEE 國際研討會, BMVC 2000, 韓國首爾 (2000)
- ↑ G.W. Uetz, E. I. Smith: 視覺訊號特徵的不對稱性以及狼蛛的性選擇. Behav Ecol Sociobiol (1999) 45: 87–93
- ↑ D. P. Harland, R. R. Jackson: 虛擬獵物前內側眼線索對食蛛跳蛛 (Portia fimbriata) 的影響. 實驗生物學雜誌 205, 1861–1868 (2002)
- ↑ R. R. Jackson, D. P. Harland: 對跳蛛來說只是一小步,但對視覺科學來說是巨大的一步. 實驗生物學雜誌, JEB 經典 第 2129-2132 頁
- ↑ P. M. de Omena 和 G. Q. Romero: 利用微生境特徵的視覺線索尋找家園: 鳳梨跳蛛 (Salticidae) 的案例研究. 行為生態學 21:690–695 (2010)







![{\displaystyle {{e}_{ij}}(t)=\int \limits _{0}^{t}{d{t}'}\,G(t-{t}')\left[S_{i}^{LMAN}(t)-\left\langle S_{i}^{LMAN}\right\rangle \right]\,\,S_{ij}^{HVC}(t)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b43f62b81c13062636c5d924a6ca0aa129f13fd8)







