結構生物化學/細胞凋亡
細胞凋亡是發育過程中和清除細胞的正常過程。這些細胞可能發展成癌細胞。
細胞凋亡是細胞程式性死亡。它自然發生在多細胞生物體中,用於調節死亡細胞。細胞凋亡每天都在人類體內發生,每天自然摧毀 20 到 700 億個細胞,這些細胞最終被更新的細胞取代。
在細胞凋亡過程中,細胞會
- 收縮
- 在它們的表面形成氣泡狀的囊泡
- 使它們細胞核中的染色質降解
- 使它們的線粒體分解並釋放細胞色素 c
- 分解成小的、膜包裹的片段
- 釋放 ATP 和 UTP
- 它們的核苷酸會與吞噬細胞上的受體結合,這將作為吸引垂死細胞的訊號
- 磷脂磷脂醯絲氨酸將在表面暴露
- 暴露的磷脂將作為“吞噬我”的訊號,這將誘導吞噬細胞吞噬細胞片段
- 吞噬細胞分泌抑制炎症的細胞因子
這種有序的事件模式被稱為程式性細胞死亡,也稱為細胞凋亡。[1]
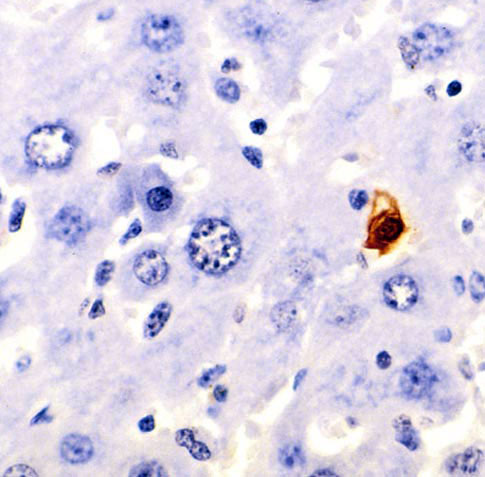
細胞凋亡是由德國科學家卡爾·沃格特發現的,他首次詳細描述了細胞凋亡的過程。這一發現後來被沃爾特·弗萊明給出了更精確的定義。自 1990 年代以來,細胞凋亡開始更加主流,並得到更多研究。它真正始於 1960 年代,當時人們在顯微鏡下觀察到它正在發生。下面的圖片是小鼠肝臟細胞,被染色的細胞正在經歷細胞凋亡。
由於細胞凋亡的途徑非常長,如果一個生化反應沒有完成,它最終會導致細胞無法死亡並繼續在生物體中造成破壞。如果細胞沒有經歷它們生命週期中的這個自然階段,它們最終會導致疾病和/或疾病。這個問題可以與癌症的產生聯絡起來,因為一個功能失調的細胞能夠複製並傳遞任何不良的細胞器或不正確的 DNA 序列。
下面是來自維基共享資源的一張圖片,簡要地展示了細胞凋亡在細胞中發生的過程的示意性圖形
細胞凋亡是在線蟲中研究的,在其細胞死亡的最後階段,人們發現死亡誘導蛋白酶 CED-3 的啟用是細胞凋亡的原因。為了調節這些蛋白酶,人們發現 CSP-3 可以阻止 CED-3 自啟用,並最終減少線蟲發育階段的細胞凋亡跡象。CSP-3 是一種半胱天冬酶同源物,僅在體細胞中起作用。因此,生殖細胞不受 CSP-3 的影響。
- 細胞凋亡對於身體部位的正常發育和形成是必需的。例如,胎兒的手指和腳趾的形成是透過它們之間的組織的細胞凋亡而實現的。
- 細胞凋亡需要破壞對生物體整體福祉構成威脅的細胞。例如,破壞具有受損 DNA 的細胞。
- 存在積極訊號的撤回。細胞需要從其他細胞中接收持續的刺激、積極訊號,或者需要持續粘附到表面才能存活。
例如:神經元生長因子的撤回會導致細胞凋亡,因為生長因子充當積極訊號,對於細胞發育至關重要
- 存在負面訊號的接收。
例如:細胞內氧化劑的增加或錯誤摺疊蛋白的積累。
細胞凋亡有 3 種不同的機制。
- 在健康的細胞中,Bcl-2 蛋白顯示線上粒體外膜的表面。這種蛋白抑制細胞凋亡。
- 細胞的內部損傷會導致 Bax 蛋白遷移到線粒體表面,抑制 Bcl-2 的作用,並粘附線上粒體外膜表面。Bax 線上粒體外膜上打孔,導致細胞色素 c 溢位。
- 細胞色素 c 利用 ATP 提供的能量,並繼續與 Apaf-1 (“凋亡蛋白酶啟用因子-1”) 蛋白結合。
- 細胞色素 c 與 Apaf-1 的結合形成凋亡體。
- 凋亡體與 caspase-9 結合並激活它。Caspase-9 是一種切割蛋白質的蛋白酶。
- 當 caspase-9 切割蛋白質時,它會啟用來自其家族的其他 caspase。例如,caspase-3 和 caspase-7。
- caspase 的啟用會產生一系列蛋白水解活性。這些蛋白水解活性會導致細胞質中結構蛋白的消化、染色體 DNA 的降解以及細胞的吞噬作用。[2]
- 膜整合蛋白,如 Fas 和 TNF 受體,在細胞表面暴露受體。
- 與互補的死亡啟用劑(如 FasL 和 TNF)結合,會向細胞質傳送訊號,導致 caspase-8 的啟用。
- 與 caspase-9 相似,caspase-8 會啟用一系列蛋白水解活性,最終導致細胞的吞噬作用。[3]
- 神經元在不使用 caspase 的情況下經歷細胞凋亡。
- AIF 是一種位於線粒體膜間隙的蛋白質。
- 當細胞接收到死亡訊號時,從線粒體釋放的 AIF 會遷移到細胞核中並與 DNA 結合,然後觸發 DNA 的破壞。
- 除了程式性細胞死亡外,AIF 在健康細胞中也起著重要的線粒體作用。“AIF 的一部分在凋亡功能中是可有可無的,它攜帶一個 NADH 氧化酶域,該域調節呼吸鏈複合物 I,對於細胞存活、增殖和線粒體完整性是必需的。”[4]
最近利用突變小鼠進行的研究有助於理解 AIF 的線粒體功能。例如,AIF 缺陷小鼠被用作複雜 I 缺陷模型,顯示出線粒體代謝的普遍重程式設計。[5] 在人類中,複雜 I 缺陷導致超過 30% 的線粒體疾病,[6] 主要影響嬰兒,表現出各種症狀,如癲癇發作、失明、失聰、共濟失調、認知缺陷、肌病和心肌病。
研究表明,AIF 的未表徵剪接異構體,其組織和細胞型別特異性表達模式可能是 AIF 缺陷中某些組織特異性效應的原因。此外,無法檢測到 AIF 突變可能導致 AIF 缺陷的胚胎致死性,這在突變小鼠中觀察到。[7]
研究還表明,AIF 表達量減少 80% 允許小鼠發育 Hq,並由於加劇的複雜 I 缺陷而影響成年動物的健康。[8]
突變小鼠被用於研究 AIF 在細胞存活、增殖和代謝中的作用。如果 AIF 的存在水平較低,它不會影響 Hq 突變的遺傳,並且在表現出生長遲緩方面沒有重大影響。隨著時間的推移,AIF 水平的降低會對衰老成年小鼠的健康產生重大影響。[9] AIF 的完全喪失會導致子宮內發育不相容,並且由於同源重組失敗而傾向於導致 AIF 零小鼠。[10]
- 某些身體部位,如睪丸和眼球前房,不受抗原入侵的影響。事實證明,這些細胞以高速度產生 FasL,因此,產生 Fas 的抗原在進入這些部位後立即會被殺死。
- 這一發現將極大地幫助移植接受者,因為如果能夠有效地將人工細胞插入移植器官中,這些細胞會以高水平產生 FasL,移植器官將不太容易受到宿主機體細胞介導的免疫系統的攻擊。
- 到目前為止,已經對動物進行了臨床試驗。合成表達 FasL 的同種異體移植已顯示出腎臟的存活率提高,但心臟的存活率沒有提高。
- 植物也會經歷程式性細胞死亡。凋亡可能幫助植物阻止病毒感染的擴散。
- 植物凋亡的機制也涉及 caspase,它在 Asp 殘基處切割。然而,caspase 的啟用會破壞中央液泡,進而分解細胞的其餘部分,而不是 DNA。
- ↑ http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/A/Apoptosis.html
- ↑ http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/caspase9.png
- ↑ http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/CTL_Fas.gif
- ↑ Hangen, Emilie; Blomgren, Klas; Bénit, Paule; Kroemer, Guido; Modjtahedi, Nazanine (2010). "Life with or without AIF". Trends in Biochemical Sciences. 35 (5): 278–87. doi:10.1016/j.tibs.2009.12.008. PMID 20138767.
- ↑ Pospisilik, J. Andrew; Knauf, Claude; Joza, Nicholas; Benit, Paule; Orthofer, Michael; Cani, Patrice D.; Ebersberger, Ingo; Nakashima, Tomoki; Sarao, Renu; Neely, Gregory; Esterbauer, Harald; Kozlov, Andrey; Kahn, C. Ronald; Kroemer, Guido; Rustin, Pierre; Burcelin, Remy; Penninger, Josef M. (2007). "Targeted Deletion of AIF Decreases Mitochondrial Oxidative Phosphorylation and Protects from Obesity and Diabetes". Cell. 131 (3): 476–91. doi:10.1016/j.cell.2007.08.047. PMID 17981116.
- ↑ Koene, S.; Smeitink, J. (2009). "Mitochondrial medicine: Entering the era of treatment". Journal of Internal Medicine. 265 (2): 193–209. doi:10.1111/j.1365-2796.2008.02058.x. PMID 19192036.
- ↑ Vahsen, Nicola; Candé, Céline; Brière, Jean-Jacques; Bénit, Paule; Joza, Nicholas; Larochette, Nathanael; Mastroberardino, Pier Giorgio; Pequignot, Marie O; Casares, Noelia; Lazar, Vladimir; Feraud, Olivier; Debili, Najet; Wissing, Silke; Engelhardt, Silvia; Madeo, Frank; Piacentini, Mauro; Penninger, Josef M; Schägger, Hermann; Rustin, Pierre; Kroemer, Guido (2004). "AIF deficiency compromises oxidative phosphorylation". The EMBO Journal. 23 (23): 4679–89. doi:10.1038/sj.emboj.7600461. PMC 533047. PMID 15526035.
- ↑ Hangen, Emilie; Blomgren, Klas; Bénit, Paule; Kroemer, Guido; Modjtahedi, Nazanine (2010). "有或無 AIF 的生命". 生物化學趨勢. 35 (5): 278–87. doi:10.1016/j.tibs.2009.12.008. PMID 20138767.
- ↑ Bénit, Paule; Goncalves, Sergio; Dassa, Emmanuel Philippe; Brière, Jean-Jacques; Rustin, Pierre (2008). "小丑魚表型的變異類似於人類線粒體複合物 I 缺乏症". PLoS ONE. 3 (9): e3208. Bibcode:2008PLoSO...3.3208B. doi:10.1371/journal.pone.0003208. PMC 2527683. PMID 18791645.
- ↑ Joza, Nicholas; Susin, Santos A.; Daugas, Eric; Stanford, William L.; Cho, Sarah K.; Li, Carol Y. J.; Sasaki, Takehiko; Elia, Andrew J.; Cheng, H.-Y. Mary; Ravagnan, Luigi; Ferri, Karine F.; Zamzami, Naoufal; Wakeham, Andrew; Hakem, Razqallah; Yoshida, Hiroki; Kong, Young-Yun; Mak, Tak W.; Zúñiga-Pflücker, Juan Carlos; Kroemer, Guido; Penninger, Josef M. (2001). "線粒體凋亡誘導因子在程式性細胞死亡中的重要作用". 自然. 410 (6828): 549–54. doi:10.1038/35069004. PMID 11279485.