結構生物化學/生物物理學 - 單分子技術
單分子技術最近在生物物理學領域變得流行起來,有助於發現或闡明並更好地理解一些重要的生物化學特性,例如蛋白質-DNA相互作用、蛋白質摺疊以及膜蛋白的功能和能力。許多單分子技術最初是在物理學和生物物理學領域被發現的,後來被發現對研究生物和生物化學分子有很大的幫助。1976年,首次發現了稱為單離子通道記錄的技術,隨後成為原子力顯微鏡 (AFM)、光鑷和磁鑷以及單分子熒光光譜等最新技術的先驅。許多這些最新的技術已幫助蛋白質摺疊、轉錄、複製、翻譯、分子馬達、膜蛋白和病毒生物學等領域取得了進展。這些單分子方法能夠提供以前無法解決的問題的資訊,同時也提供了對已研究主題的更詳細的瞭解。不僅如此,單分子技術還能夠引導生物化學家擺脫通常的集合平均,從而導致使用摩爾,轉向更詳細和統一的概念,涉及單個分子和顆粒。
單分子技術的一個有用方面是,它們給出了某個屬性值的分佈,而不是該屬性在大量分子集合中的平均值。這種特性允許獲得更完整和具體的資料,這些資料可以比平均值更詳細地描述正在評估的特定生物分子,而平均值則提供了相當不具體和廣泛的視角。單分子方法的這種特異性還提供了有關分子異質性的資訊,分子異質性是複雜生物分子及其功能的一個基本方面。分子異質性可以分為靜態和動態兩種。靜態異質性是指具有多個亞群的分子集合在觀察期間非常穩定且不相互轉換。一個例子是不活躍的分子。當使用集合方法時,人們試圖確定活性分子與整個群體相比的比例。但是,當使用單分子技術時,可以忽略或不考慮非活性分子,因為它們不會產生實驗訊號。因此,靜態異質性允許僅研究感興趣的物種(活性分子),因為非活性分子可以被忽略和去除。另一方面,動態異質性是指樣品中分子亞群在觀察期間相互轉換。動態異質性的一個例子是一種酶,它在兩種催化活性狀態之間相互轉換,每種構象對底物的親和力不同。當酶的相互轉換速度比所用單分子技術的時態解析度快時,輸出值將顯示每種酶兩種狀態的親和力的加權時間平均值。另一方面,如果相互轉換速度比單分子方法的時態解析度慢,則可以直接觀察到兩種狀態之間的相互轉換。此外,在多步作用於底物的酶中也可以觀察到動態異質性,每一步都有不同的速率。透過單分子分析,可以仔細監測酶過程中每個單一步驟的觀察結果,作為即時“電影”,顯示每個步驟的動力學以及酶和底物的中間結構。
從單分子技術中提取的資訊型別也可以與經常使用的集合分析進行比較。一個例子是單分子方法提供的動力學資訊。透過單分子方法對反應進行動力學觀察提供了所謂的駐留時間。這些駐留時間是指單個分子在反應途徑上每個特定狀態下的時間。想象一下,透過單分子可觀察物觀察到名為 A 和 B 的分子的兩種結構狀態。具有足夠時態解析度來觀察這兩種狀態的單分子方法能夠確定狀態 A 和 B 的駐留時間。之後,可以繪製頻率直方圖以提供有關每個駐留時間持續多長時間的資訊。駐留時間分佈可用於研究酶-底物相互作用。此示例還可以用於揭示單分子技術在其識別生物大分子結構狀態的方法中的重要方面。
目前存在各種各樣的單分子技術。常用的方法分為兩個不同的屬性:力學和熒光。這兩個組是根據不同的時間解析度、觀察範圍和不同的空間解析度進行分離的。在基於力的檢測方法中,有原子力顯微鏡、光鑷、繫留顆粒運動和磁鑷等特定技術。另一方面,熒光成像包括共聚焦顯微鏡和全內反射熒光 (TIRF)。
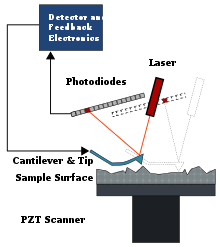
原子力顯微鏡最初用於平面原子表面上分子的形貌成像。這種成像方式是透過沿著樣品表面掃描一個極其尖銳的探針,然後使用雷射和象限光電探測器測量探針的偏轉來實現的。在這種成像下,可以觀察到乾燥和溼潤的溶液,儘管溼潤溶液的時態解析度遠低於乾燥溶液。AFM 的設定通常有一個小槓桿(AFM 懸臂樑),該槓桿的一端連線著一個尖銳的奈米級探針,該探針連線到生物分子的其中一端。透過使用壓電定位,可以將生物分子吸附的表面在 x、y、z 座標系(3D 空間)中掃描到埃級解析度。然後,可以透過使雷射束從探針表面反射到位置敏感的光電探測器上,來測量探針的位置。槓桿將充當線性彈簧,當生物分子相對於探針移動時,槓桿將彎曲並在分子上施加力。由於槓桿非常堅硬,因此施加的力可以很大,因此在測量摺疊蛋白質和化學鍵的結構特性方面非常有用。

對於光鑷方法,設定涉及一個高功率紅外雷射,由於高階顯微鏡物鏡,該雷射被聚焦得很緊。聚焦的紅外雷射束將在其焦點處捕獲一個微米大小的珠子,這使得能夠控制珠子的位置。然後,陷阱就像一個彈簧,當珠子遠離雷射軸移動時,它會對珠子施加更大的力。透過測量珠子相對於焦點的位移,可以確定陷阱施加的力(這可以使用象限光電探測器完成,就像在 AFM 中一樣)。光鑷有兩種主要模式:恆力模式和恆位模式。當處於恆力模式時,可以透過反饋迴路來維持恆定的陷阱力,該反饋迴路將移動光學陷阱或樣品蓋玻片表面,這將使珠子在被捕獲區域內保持恆定的位置。在恆位模式下,保持陷阱位置的中心,並且當珠子被拉出陷阱時,它將經歷逐漸增大的力。
磁鑷的設定將光鑷中使用的微珠替換為一個小的磁珠。這個小的磁珠將由靠近樣品的磁鐵對進行控制。這種設定允許繫留的生物分子施加力和輕鬆施加旋轉。磁鑷在恆力模式下工作,因為力是感興趣相互作用的重要控制引數。此外,與光鑷相比,磁鑷無法獲得精細的空間靈敏度。但是,它更容易使用,並且可以與單一生物分子的長期分析相容。磁鑷通常用於研究DNA的結構特性和蛋白質-DNA轉錄。
此方法用於研究蛋白質和聚合物的相互作用。主要思想是一個珠子結合到表面,而另一個珠子連線到聚合物的末端。然後將它們放入水溶液中,可以看出珠子具有受限的運動,它以布朗運動的方式移動。然後透過光學顯微鏡記錄該珠子的位置;記錄可以告訴我們轉錄過程中DNA的資訊。不同的珠子型別也改進了分析聚合物的方法。首先,有時使用金屬珠,因為它們具有高強度的金光。其次,聚苯乙烯珠也與光鑷結合使用,因為這些珠子比金屬珠的強度低。
熒光生物分子包含一些特性,熒光顯微鏡和光譜學可以使用這些特性來觀察它們的位置、結構和動力學。單分子熒光主要有兩種方法:共聚焦顯微鏡用於點檢測,寬場成像用於區域檢測。共聚焦顯微鏡用於點檢測,試圖收集由約1飛昇的衍射極限體積發射的熒光。另一方面,對於寬場成像,有全內反射熒光(TIRF)顯微鏡。TIRF能夠透過使用表面上方薄層內的消逝波激發並在表面上方使用超靈敏相機進行成像,長時間觀察表面上數百個不動的分子。
FIONA或具有奈米級精度的熒光成像,實現了1奈米的精度運動跟蹤。這可以透過連線到目標分子的任何單個熒光團或光散射顆粒(例如,小的金顆粒)來完成。透過這種設定,人們可以識別分子的存在並跟蹤其在體外分子軌道上的運動或其在體內的擴散。這種非凡的跟蹤能力已經能夠揭示驅動蛋白和肌球蛋白等分子馬達如何在它們的軌道上移動。這種跟蹤精度的結合以及一些探針熒光開關的複雜方法的發現,使得PALM(光啟用定位顯微鏡)和STORM(隨機光學重建顯微鏡)等技術成為可能。PALM和STORM因其能夠實現優於50奈米的空間解析度而被稱為“超解析度顯微鏡”。
如果將兩個探針連線到一個分子上,就會出現一些新的功能。FRET(熒光共振能量轉移)與距離相關,可用於測量奈米距離以及單分子內距離的變化。對於FRET,第一個探針將充當FRET供體,而第二個探針將充當FRET受體。第一個探針將是熒光的,第二個探針將以距離依賴的方式猝滅供體(它也可以是熒光的)。由於這種設定,改變供體-受體分離距離的運動也會改變它們的熒光。這些變化用於觀察構象變化或分子締合/解離的動力學。然而,單分子FRET也受熒光團的相對取向和旋轉自由度的影響,這可能被誤認為是構象變化。可以透過使用MFD(多引數熒光)來檢查這種困難,這是一種可以告知單分子熒光特性的方法,例如不同波長下的熒光強度、各向異性和壽命。另一種可以幫助解決複雜問題的方法是ALEX(交替雷射激發),它使用兩束雷射來測量FRET和相對探針化學計量。
單分子研究小組目前正在追求力學和熒光技術的結合,因為它將允許同時操縱和視覺化單分子在相互作用和反應時的行為。這種結合之所以有效,是因為力學和熒光技術高度互補,因為基於力的方法可以實現50-100毫秒的時間尺度,而基於熒光的方法可以快得多,並且不受施加力的限制。此外,基於力的方法提供更多關於生物分子全域性結構和機械重排的資訊,而基於熒光的方法揭示了局部構象變化。這兩種單分子方法的互補能力將來可能會帶來重大發現。
Kapanidis, A.N. 和 Strick, T.,2009,一次一個分子的生物學,趨勢生物化學科學,第 34 卷,第 234-243 頁。
