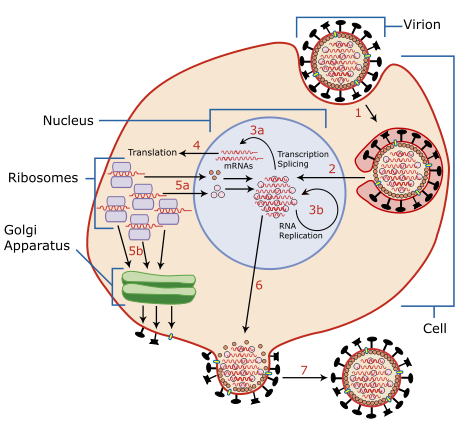
結構生物化學/碳水化合物/病毒
一些病毒透過附著在細胞表面碳水化合物上進入宿主細胞。特別是流感病毒,會附著在細胞表面糖蛋白和糖脂附近寡糖末端的唾液酸殘基上。


一旦附著,病毒就會注入自己的遺傳物質,並接管細胞的機器來生產更多病毒。細胞可以經歷裂解週期或溶原週期。在裂解週期中,細胞被接管,用自身的機器和細胞器生產病毒,然後死亡,釋放出更多病毒。在溶原週期中,細胞不會死亡,而是用病毒 DNA/RNA 在其自身基因組中複製。一個常見的溶原病毒的例子是 λ 噬菌體。然而,λ 噬菌體也可以進入裂解週期。透過這種方式,一些病毒可以休眠數年,在某些環境條件下啟用,並在裂解週期下開始複製。
有幾種不同型別的病毒,包括 DNA 病毒、RNA 病毒和逆轉錄病毒。DNA 病毒通常透過接管細胞的 DNA 複製,而 RNA 病毒傾向於在細胞質中複製。逆轉錄病毒透過逆轉錄將其 DNA 轉錄為宿主 DNA——HIV 就是這種情況。
人體擁有幾種針對病毒的防禦機制。人體的第一道防線是先天免疫反應,它是非特異性的,可以防禦各種威脅。炎症、咳嗽、打噴嚏以及其他各種非特異性防禦機制都是先天免疫反應的例子。另一方面,適應性免疫系統針對特定威脅。T 細胞和抗體啟用是適應性免疫系統防禦機制的例子。此外,科學家還開發了疫苗和抗病毒藥物來幫助免疫系統和/或破壞病毒複製機制。
淋巴細胞或白細胞是人體抵禦外來入侵者的主要防禦者。淋巴細胞有兩種主要型別,T 細胞和 B 細胞。在 T 細胞中,有 T 輔助細胞、細胞毒性細胞、記憶細胞、調節細胞和自然殺傷細胞。每種型別的 T 細胞在免疫反應中都有其自身的用途。輔助細胞在感染的最初跡象時協助並激活其他細胞,細胞毒性 T 細胞摧毀感染細胞,阻止更多病毒釋放,記憶細胞儲存抗原,使人體能夠快速識別之前的感染,從而使對抗未來感染更有效,調節性 T 細胞在感染消退後關閉免疫反應,自然殺傷細胞可以幫助殺死腫瘤細胞。另一方面,B 細胞識別抗原,並在找到感染的正確抗原後產生抗體。
病毒是寄生蟲,因為它們不能獨立生存。它們感染一個細胞,並利用感染的細胞繁殖並製造更多病毒。病毒被認為是有生命的,因為它們能夠複製並擁有防禦機制。所有病毒都具有一定的基因組,可以是單鏈或雙鏈的、DNA 或 RNA 的、線性的或環狀的。病毒基因組也非常小:它們可能是 4 個基因或幾百個,而原核生物往往有幾千個基因,真核生物往往有幾萬個基因。病毒有一個保護基因組的蛋白質外殼,這個外殼由蛋白質組成。通常,外殼有多個一個蛋白質的副本,因為病毒希望最小化其基因組。病毒希望儘快打包併發送新的病毒副本,因此,如果基因組更長、更多樣化,則打包時間更長,因為它必須編碼多個不同的基因;因此,如果病毒的基因組有多樣性,它們將處於極大的劣勢。
病毒是一種傳染性寄生代理,只能在其他宿主細胞內複製。所有病毒都有一個基因組和一個衣殼。
病毒基因組可以是
•單鏈 (ss) 或雙鏈 (ds)
•DNA 或 RNA
•線性的或環狀的
與其他生物相比,病毒基因組非常小。它包含兩個到幾百個基因。細菌等原核生物擁有數千個基因,而真核生物可以擁有數萬個基因。
病毒曾經被認為是自我複製的遺傳元件,但區分這兩者的指導原則是“一旦複製子整合了一個基因,使它能夠製造一個衣殼來包裹複製子,那麼就會產生一個稱為病毒粒的結構和功能實體”。這意味著病毒的功能標誌是病毒粒。[9]
衣殼是包圍基因組的蛋白質外殼。它包含一個蛋白質的多個副本,這對病毒有利,因為它只需要一個基因來編碼衣殼蛋白。衣殼及其封閉的基因組也稱為核衣殼。
一些病毒在核衣殼周圍也有一個膜雙層,可以作為保護層。這可以在已經感染宿主細胞並從宿主細胞出芽的病毒中找到。
病毒蛋白的結構與真核蛋白不同,因為它們由於氫鍵和範德華相互作用相對較少而鬆散堆積。[2]
病毒蛋白是含有許多無序片段和許多螺旋殘基的小蛋白。螺旋殘基會導致蛋白質鬆散堆積,因為螺旋構象(二級結構)是無序的,不容易靠近另一個蛋白質鏈。[2]
此外,病毒不被認為是生物,因為它們沒有滿足被認為是生物的生命基本要求。雖然病毒會複製,但它們不能代謝食物。病毒沒有組織化的細胞結構,在這些情況下不會對任何外部刺激做出反應,也不會保持體內平衡,其中試圖保持內部溫度恆定。此外,病毒不屬於任何動物界,它們不能適應環境,它們唯一的繁殖方法是入侵宿主細胞,但不能獨立繁殖。
幾十年來,科學家們一直在質疑病毒的真正起源。雖然關於起源有很多理論,但有三種假說對病毒的起源進行了更深入的討論。
1. 病毒起源於古老時期,在細胞生命出現之前。這種假說已被許多人拒絕,理由是病毒需要宿主細胞才能生存。如果病毒在細胞生命出現之前就存在,那麼它們將無法在宿主細胞中複製。
2. 病毒起源於透過減少而產生的細胞。這種假說以細胞和病毒之間的中間體尚未找到為前提而被拒絕。
3. 病毒透過利用從細胞控制中移除的細胞複製元件從細胞中逃逸。這種假說無法解釋如何構建複雜的病毒粒結構。此外,由於發現病毒能夠感染所有三個域的細胞,因此已證明它們是古老的,而不是來自減少的細胞。此外,巨病毒的發現也證明了這種假說的錯誤。
當比較兩種不同的植物病毒時,科學家們能夠看到衣殼結構的相似性和衣殼內排列的相似性。當比較兩種動物病毒時,不僅發現它們彼此相似,而且還發現它們與植物病毒相似,因為它們的衣殼蛋白摺疊方式相同。它們都共享了鏈狀 β 桶摺疊。植物、昆蟲和人類病毒顯示出共享類似的結構體系結構,因此得出結論,單鏈 RNA 病毒可能共享一個共同的祖先。除了單鏈 RNA 外,經過更多比較後,科學家發現即使是雙鏈 DNA 和細菌病毒也共享與單鏈 RNA 病毒相同的基本結構;它們都使用 β 桶摺疊。透過比較各種病毒,人們發現一個共同的祖先在分化之前感染了所有三個域的細胞。[9]
病毒根據兩種不同的分類進行分類:巴爾的摩體系和國際病毒分類委員會 (ICTV)。
巴爾的摩體系根據病毒的化學型別、鏈數以及它們的單鏈是否能夠直接進行翻譯將所有病毒劃分為七組。七類病毒是雙鏈 DNA、單鏈 DNA、雙鏈 RNA、正鏈 (正義) 單鏈 RNA、負鏈 (反義) 單鏈 RNA、具有 DNA 中間體的單鏈 RNA 和具有 RNA 中間體的雙鏈 DNA。
第二種分類將病毒分類為目、科、屬、種。病毒譜系的組織是基於每種病毒感染的宿主細胞型別的資訊。儘管 ICTV 盡力組織病毒,但仍然難以將大多數科指定為目。[9]
病毒結構是病毒世界中統一的組成部分。病毒具有幾種固定的結構,不會偏離這些結構。它們可以是二十面體、螺旋形、兩種結構的組合、瓶狀、檸檬狀和紡錘狀。一些病毒也是多形性的,它們具有脂質包膜。
為了分類目的,衣殼結構被宣佈為關鍵元素。複製過程和基因組結構被認為是分類中的一個要素,但由於它們缺乏用於身份識別的資訊,因此被排除在外。衣殼結構是與病毒身份一致的主要結構成分。[9]
病毒是專性(由必要性決定;無法適應不同的條件;限制在特定的生活方式)細胞內寄生蟲。它們只在宿主細胞內繁殖。病毒不包含任何代謝酶或蛋白質合成的“機制”。它們只能感染有限範圍/型別的宿主細胞(一些病毒可以感染多種物種,例如狂犬病病毒;一些病毒只能感染一種物種;動物病毒通常是組織或細胞型別特異性的;也就是說它們只會感染一種特定的細胞型別)。病毒生命週期的步驟(病毒與宿主細胞結合;病毒蛋白與宿主細胞表面受體之間鎖和鑰匙的契合;病毒基因組透過各種機制進入細胞;病毒基因組“指揮”其宿主,利用宿主細胞的機制複製病毒基因組併合成病毒蛋白;DNA病毒通常使用宿主細胞的DNA聚合酶,例如逆轉錄酶)。
動物病毒種類繁多,繁殖方式也多種多樣。許多動物病毒都有外膜(病毒包膜)。通常有一個脂質雙層(源自宿主細胞質膜),其中有病毒編碼的蛋白質突出。這些病毒編碼的蛋白質對於結合和幫助病毒進入細胞很重要。
皰疹病毒包膜源自核膜(皰疹病毒基因組整合到宿主細胞DNA中 - 作為前病毒)。通常病毒會保持潛伏狀態。但壓力會導致病毒活躍。前病毒離開基因組並啟動病毒生產。結果形成水泡。
DNA病毒有兩種型別:雙鏈DNA病毒和單鏈DNA病毒。
•雙鏈DNA病毒,例如天花病毒,能夠使用DNA聚合酶複製自身,使用RNA聚合酶轉錄mRNA,然後使用宿主細胞的核糖體產生蛋白質。
•單鏈DNA病毒必須使用DNA聚合酶兩次來複制其自身的基因組(第一個合成的鏈將是病毒基因組的共軛基因表達),但它們仍然可以使用RNA聚合酶來產生mRNA和宿主細胞的核糖體來產生蛋白質。
RNA病毒有三種類型:雙鏈RNA病毒、單鏈RNA病毒和逆轉錄病毒。與DNA病毒不同,RNA病毒可以使用RNA複製酶在宿主中複製。
•在雙鏈RNA病毒中,每條鏈都被認為是病毒mRNA。RNA複製酶可用於複製基因組和產生病毒蛋白。
•單鏈RNA病毒還存在兩種型別,陽性和陰性。在陽性SS RNA病毒中,RNA被稱為“有義”鏈,充當mRNA。RNA複製酶將製作mRNA的互補鏈,然後可以充當模板來複制其基因組。陽性SS RNA病毒也使用RNA複製酶來翻譯蛋白質。在陰性SS RNA病毒中,它們的基因組被認為是“無義”鏈,與mRNA鏈不同。因此,RNA複製酶必須從“無義”鏈上製作模板鏈,然後可以用它來產生蛋白質。它也充當模板來複制新的“無義”RNA。
•逆轉錄病毒也是單鏈RNA病毒,然而,它們的基因組透過病毒逆轉錄酶轉化為雙鏈DNA。首先,逆轉錄酶將使用原始單鏈RNA基因組製作DNA/RNA雜合鏈。然後它將使用新合成的單鏈DNA模板製作雙鏈DNA,然後將其整合到宿主基因組中,在那裡它將在宿主細胞的細胞週期中複製。
類病毒是感染植物的小分子裸露RNA。朊病毒是感染性蛋白質(引起多種退行性腦病)。腦病:瘋牛病,綿羊瘙癢病,人類克雅氏病。它可能是一種正常蛋白質的錯誤摺疊版本,它會重定向受感染細胞中的蛋白質摺疊。這會產生更多錯誤摺疊的蛋白質,這些蛋白質可以感染其他細胞。
宿主細胞防禦
病毒在細胞中通常很難看到,因為它們的“包膜”使它們看起來像宿主細胞的一部分。但是,如果細胞看到雙鏈RNA,它會提醒細胞出現了問題。雙鏈RNA被認為是外來的,一旦被發現,dicer酶就會將其切割成更小的RNA片段。RNA干擾(RNAi)會來破壞這些小的雙鏈RNA片段。雙鏈RNA還會發出停止轉錄的訊號,並增加核糖核酸酶的量,核糖核酸酶是一種催化RNA降解的酶。這將消除所有雙鏈RNA。一旦所有雙鏈RNA都被破壞,轉錄將像往常一樣繼續。
如果病毒抑制dicer,並且細胞無法消除細胞內的病毒,受感染的宿主細胞將被標記為凋亡。
也會發生透過主要組織相容性複合體I(MHC I)的免疫反應。MHC I參與抗原呈遞。一旦宿主細胞將病毒切割成更小的片段,MHC I就可以在細胞外呈遞抗原,然後可以被T細胞識別並促進抗體產生以幫助殺死受感染的細胞。
治療方法
病毒具有易於改變構象以適應新的宿主和條件的結構,這解釋了它們如何逃避藥物治療。[2]例如,每年都會有新的流感疫苗來對抗新的流感病毒株,這些病毒株是由允許它們在某些條件下更好地存在的微小突變引起的。
抗生素對病毒不起作用,而是體外合成疫苗。疫苗是透過純化的病毒蛋白製成的。純化的蛋白質缺乏致病基因組資訊,可以被切割成片段並注射到宿主體內。這樣,宿主就不會冒病毒感染其細胞的風險,相反,身體會識別切割的片段是來自病毒的外來抗原,並對其發動免疫反應。這使得免疫系統能夠準備抗體,並在發生真正的感染時做好準備。
逆轉錄酶抑制劑(RTI)是一種抗逆轉錄病毒藥物,靶向RNA病毒,如HIV感染。RTI用於抑制逆轉錄酶的活性,逆轉錄酶是允許病毒繁殖的必需酶。透過抑制轉錄,病毒DNA無法從RNA轉錄,從而阻止病毒感染週期。然而,隨著時間的推移,HIV感染的細胞最終會突變為另一種形式,具有不同的逆轉錄酶標籤,不受抗逆轉錄病毒藥物的影響,通常在大約五年時間內。
流感疫苗通常含有3種不同的滅活病毒,因為研究人員無法始終預測在季節性流感中起主要作用的病毒的確切型別。他們假設這3種可能性最高的蛋白質結構,並將它們放入疫苗中。
耐藥性
許多抗病毒劑是抑制劑,它們看起來像病毒蛋白質想要結合的實際分子。透過代替實際的蛋白質,抑制劑能夠充當“誘餌”並阻斷病毒蛋白質的活性位點,幫助阻止病毒的生命週期。
由於病毒蛋白質的活性位點不易改變,因此抑制劑的有效性取決於它與活性位點的契合程度。因此,通常,抑制劑的結構越接近通常與活性位點契合的實際分子,抑制劑就越有效。臨床試驗發現,抑制劑的結構越接近實際底物,病毒耐藥的屏障就越高。
病毒還擁有允許它們與宿主細胞融合的機制。這種融合機制也成為藥物的主要靶點。HIV等病毒已經表明,膜融合遵循六螺旋束的形成。這個束是由一個三聚體螺旋捲曲中間體形成的途徑產生的,該中間體可以使用N端上的“融合肽”與靶膜結合。
病毒耐藥性帶來了重大問題。群體中高於正常的病毒耐藥率通常歸因於患者使用抗病毒藥物。不按規定劑量服用或未按規定時間服用藥物會導致病毒耐藥。這是因為,如果沒有足夠的藥物劑量(例如:服用量少於規定劑量),抑制劑的含量不足以取代實際的底物。因此,那些對藥物只有輕微耐藥的病毒株,在正常情況下會在規定條件下死亡,最終會存活下來,並將其耐藥基因傳遞給後代。經過一段時間後,這種弱耐藥性會在多次突變後變得足夠強,能夠抵抗抗病毒藥物,即使是在規定條件下。透過從基因庫中去除非耐藥菌株的選擇過程,越來越多的菌株正在變得耐藥。
抗病毒耐藥性的一個重大問題是,群體中每個人都有責任幫助阻止其傳播。一個人不按規定服用處方藥的疏忽會導致耐藥菌株的傳播,從而降低其他人感染後抵抗病毒的能力。不幸的是,即使嚴格遵守處方,病毒也可能在一段時間後產生耐藥性。因此,儘管無論我們採取什麼措施,耐藥病毒株最終會變得越來越普遍,但人們仍然應該承擔個人責任,全心全意地遵循給定的方案,以幫助減緩這種現象的傳播。
病毒對人類有一些益處。
•病毒可以幫助我們瞭解細胞機制。
•病毒攻擊有害昆蟲和細菌。
•病毒也為基因治療提供了希望。基因治療是將外源 DNA 匯入細胞的過程。理論上,可以獲取空病毒(其致病基因組已被去除),將其裝載特定 DNA,透過 PCR 擴增病毒,以獲得特定蛋白質,該蛋白質可以靶向特定細胞上的受體,並使其將 DNA 注入細胞。例如,囊性纖維化是由於缺乏 CFTR 引起的,因此理論上可以將裝載 CFTR DNA 的空病毒,用特定肺受體標記,然後注射到宿主體內。然而,在現實中,這很難做到。此外,病毒具有相對較高的轉染率。換句話說,它們能夠以高效率將遺傳物質成功地傳遞到宿主細胞中,並且比傳統方法造成的併發症更少,傳統方法往往會導致不必要的細胞死亡。
流感病毒是一種負義單鏈 RNA 病毒。兩種型別對人類構成最大威脅:A 型和 B 型。它有八條 RNA 鏈,編碼 11 個不同的基因。這些基因隨後被翻譯成許多不同的蛋白質,但兩種主要的病毒蛋白是
•血凝素 (HA),存在 16 種不同的抗原血凝素存在於病毒蛋白的表面,並與糖結合。
•神經氨酸酶 (NA),存在 9 種不同的抗原神經氨酸酶(唾液酸酶)切割寡糖鏈,釋放病毒的後代去感染其他細胞。這種病毒蛋白已成為抗流感治療的目標。神經氨酸酶抑制劑,包括扎那米韋和奧司他韋(兩種抗流感藥物),是底物的不同結構類似物,試圖與病毒的神經氨酸酶結合位點結合,以阻止其與實際的細胞受體結合。已發現 10 種不同形式的神經氨酸酶,其中 9 種被稱為“N1、N2、N3、...、N9”,用於 A 型流感,而“B 型神經氨酸酶”用於 B 型流感。雖然 A 型和 B 型的神經氨酸酶催化機制基本相同,但蛋白質其他區域中氨基酸序列的差異導致每種蛋白質對各種神經氨酸酶抑制劑的反應略有不同。
目前對神經氨酸酶抑制劑的研究發現,許多現有抑制劑的類似物優先與 A 型流感結合,而不是 B 型流感,使其成為抑制劑的糟糕選擇。這些導致抑制劑優先選擇 A 型的改變包括 Neu5Ac2en 中醯胺鏈的類似物。
A 型流感中的 N1、N4 和 N8 亞型的神經氨酸酶比較特殊,因為它們在結合位點內包含一個額外的亞位點。負責此的氨基酸序列尚未確定。此外,尚未發現與該額外亞位點相關的任何生物學功能。
HA 是一種病毒蛋白,它與宿主細胞結合以進入。它指定哪些細胞可以被感染。NA 是一種病毒蛋白,它透過切割 HA/宿主細胞相互作用來負責病毒釋放。
流感病毒株包含 HA 和 NA 的不同組合,以及其他病毒蛋白。
許多人越來越擔心不同流感病毒株的致命性。例如,禽流感、豬流感和普通流感。
•禽流感 (H5N1):這種病毒株不容易感染人類,也不容易傳播。在過去的五年裡,只有 400 例病例,但有 262 人死亡,這意味著 H5N1 的死亡率約為 65%(2009 年 11 月)。H5N1 靶向肺部,雖然目前來說,這並不是許多人需要擔心的事情,但如果這種病毒株發生變異,能夠在人與人之間傳播,它將成為一個非常嚴重的問題。
•豬流感 (H1N1):這種病毒株與 H5N1 不同,它很容易感染人類,也可以輕鬆傳播。據估計,病例數在 1400 萬到 3400 萬之間,死亡人數約為 2500 到 6000 人,這意味著 H1N1 的死亡率不到 0.01%(2009 年 11 月)。這表明 H1N1 的毒性並不強,這對人類來說非常有利。然而,如果這種病毒株發生變異,變得具有毒性,它將成為一個非常嚴重的問題。
•普通流感:普通流感每年都在不斷變異,據估計每年有 2500 萬到 5000 萬例病例,死亡人數約為 3 萬到 4 萬人。
當 Neu5Ac2en 類似物與神經氨酸酶抑制劑耐藥流感病毒一起培養時,血凝素受體結合位點的脫靶突變發生了。這揭示了神經氨酸酶的破壞效率和血凝素對受體的親和力之間的平衡。
對神經氨酸酶的催化位點變體進行了實驗。其中一種醯胺類似物選擇了一種耐藥病毒,該病毒在三個精氨酸殘基之一 R292 中發生突變。相同的突變是所有神經氨酸酶的已知特徵。透過替換為 K292 可以實現酶活性的喪失,但對 Neu5Ac2en 的醯胺類似物的結合能力也會大幅下降。已證明 E276 會改變與 R292K 變體結合的醯胺的構象,以允許疏水口袋結合。E276 和 R224 的相互作用形成了疏水結合口袋,但耐藥性來自 R292K 變體。耐藥性是 E276 和 K292 之間的氫鍵,在非配體結合 R292K 變體的晶體結構中觀察到。
抑制劑越不像底物,針對 R292K N9 神經氨酸酶抑制劑的抑制能力損失就越大,包括:Neu5Ac、Neu5Ac2en、4-氨基-Neu5Ac2en、扎那米韋、Neu5Ac2en 醯胺和奧司他韋羧酸鹽。這一發現支援了以下規則:藥物越像天然底物/配體,它們就越能有效地抑制耐藥病毒。為了抑制耐藥病毒,需要對突變體的抑制活性最小程度地降低,以及突變體的生物活性。耐藥病毒必須保持其結合能力,才能處理天然底物或與底物類似的藥物。
儘管這些體外實驗很有用且具有教育意義,但感染患者的藥物治療可能與這些研究大不相同。不同的劑量和服用方法會導致感染部位的藥物水平不同。扎那米韋和奧司他韋的比較就是一個很好的例子。
噬菌體是感染細菌的病毒。一個很好的例子是 T2 噬菌體,它感染大腸桿菌。T2 和 T4 噬菌體具有帶針狀尾巴的衣殼,可以將自己的基因組插入宿主細胞,在那裡它可以指導複製後代病毒。新形成的病毒可以透過稱為裂解的常見現象逃離宿主細胞。裂解發生的位置可以透過噬菌斑的形成顯著地觀察到,噬菌斑是一個被大量細菌細胞包圍的透明斑點。單個噬菌體粒子裂解宿主細胞,然後感染附近的細胞,從而形成噬菌斑。
噬菌體生命週期
為了開始其生命週期,噬菌體必須找到一個宿主,將其附著到其表面。細胞表面受體,一種存在於宿主細胞表面,並且特定於病毒成分的蛋白質,適當地介導噬菌體與宿主細胞的附著和接觸。
細胞表面受體對宿主細胞起著重要作用,但病毒已經發生突變和進化,利用了這些受體。以λ噬菌體為例。大腸桿菌擁有一種叫做“λ受體蛋白”的蛋白質,它允許細菌獲取麥芽糖用於代謝。然而,λ噬菌體對大腸桿菌外膜中的麥芽糖孔蛋白具有特異性受容性。雖然這對宿主細菌不利,但自然選擇出於代謝原因保留了這種孔蛋白。
當噬菌體基因組插入宿主細胞時,它指示宿主產生後代噬菌體。阿爾弗雷德·赫希和瑪格麗特·蔡斯在 1952 年透過實驗證明了這一點,他們透過實驗表明,當他們將噬菌體中的 DNA 轉移到宿主細胞中時,會導致後代噬菌體的產生。1950 年,安德烈·勒沃夫和安妮特·古特曼觀察到,噬菌體基因組可以整合到宿主細菌的基因組中。大多數噬菌體只將它們的基因組插入宿主細胞,透過細胞壁,而不需要整個衣殼穿透細胞壁。例如,T4 表現出這種行為。這種病毒體有一個頸管,可以收縮並將它的 DNA 透過細胞表面插入宿主細胞的 DNA。
噬菌體可以經歷兩種主要的迴圈:裂解迴圈和溶原迴圈。在裂解迴圈中,噬菌體在插入 DNA 後直接指導其後代的生產。該過程包括複製噬菌體基因組和表達噬菌體 mRNA 以生產酶和衣殼蛋白。在一些噬菌體中,例如 T4,宿主 DNA 被消化,從而提高噬菌體生產的效率。在大量子代噬菌體產生後,它會繼續進行宿主細胞裂解,然後釋放噬菌體。裂解通常被稱為爆發,釋放的病毒子代數量稱為爆發大小。
在溶原迴圈中,噬菌體將 DNA 插入宿主細胞,但將其自身的基因組整合到宿主細胞的基因組中。λ 噬菌體具有雙鏈 DNA 的線性基因組,在進入宿主細胞後會將 DNA 重塑為環狀。然後,環狀 DNA 可以透過 DNA 的位點特異性重組整合到宿主基因組中。在這種重組中,重組酶將噬菌體 DNA 與宿主 DNA 對齊,以便磷酸二酯骨架連線可以交換,從而導致整合。
整合允許噬菌體基因組隨著宿主細胞的複製而複製。宿主 DNA 中的噬菌體基因組稱為前噬菌體。溶原不僅將噬菌體基因組整合到宿主基因組中,而且還可以自發地產生噬菌體的裂解爆發。前噬菌體透過噬菌體基因組兩端之間的位點特異性重組的分子內過程指導其自身從宿主基因組中移除,再次交換磷酸二酯骨架連線。當切除的 DNA 退出宿主基因組時,它會環化並開始裂解迴圈,從而破壞宿主細胞並釋放子代噬菌體。
噬菌體也可以經歷一個不太突出的迴圈,稱為慢釋放迴圈,由絲狀噬菌體(如 M13 噬菌體)執行。在這個特定的迴圈中,噬菌體顆粒在宿主細胞不裂解的情況下複製。M13 的單鏈環狀 DNA 作為合成雙鏈中間體的模板鏈。然後,這種中間體產生被衣殼蛋白包被和超螺旋的單鏈子代基因組。這些子代噬菌體透過宿主細胞包膜強行排出,而不會裂解細胞。宿主細胞繼續繁殖,但速度更慢,因為大部分資源用於病毒的生產。
結合 DNA 並抑制病毒複製轉錄的蛋白質決定了是進行裂解還是溶原。從溶原到裂解的轉變可以隨機發生,但也會受到環境因素(如紫外線)的影響,紫外線會破壞細胞的 DNA。至於環境線索,如果宿主細胞的生長非常強,則更常見的是看到噬菌體 DNA 不活躍,而威脅到細胞生存的事件將啟動裂解噬菌體。
病毒轉移宿主基因
在退出溶原階段期間,噬菌體可以獲得宿主基因並將其傳遞給另一個宿主細胞,這種事件稱為轉導。有時,整個噬菌體基因組可以被宿主基因組永久取代幷包裝到衣殼中,這將只能轉移宿主 DNA。
所有病毒都具有病毒衣殼。病毒衣殼是外套和基因組。但是,只有某些病毒具有包膜。包膜由脂質組成,本質上與細胞的質膜相同;它們相似是因為包膜實際上來自宿主質膜。因此,包膜具有透過退出宿主獲得的宿主和病毒蛋白:病毒不能在細胞內部執行任何操作,因此它們必須出去感染更多細胞。它們通過出芽並帶走一部分宿主質膜來做到這一點。病毒的目標是複製其基因組並製造蛋白質;然而,真正的目標是製造更多病毒,病毒透過感染宿主細胞並在宿主細胞內工作來做到這一點。首先,病毒需要弄清楚它可以進入哪些型別的細胞。病毒衣殼和包膜蛋白定義了宿主/病毒特異性:在衣殼中,有特定的蛋白質將與宿主細胞膜上的特定蛋白質相互作用。這就是鎖和鑰匙機制,其中只有某些病毒會識別某些宿主細胞。宿主細胞範圍是病毒可以感染的細胞型別,病毒具有有限的宿主細胞範圍:病毒只能感染特定的細胞,而不能感染體內的所有細胞,宿主細胞範圍由鎖和鑰匙機制定義。病毒透過胞吞作用(如內共生假說)或透過基因組注射進入宿主細胞,其中只有基因組被注射到細胞中(整個病毒不需要進入細胞,因為它只需要基因組)。胞吞作用和基因組注射都依賴於鎖和鑰匙機制來決定哪些病毒可以進入。
在這個迴圈中,病毒進入宿主細胞,複製其基因組,製造蛋白質,然後透過將它剛剛生產的片段組裝在一起來組裝新的病毒。最終,病毒會導致宿主細胞破裂,這意味著裂解生命週期會導致細胞死亡和非包膜病毒。在這個迴圈中的所有事情都儘可能快地完成,然後病毒繼續感染其他細胞。

這個迴圈不會導致細胞立即死亡。病毒進入細胞,並將其實際的基因組插入宿主細胞的基因組中。然後,當宿主細胞基因組複製時,病毒基因組也會隨之複製。然後,當有東西發出訊號讓病毒複製時,病毒進入裂解生命週期。溶原生命週期包括裂解生命週期。
這種型別的病毒可以經歷裂解或溶原生命週期,但結局不同。組裝完成後,病毒開始從細胞中出芽。它們不會立即殺死細胞,而是會帶走宿主細胞質膜的一部分。因此,包膜病毒包含許多與宿主細胞相似的蛋白質和脂質,這意味著免疫系統難以檢測到它們。另一方面,非包膜病毒更容易被發現,因為它們被視為外來物質。此外,一些病毒特徵使它們可以被識別為外來物質:它們的雙鏈 RNA(我們體內沒有雙鏈 RNA)和病毒蛋白,如 RNA 複製酶和逆轉錄酶(它們也是細胞的外來物質)。儘管如此,病毒不像細菌那樣容易被檢測到:細菌獨自漂浮,使它們更容易被更快地檢測到,而病毒則隱藏在我們的體細胞內。
病毒主要使用兩種方法來包裝其基因組
- 在病毒基因組周圍構建衣殼
- 先構建衣殼,然後將基因組包裝到衣殼中;通常需要使用馬達蛋白
在包裝自己的病毒基因組之前,必須有一個過程可以幫助病毒區分其自身的基因組與其宿主基因組;這個過程被稱為起始。有幾種方法可以啟動包裝
- 未分段 RNA
- 衣殼具有與 RNA 或 DNA 的特定序列互補的結合位點
- 分段 RNA
- 片段具有與其他片段互補的序列
- 衣殼具有多個結合位點,可以識別不同片段上的不同序列
- DNA
不同的病毒具有不同的基因組型別(dsDNA、dsRNA、ssDNA、ssRNA),以及不同的馬達蛋白。不出所料,它們的包裝機制彼此不同。
- 存在於Φ6和Φ12等dsRNA病毒中
- 多亞基
- 除了包裝基因組之外還有許多其他功能
P4 ATPase是一種六聚體分子,具有一箇中心通道,該通道由環和螺旋[3]。其中一些環具有磷酸鹽結合位點。ATP將結合到這些位點,導致中心通道內的構象發生變化。這種構象變化被認為是RNA易位的原因。即使包裝完成,P4 ATPase也會保留在最終的病毒體中。
- 相對強大;已知最強大的分子馬達是T4
- 產生高達60皮牛頓的力
- 以700bp/s的速度包裝DNA
用於包裝DNA基因組的馬達蛋白必須比典型的RNA馬達蛋白更強大,因為DNA基因組具有高密度,這會導致衣殼中的高壓(60 atm)。與P4 ATPase不同,DNA馬達蛋白在包裝完成後會解離。
最早研究的馬達蛋白組分之一是Φ29的gp10門蛋白。它嵌入衣殼中,其結構被確定為類似於漏斗;小端朝向衣殼外,而大端朝向衣殼內部。它的中心通道襯有α-螺旋,這些α-螺旋帶負電荷[4]。這使得DNA分子很容易透過,因為它們本身帶負電荷。據預測,門戶將利用ATP水解產生的能量旋轉,從而將DNA轉運到衣殼中。冷凍電鏡發現衣殼上的一些結構支援了這一理論;然而熒光光譜實驗沒有檢測到門戶的任何旋轉。因此,這種機制被認為不太可能。
此外,鳥槍法(也稱為鳥槍克隆)是克隆基因組DNA的一種方法。它涉及將要克隆的DNA使用限制性內切酶切割,或者使用物理方法隨機粉碎DNA,將其切割成小片段。然後將這些片段一起克隆到載體中。原始DNA可以是基因組DNA(全基因組鳥槍克隆),也可以是克隆體,例如YAC(酵母人工染色體),它包含需要被分割成片段的大段基因組DNA。
如果DNA需要在特定的克隆載體中,但載體只能攜帶少量DNA,那麼可以使用鳥槍法。更常見的是,該方法用於生成用於測序的DNA小片段。每次可以生成大約600個鹼基的DNA序列,因此如果克隆了大約1100kb的DNA片段,那麼它可以在兩個步驟中被測序,每個末端600個鹼基,以及100個鹼基的重疊。測序總是可以用載體中的已知序列進行引物,因此不需要事先了解克隆的序列。這種鳥槍克隆後從載體兩端進行DNA測序的方法稱為鳥槍測序。
HIV病毒是一種叫做慢病毒的逆轉錄病毒。它感染人類免疫系統中的重要細胞,並導致艾滋病(獲得性免疫缺陷綜合徵),這將逐步降低人類的免疫系統。HIV病毒很難抵禦,因為它有幾個防禦機制,包括:碳水化合物掩蔽和構象變化。患者患上危及生命的感染和癌症的風險很高。HIV與其他慢病毒一樣,以單鏈、正鏈、包膜RNA病毒的形式傳播。與其他逆轉錄病毒不同,HIV大約是球形的,直徑為120 nm。它包含兩份正鏈單鏈RNA。RNA與核衣殼蛋白緊密結合,以及病毒發育所需的酶。HIV有兩種型別,1)HIV-1和2)HIV-2。HIV-1是世界上大多數HIV感染的原因,因為它有毒,更容易感染其他人。它會導致CD4+T細胞計數逐漸減少。HIV-2是透過接觸感染的。HIV病毒整合到宿主細胞中並處於潛伏狀態,無法被免疫系統檢測到。有四種主要的HIV病毒傳播途徑:不安全的性行為、被汙染的針頭、母乳和母嬰傳播。
有些人即使接觸了HIV,也不會患上艾滋病,因為科學家發現他們攜帶了一種罕見的遺傳變異,該變異具有略微不同的核苷酸序列,可以保護人們免受艾滋病。它被稱為CCR5。這種罕見基因被認為是在進化過程中被選擇的,因為它使人們對與HIV無關的生物體產生了抗性。
HIV病毒進入人體系統和實際患上相關疾病(艾滋病)之間的時間是一個非常重要的因素。在這段時間內,人類免疫系統會逐漸變弱,因為免疫系統受到損害。事實上,有些人接觸到的病毒(甚至普通感冒病毒)實際上充當了HIV病毒的輔助因子。然而,要充當輔助因子,另一種病毒必須具有某些特徵。首先,另一種病毒應該能夠感染HIV感染的相同細胞。其次,同時感染的細胞數量必須足夠大,才能改變HIV病毒的正常機制。許多病毒被認為是HIV病毒的輔助因子,但沒有滿足上面列出的第一個標準。
此外,HIV病毒通常喜歡感染CD4+T細胞。這些細胞中的許多都位於淋巴結中,因此HIV病毒通常也可以在淋巴結中找到。HIV病毒通常可以在體內任何CD4+細胞豐富的部位找到。這包括腺樣體、巨噬細胞和扁桃體等部位。
為了研製出一種有效的抗HIV病毒疫苗,人們付出了很多努力。在能夠研製出疫苗之前,必須檢查傳播方式。這種病毒可以透過四種不同的方式傳播。最明顯的方式是性傳播。其他感染途徑包括吸毒者共用針頭、母嬰傳播以及使用受感染的血液或血液製品。目前已經提出了一些針對HIV的疫苗,並且現在正處於臨床試驗階段。然而,在人體志願者中使用此類疫苗存在著大量的倫理和社會問題。一個擔憂是,如果疫苗混合物中的病毒失控,對人類生命的明顯威脅。另一個安全問題是,大量生產逆轉錄病毒對實驗室工作人員和公眾來說都是危險的。
HIV免疫
APOBEC是一種在動物中進化上保守的蛋白質,用於從mRNA製造多種蛋白質。APOBEC3G屬於同一家族的保守蛋白,但只存在於人類中。據說是抗病毒免疫中重要的角色,特別是針對逆轉錄病毒,如HIV,目前正在研究中。這種對稱蛋白,具有兩個同源催化序列,已知會干擾HIV逆轉錄活性,使其無法整合到宿主染色體中。通常,在沒有APOBEC3G的情況下,一種叫做tRNA3Lys的tRNA會結合到HIV-1的引物結合位點,啟動逆轉錄過程。但是,當APOBEC3G存在時,它可以阻止引物結合位點,從而阻止逆轉錄酶製造單鏈DNA,最終制造雙鏈DNA。
然而,有一種叫做病毒感染因子(Vif)的蛋白質,它來自HIV病毒,正在被研究,因為它對APOBEC3G有對抗作用。已知Vif會攻擊APOBEC3G並將其失活。回到APOBEC3G的功能,在沒有Vif的情況下,APOBEC3G可以催化反向鏈指令碼中的dC到dU突變,導致子指令碼中出現多個複製錯誤。這些是錯義和無義密碼子,最終會被複制。
來源:APOBEC3G:防禦中的雙重間諜 Harold C. Smith 紐約羅切斯特大學醫學院和牙科學院生物化學和生物物理學系以及RNA生物學中心,紐約州羅切斯特 14642 USA
1. Berg, Jeremy "Biochemistry, 6th Edition" 2007 2. "Microbiology: an evolving science" by Joan L. Slonczewski and John W. Foster.
3. “病毒蛋白是否具有獨特的生物物理特徵?”,作者 Nobuhiko Tokuriki1、Christopher J. Oldfield、Vladimir N. Uversky、Igor N. Berezovsky 和 Dan S. Tawfik。4. “生物學”,作者 Neil A. Campbell 和 Jane B. Reece。
5. Colman,Peter M. “新型抗病毒藥物和耐藥性”。
- ^ Sun,Siyang、Venigalla B. Rao 和 Nathan Nelson。“病毒的基因組包裝”,《結構生物學現狀》(Current Opinion in Structural Biology),2010 年第 20 卷,第 114-120 頁。Pubmed。網路。2010 年 11 月 19 日。
Sun, Siyang; Rao, Venigalla B.; Rossman, Michael G. (2010), "病毒的基因組包裝", 結構生物學現狀, doi:10.1016/j.sbi.2009.12.006, PMID 20060706 {{citation}}: 未知引數 |acess date= 被忽略 (|access-date= 建議) (幫助)
Colman, Peter (2009), "新型抗病毒藥物和耐藥性", 生物化學年度評論, PMID 19254207 {{citation}}: 未知引數 |acess date= 被忽略 (|access-date= 建議) (幫助)
6. 新遺傳學 - 美國衛生與公眾服務部
7. Colman,Peter M.,“新型抗病毒藥物和耐藥性”,沃爾特和伊麗莎醫學研究所,10.1146/annurev.biochem.78.082207.084029,2009 年 3 月,第 95-112 頁。
8. Lever,A.M.L. “HIV/AIDS 的分子生物學”。John Wiley & Sons。英國劍橋大學臨床醫學院。1996 年。