結構生物化學/細胞訊號通路/胰島素訊號
胰島素是由胰腺β細胞在血液中營養物質水平升高時釋放的一種激素。胰島素使肝臟、肌肉和脂肪組織中的細胞從血液中攝取葡萄糖,促進這些營養物質以肝糖原的形式儲存在肝臟和肌肉中,並停止使用脂肪作為能量來源。當無法控制胰島素水平時,會導致糖尿病。1型糖尿病患者的特點是無法體內產生該激素,而2型糖尿病患者則對胰島素的作用產生抵抗,這可能是由於無法控制血糖水平造成的。作為一種肽類激素,胰島素由 51 個氨基酸組成,分子量為 5808Da。胰島素在胰腺的胰島中產生,其名稱來源於拉丁語 insula,意為“島嶼”。

胰島素的受體是跨越細胞膜的兩個相同亞基的二聚體。每個亞基由一個α鏈和一個β鏈組成,透過單個二硫鍵連線在一起。α鏈位於細胞膜的外側,而β鏈跨越細胞膜,只有一個片段,除該片段外,位於細胞膜的內側。[1]
當檢測到胰島素時,細胞外部的兩個α鏈會移動在一起,並圍繞胰島素摺疊。該動作將β鏈移動在一起,從而使β鏈成為一個活躍的酪氨酸激酶。酪氨酸激酶催化磷酸基團從 ATP 轉移到β鏈啟用環中的酪氨酸。磷酸化的啟用環隨後會發生巨大的構象變化,導致激酶完全啟用。[2]
胰島素受體底物是一組特殊的蛋白質,它們被吸引到啟用的胰島素受體上的磷酸化位點。這些位點充當 IRS 蛋白的對接點。每個 IRS 分子都有四個序列,這些序列近似為 Tyr-X-X-Met。這種重複出現的序列是 IRS 分子對受體酪氨酸激酶的親和力的原因。然後,酪氨酸激酶會磷酸化這些酪氨酸,導致 IRS 分子啟用。啟用的 IRS 蛋白充當銜接蛋白。銜接蛋白將激酶與其底物結合在一起,而不是啟用激酶。例如,啟用的 IRS 蛋白結合到脂類激酶,從而將脂類激酶吸引到脂類膜,即其底物。[3]
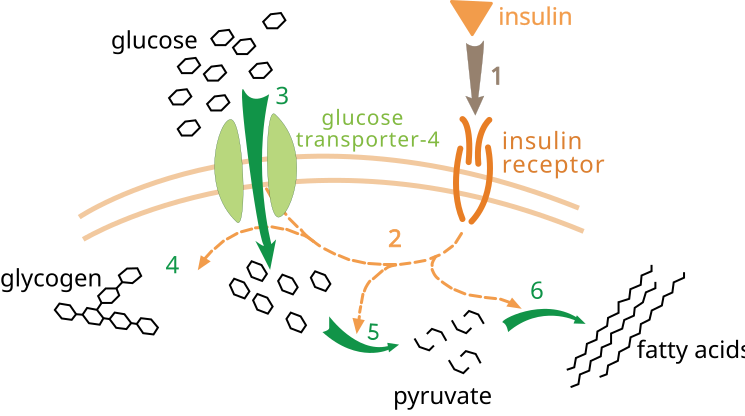
SH2 是存在於許多訊號轉導蛋白中的一個結構域。SH2 結構域是特定磷酸酪氨酸序列的宿主,例如啟用的 IRS 蛋白中的那些序列。這是一個特定過程,因此每個 SH2 結構域都對包括磷酸酪氨酸的近似序列具有結合偏好。一大類脂類激酶具有被吸引到 IRS 蛋白的 SH2 結構域。這些脂類激酶在磷脂醯肌醇 4,5-二磷酸 (PIP2) 中的肌醇的 3 位反應,並新增一個磷酸基團。透過將脂類激酶吸引到 IRS 蛋白,反應將激酶移動到位於膜上的 PIP2,在那裡它可以將它們磷酸化為磷脂醯肌醇 3,4,5-三磷酸 (PIP3)。這會導致級聯反應,啟用蛋白激酶 PDK1,PDK1 磷酸化蛋白激酶 Akt,從而也啟用它。Akt 是細胞質中一個自由移動的激酶,它在細胞內磷酸化靶標,例如控制 GLUT4(一種葡萄糖轉運蛋白)移動的蛋白質,將其帶到細胞表面。這只是許多以胰島素受體啟用 IRS 為起點通路的其中之一。[4]
胰島素受體的磷酸化啟動了一系列蛋白質的絲氨酸-蘇氨酸磷酸化。它們與 3 個額外的蛋白激酶訊號系統相連。蛋白激酶訊號系統包括:1) 透過 PI3-激酶和磷脂醯肌醇 (3,4,5)P3(PI-3 激酶和蛋白激酶 B/Akt)進行訊號傳導的通路,2) 絲裂原活化蛋白激酶 (MAPKinases),3) 可能透過未與 IRS 蛋白偶聯的激酶進行的相互作用。
•葡萄糖儲存和攝取
胰島素與 a 亞基結合,並改變構象,導致酪氨酸殘基的自磷酸化。這些殘基隨後被磷酸酪氨酸結合域(稱為 PTB)識別,例如胰島素受體底物、SHC 和 Cbl。啟用的受體磷酸化受體上的酪氨酸殘基。這些受體透過其 SH2 域與訊號分子相互作用,並激活許多其他通路,例如 PI 3-激酶訊號通路、MAPK 啟用和 Cbl/CAP 複合物啟用。這些通路的結果是調節葡萄糖、脂類和蛋白質代謝。
•蛋白質合成
胰島素刺激氨基酸進入細胞的攝取,阻止蛋白質降解並促進蛋白質合成。
•脂類合成調節
胰島素刺激脂肪酸的攝取和脂類合成,並抑制脂解。脂類合成需要大量的轉錄因子類固醇調節元件結合蛋白 (SERBP)-1c。胰島素透過啟用脂肪細胞中的 cAMP 特異性磷酸二酯酶來降低 cAMP 濃度,從而抑制脂解、脂類代謝。
•有絲分裂反應
胰島素受體的另一個底物是 SHC。SHC 的磷酸化與 GRB2 有關,GRB2 可以獨立於胰島素受體底物啟用 MAPK 通路。其他訊號轉導蛋白與 GRB2(一種含有 SH3 結構域的胰島素受體底物)相互作用,該結構域與鳥嘌呤核苷酸交換因子 son-of sevenless 有關,並促進 MAPK 通路的啟用,然後達到有絲分裂反應。
- ↑ Berg, Jeremy (2007). 生物化學,第 6 版. 紐約,紐約:薩拉·特尼。第 392-393 頁。 ISBN 978-0-7167-8724-2.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Berg,Jeremy (2007)。生物化學,第 6 版。紐約,紐約:Sara Tenney。第 392–393 頁。ISBN 978-0-7167-8724-2.
{{cite book}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助) - ↑ Berg,Jeremy (2007)。生物化學,第 6 版。紐約,紐約:Sara Tenney。第 393–394 頁。ISBN 978-0-7167-8724-2.
{{cite book}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助) - ↑ Berg,Jeremy (2007)。生物化學,第 6 版。紐約,紐約:Sara Tenney。第 394–395 頁。ISBN 978-0-7167-8724-2.
{{cite book}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助)
http://www.abcam.com/index.html?pageconfig=resource&rid=10602&pid=7