結構生物化學/細胞訊號通路/激酶抑制劑
細胞中的訊號轉導在細胞代謝、分割、分化、生物行為和細胞死亡過程中佔據重要地位。激酶抑制劑用於抑制特定受體,阻斷訊號轉導,導致病變細胞死亡。
大多數蛋白質激酶抑制劑是在過去 10 年中發現的,用於治療癌症和炎症性疾病,其中大多數是多靶點激酶抑制劑,可以同時抑制激酶的多個位點,更有效地阻斷訊號轉導。
蛋白質激酶抑制劑有三種類型
I 型 - 一種小分子,與激酶 ATP 口袋的活性構象結合。
II 型 - 一種小分子,與激酶 ATP 口袋的非活性構象結合。
III 型 - 一種非 ATP 競爭性激酶抑制劑。
化療一直是過去幾十年中主要的醫學進步之一。然而,用於這種治療的藥物治療指數狹窄,而且通常產生的結果僅具有姑息作用,而且不可預測。相比之下,近年來引入的靶向治療針對癌症特異性分子和訊號通路,因此非特異性毒性更低。酪氨酸激酶是一個特別重要的靶點,因為它們在調節生長因子訊號傳導中起著重要作用。
細胞生長和細胞週期通路在癌細胞中持續啟用。激酶/磷酸酶酶發揮的標準控制作用不再起作用。癌細胞的主要特徵是它們在不存在生長因子等外部訊號的情況下複製的能力。
生長因子參與細胞週期的啟動和調節。生長因子的型別決定了它對細胞的影響。與酪氨酸激酶相關的三個主要生長因子。這些生長因子的受體是受體酪氨酸激酶家族的成員。表皮生長因子 (EGF) 有助於調節細胞生長和分化。血小板衍生生長因子 (PDGF) 調節細胞生長和發育。血管內皮生長因子 (VEGFR) 參與血管的形成。
酪氨酸激酶抑制劑 (TKI) 是一類化療藥物,可抑制或阻斷酪氨酸激酶。TKI 是從現代遺傳學中發展而來的——對 DNA、細胞週期和分子訊號通路瞭解的——因此代表了從一般癌症治療方法向分子方法的轉變。這允許對特定癌症進行靶向治療,從而降低對健康細胞造成損害的風險並提高治療成功率。
科學研究正在集中於酪氨酸激酶抑制劑,因為它們與以前的方法相比具有獨特的特性。所有化療藥物都旨在停止細胞分裂和生長。它們還試圖在不破壞健康細胞的情況下殺死癌細胞。癌細胞的固有弱點是細胞修復機制的失效是導致細胞癌變的原因。因此,細胞無法有效地修復受損或改變的 DNA。
對有絲分裂細胞週期至關重要的多方面激酶包括 BUB1 和 BUBR1。它們主要以其構建紡錘體組裝檢查點的能力而聞名。透過這樣做,蛋白質激酶 BUB1 和 BUBR1 的存在有助於透過減緩後期開始直到染色體在有絲分裂紡錘體上雙向定向來確保染色體分離的高保真度。儘管兩種蛋白質激酶在有絲分裂週期中都是必不可少的,但它們在紡錘體組裝檢查點 (SAC) 中發揮著不同的功能。
BUB1 對染色體聚合和維持與紡錘體微管的雙極附著穩定性至關重要。如果去除這種蛋白質激酶,染色體錯誤分離的速率會增加,並且染色體可能生長緩慢,而極端情況包括染色體完全喪失。BUBR1 與未附著的著絲粒高度相關,併為染色體排列中著絲粒-微管附著提供穩定性。此外,BUBR1 監測前期 I 阻滯,這對於減數分裂 I 中產生可受精卵至關重要。在這樣做的時候,它會積累到會產生未修復的 DNA 雙鏈斷裂的染色單體。
人類 BUBR1 和 BUB1 序列中存在許多與癌症相關的突變。BUB1 和 BUBR1 在癌細胞突變中也發揮著非常重要的功能。染色體不穩定和癌症與 BUB1 和 BUBR1 序列的存在有關。BUB1 在致癌作用中起著重要作用;BUB1 基因和蛋白質序列突變的變化可能會促進癌組織和細胞的生長。已發現 BUB1R1 序列中的突變與馬賽克斑駁非整倍體家族有關,換句話說,該綜合徵表現為小頭畸形和智力障礙。此外,胃癌進展已顯示出與過量的 BUBR1 表達有很大關係。BUB1 和 BUBR1 序列中的這些突變導致了癌症治療的發展。事實上,最近的研究發現 BUBR1 可以用作各種人類癌症生存不足的表達標誌。蛋白質激酶導致有絲分裂檢查點功能受損。研究還表明,削弱 SAC 有利於與抗癌治療相關的細胞存活。
自上世紀 80 年代以來,抗癌研究的關鍵點從抑制 DNA 合成轉移到抑制激酶的催化活性。以下抗癌藥物已在臨床應用中。

伊馬替尼由諾華公司在 1990 年代發現,並於 2001 年 5 月 10 日獲得 FDA 批准。透過使用多個氫鍵,伊馬替尼佔據 ABL 蛋白激酶的 ATP 口袋,阻止 ATP 和 ABL 激酶的結合,從而抑制蛋白質激酶的活性並阻止下游訊號轉導。伊馬替尼用於治療慢性髓性白血病胃腸道間質瘤。伊馬替尼還可以抑制膜上的 PDGFR 激酶和 c-Kit 激酶。伊馬替尼對正常人體細胞沒有危害。
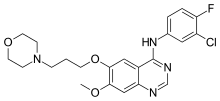
吉非替尼由阿斯利康公司發現,並於 2003 年 5 月 5 日獲得 FDA 批准。吉非替尼主要針對 EGFR,EGFR 屬於 HER 受體家族。在正常細胞中,EGFR 透過調節形成和分化的速度來幫助器官生長。然而,在癌細胞中,EGFR 過度表達。與伊馬替尼相比,吉非替尼的譜系相對較窄,這意味著吉非替尼比伊馬替尼更具選擇性。最近的研究證明,吉非替尼在非小細胞肺癌細胞中對 EGFR 的結合能力確實很高。

索拉非尼由拜耳公司發現,並於 2005 年 12 月 20 日獲得 FDA 批准。索拉非尼用於治療腎細胞癌和肝細胞癌。它利用氫鍵和範德華力來抑制 RAF 激酶,佔據 RAF 的 ATP 口袋和疏水口袋。在這種情況下,B-RAF 激酶無法磷酸化,從而失去活性並抑制訊號轉導。

厄洛替尼由 OSI 公司發現,並於 2004 年 11 月 18 日獲得 FDA 批准。厄洛替尼是 EGFR-TK 的激酶抑制劑,屬於小分子化合物。厄洛替尼佔據 ErbB 的 ATP 口袋,阻止 ErbB 酪氨酸的磷酸化過程。厄洛替尼對 LOK、ABL、FLT 和 SLK 也有強效。厄洛替尼用於治療胰腺癌。

舒尼替尼(Sunitinib),由輝瑞公司發現,於2006年1月26日獲得美國食品藥品監督管理局(FDA)批准。舒尼替尼的發明過程實際上是將單一靶點轉移到多靶點的過程。與早期研發的其他化合物相比,舒尼替尼的長鏈結構提高了其溶解度。這可能是舒尼替尼的效果優於早期藥物的第二個原因。在激酶譜測定實驗中,舒尼替尼表現出廣泛的譜系水平,並能有效抑制激酶活性。舒尼替尼主要抑制VEGFR2、PDGFRs、FLT3和c-Kit蛋白激酶,控制三個下游訊號轉導途徑:PI-3K/AKT、Ras/Raf/MEK和PKCs。舒尼替尼用於治療患有腎細胞癌或伊馬替尼耐藥的胃腸道間質瘤的患者。

尼洛替尼(Nilotinib),由諾華公司發現,於2007年10月29日獲得美國食品藥品監督管理局(FDA)批准。尼洛替尼是對伊馬替尼的改進。與伊馬替尼類似,尼洛替尼利用多個氫鍵佔據ABL激酶的ATP結合口袋,阻止ATP與ABL的結合,抑制激酶活性,控制訊號轉導。尼洛替尼的不同之處在於它還可以與疏水性口袋反應,這可能是尼洛替尼比伊馬替尼能夠抑制更多異常ABL激酶的原因。尼洛替尼用於治療伊馬替尼耐藥的慢性髓性白血病。

拉帕替尼(Lapatinib),由葛蘭素史克公司發現,於2007年3月13日獲得美國食品藥品監督管理局(FDA)批准。人體EGFR家族中有四個不同的RTKs:EGFR、HER2、HER3和HER4。拉帕替尼同時抑制EGFR和HER2酪氨酸激酶。EGFR在頭頸部鱗狀細胞癌、非小細胞肺癌、結腸癌和乳腺癌中過表達。同時,它可能有助於分泌TGF-α,保持啟用訊號轉導。HER2也會導致訊號轉導增強,其過表達與女性乳腺癌有關。拉帕替尼的譜系水平較窄,但抑制激酶的活性比其他激酶抑制劑更強。拉帕替尼控制兩個訊號轉導途徑:Ras/Raf/MEK和PI-3K/Akt。拉帕替尼用於治療HER2+乳腺癌。

帕唑帕尼(Pazopanib)於2009年獲得美國食品藥品監督管理局(FDA)批准。帕唑帕尼是一種多靶點激酶抑制劑,它抑制VEGFR-1、VEGFR-2、VEGFR-3、VEGFR-α/β和C-KIT激酶,阻止訊號轉導,減緩腫瘤生長。帕唑帕尼用於治療晚期腎細胞癌。

達沙替尼(Dasatinib),由百時美施貴寶公司發現,於2006年6月8日獲得美國食品藥品監督管理局(FDA)批准。達沙替尼透過利用氫鍵與受體激酶結合,可以同時抑制多個靶點,包括ABL。在激酶譜測定實驗中,達沙替尼表現出非常廣泛的譜系水平,主要抑制DDR、EPHA、EPHB激酶受體家族。達沙替尼在整個藥物市場中抑制激酶的比例最高。在細胞訊號轉導過程中,達沙替尼抑制細胞膜上的TCR受體、細胞內的Src激酶和BCR-ABL酪氨酸的活性,從而阻止三個訊號轉導途徑:Ras/Raf/MEK、JAK/STAT和PI-3K/Akt,控制癌症的形成。達沙替尼用於治療慢性髓性白血病和費城染色體陽性急性淋巴細胞白血病。
Raf-MEK-ERK 通路
三級Raf-MEK-ERK是一個常見的胞質激酶級聯反應,由小GTP酶Ras的下游觸發,在細胞生成中起著至關重要的作用。對該通路中蛋白質-蛋白質相互作用的分析提供了有關該通路時間和空間調控的充分資訊。這種三級排列使累積訊號強度大幅度提高,並將時間調節所需的訊號多樣化,因為它在通路中向下傳遞。
在脊椎動物中發揮作用的其他MAPK級聯反應中,Raf-MERK-ERK通路是最早被引入的,並且仍然是最受關注的通路之一。通常,該通路透過在膜結合的小G蛋白Ras上發生GTP與GDP的交換,被下游生長因子受體所影響。與GTP結合的Ras會將激酶Raf招募到膜上,在那裡它被該複合物啟動。結果,Raf使MEK磷酸化,MEK是一種雙特異性激酶,它只靶向細胞外訊號調節激酶ERK。相反,ERK監測位於不同亞細胞位置的靶標——例如代謝酶、轉錄因子和結構蛋白。簡而言之,調節可以透過通路內組分與其他組分的直接結合來實現。這將導致蛋白質支架的形成和定位訊號的適應。
Raf-MEK-ERK二聚體的夥伴關係顯示出優點和缺點。二聚化是訊號轉導中的一個調節機制;在這種特殊情況下,它可以啟用激酶(如Raf),調節負反饋控制(如MEK),並允許同時與底物結合(如ERK)。Raf通路中的二聚化促進B-Raf與蛋白質支架KSR1、C-Raf或A-Raf的異二聚化。異二聚體含有高水平的MEK激酶活性,並代表MEK啟用單位。由ERK調節的B-Raf磷酸化會導致Raf異二聚體的解離,並阻止穩定的MEK1-MEK2異二聚體的重新結合。
參考文獻
文武,陸成,陳思宇,於聶芳“多靶點激酶抑制劑作為抗癌藥物的訊號轉導通路”
Arvin C. Dar1 和 Kevan M. Shokat,“從細胞訊號的拮抗劑到激動劑的蛋白激酶抑制劑的演變”
血管內皮生長因子刺激慢性淋巴細胞白血病細胞中蛋白激酶C{beta}II的表達 血 2010 年 6 月 3 日 115:4447-4454
