結構生物化學/細胞訊號通路/RAGE:模式識別受體
RAGE 是免疫系統中的一種核心訊號分子,參與炎症的持久和複雜反應。RAGE 也是糖基化產物的受體,並充當模式識別受體,識別共同特徵而不是特定配體。關於 RAGE 的細胞外結構的新資訊導致了這一發現。X 射線晶體學和核磁共振實驗程式表明,配體結合是由外域和配體之間的靜電相互作用驅動的,外域帶正電,而配體帶負電。
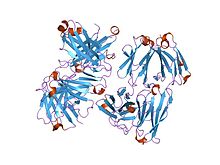
這種受體,RAGE,是細胞表面受體超家族的一部分,稱為免疫球蛋白 (Ig)。它是包括糖尿病、炎症、動脈粥樣硬化、神經退行性疾病甚至癌症在內的嚴重慢性疾病發展中的主要分子。健康動物的 RAGE 分子表達量很低,但隨著健康狀況或疾病的惡化,表達量會增加。RAGE 分子表達的增加也會增加附著在 RAGE 分子上的配體表達。RAGE 配體的例子包括 AGEs,它們是晚期糖基化終產物和 S100 蛋白家族的成員。AGEs 也是許多其他組的一部分,包括高遷移率族蛋白盒 1 (HMGB1)、β 澱粉樣蛋白和纖維蛋白聚集體。配體與 RAGE 受體的結合激活了各種訊號通路,這些通路依賴於配體、環境或細胞型別。這些通路可能是
- RAS-細胞外訊號調節激酶通路
- 應激啟用蛋白激酶通路
- p38 絲裂原活化蛋白 (MAP) 激酶通路
- cAMP 響應元件結合 (CREB) 蛋白
- 轉錄家族啟用 (STAT3)
當炎症反應正在進行時,RAGE-配體附著會導致 RAGE 分子表達增加。這是一種正反饋迴路,會導致 NF-κB 的持續啟用,NF-κB 是一種核轉錄因子,允許將正炎症反應轉化為慢性生理狀態。這種現象的研究人員意識到,為了防止 RAGE 分子抑制炎症反應,RAGE-配體和 RAGE 分子產生的正反饋迴路應該透過阻斷受體-配體相互作用位點來破壞。然而,這需要對 RAGE-配體相互作用機制有深入的瞭解。
X 射線晶體學和核磁共振波譜法使得能夠研究 RAGE 的結構以及 RAGE-配體識別的機制。RAGE 具有很大的正表面電荷,使其能夠為帶負電荷的配體建立靜電陷阱。RAGE 的分子組織在啟動配體相互作用的訊號中起著重要作用。透過研究熒游標記的受體,很明顯 RAGE 不以細胞質膜中的單一分子形式存在,而是收集在受體組裝體中。
RAGE 具有單個跨膜螺旋,將外域與短的胞質域連線起來,以及一個配體識別和結合所需的細胞外成分。這種細胞外成分具有三個類似免疫球蛋白 (Ig) 的結構域。N 端 Ig 結構域被分配給 Ig 樣分子的 V 集,被稱為 RAGE 的 V 結構域。另外兩個 Ig 結構域是 C1 和 C2 集的一部分。N 端 V 結構域位於遠離質膜的位置,但 C2 結構域位於靠近膜的位置。V 和 C1 結構域可以連線在一起形成一個細長的結構。V 和 C1 結構域可以固定併成為 VC1 結構域,可以通過幾個沒有二級結構的氨基酸連線到 C2 結構域,從而使 VC1 和 C2 結構域連線起來。核磁共振波譜研究表明,VC1 作為一個單位移動,並且可以與 C2 結構域結合。
V 結構域包含大量的精氨酸和賴氨酸,它們在中性 pH 值下帶有正電荷。RAGE V 結構域的精氨酸和賴氨酸含量比 Ig 結構域的 V 集要高。精氨酸和賴氨酸殘基在 V 和 C1 結構域的表面形成大的帶正電荷的區域。同時,C2 結構域在其表面主要具有酸性殘基,並且帶負電荷。由於這兩個結構域帶相反的電荷,RAGE 的細胞外成分被細分。這種細分反映在不同結構域的配體結合特性中,因為配體不會由於電荷排斥而與 C2 結合。大多數配體傾向於與 V 結構域或 VC1 結構域結合,因為配體帶負電荷。只有一個案例是配體與 C2 結構域結合。儘管如此,電荷-電荷相互作用對於受體-配體複合物的形成非常重要,並且表明 RAGE 分子的帶正電荷的配體結合域可以識別配體的負電荷的某些排列,並且可以識別這些排列作為配體的共同特徵。
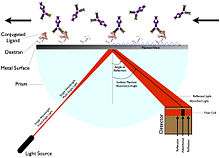
正電子發射斷層掃描 (體內) 和體外實驗使得能夠研究配體的結合。體外研究是透過監測 RAGE 配體的細胞反應以及蛋白質-蛋白質相互作用來進行的。結論是,RAGE-配體結合會導致細胞立即做出反應。當 RAGE 和配體之間的結合親和力高時,配體及其 RAGE 分子的訊號強度會增加。當訊號複合物被啟用更長時間時,訊號強度也會增加。配體結合過程有兩個階段。首先,解離階段揭示了訊號傳導能力複合物的壽命。在體外解離緩慢的配體可以誘導更長和更強烈的受體啟用。表面等離子共振 (SPR) 是一種觀察這些啟用的方法,因為它檢查了受體的即時相互作用,該受體可以被固定,以及可以結合的配體。可以觀察到結合的熱力學,包括 RAGE-配體吸引力的親和力以及解離的動力學。SPR 技術還發現,多聚體或由多個亞基組成的配體與其受體的結合時間更長。
Rage 配體非常多樣,並且具有共同特徵,可以啟用 RAGE 分子。以下是 RAGE 配體的例子
- AGEs (晚期糖基化終產物)
這些分子是異質的,來源於蛋白質、肽和糖的縮合和氧化。形成 AGE 的第一步是糖的醛基與來自賴氨酸或精氨酸氨基酸的胺基的反應。這是一個非特異性且非酶促的過程,稱為糖基化。當個體糖基化水平高且頻繁時,會導致糖尿病和其他併發症。AGEs 的氧化可以透過氨基的羧甲基化來增加配體上的整體負電荷。AGEs 和 RAGE 之間具有很高的親和力,並啟動了對促炎反應的高度耐受性。AGE 和 RAGE 的相互作用被認為是糖尿病併發症和心血管疾病的主要原因。
- S100 蛋白
該蛋白家族包含超過 25 個成員,每個成員都表現出不同的模式和功能。這些蛋白質很小且呈酸性,並且具有兩個由柔性環連線的不同鈣結合位點。S100 蛋白形成同二聚體,有時還形成異二聚體和寡聚體,例如四聚體和八聚體。S100 蛋白主要存在於脊椎動物中,並定位於細胞質中,充當鈣感測器。這些蛋白質可以表現出細胞內鈣訊號傳導和結合,導致 S100 蛋白構象和形狀發生改變。在細胞外空間,由於鈣濃度高,S100 蛋白會負載鈣,因此它們可以輕鬆地與 RAGE 結合。
- 澱粉樣蛋白 β 和澱粉樣蛋白纖維

阿爾茨海默病是由澱粉樣蛋白 β 肽的細胞外沉積引起的,而澱粉樣蛋白 β 肽源於澱粉樣蛋白前體蛋白的蛋白水解裂解。澱粉樣蛋白 β 肽包含 40 到 42 個氨基酸。這些肽具有酸性和疏水區域,容易積累澱粉樣蛋白纖維,這些纖維在腦中積聚形成澱粉樣斑塊,導致阿爾茨海默病。阿爾茨海默病的小鼠模型表明,RAGE 結合澱粉樣蛋白 β 並將其從血液中移動到中樞神經系統 (CNS) 的血腦屏障。體外分析表明,RAGE 和澱粉樣蛋白 β 對可溶性澱粉樣蛋白 β 肽具有高親和力。RAGE 也可以結合澱粉樣蛋白纖維。
- 高遷移率族蛋白 1 (HMGB1)

這種蛋白質具有細胞外調節功能,並充當促炎啟用劑。HMGB1 有三個結構域:兩個 N 末端結構域參與 DNA 結合,一個 C 末端結構域包含各種酸性氨基酸,並指導與 RAGE 分子的結合。HMBG1 結合 RAGE 和 Toll 樣受體 9 (TLR9),形成啟用 B 細胞的 HMGB1-RAGE-TLR9 複合物。DNA 可以與 RAGE 高親和力結合並形成穩定的複合物,而無需 HMGB1 蛋白,但 DNA-RAGE 相互作用尚未產生明顯的結果。
RAGE 可以識別不同配體中的共同特徵。RAGE 配體在其表面具有淨負電荷。它們通常也具有中性 pH 值,但 S100 蛋白具有酸性 pH 值。此外,AGE 通常在其表面不帶負電荷,直到它們在糖基化和氧化過程中發生轉化。大多數配體也發生寡聚化。AGE 修飾蛋白質,導致與較高摩爾質量分子的共價鍵。S100 蛋白也形成四聚體或八聚體的巨大組裝體。
Fritz, Gunter. RAGE: a single receptor fits multiple ligands. Trends Biochem Sci. 2011 Dec(12): 625-32. Epub2011 Oct19.
