結構生物化學/細胞訊號通路/轉化生長因子β
轉化生長因子β (TGFβ) 是一種小的細胞訊號蛋白分子(細胞因子),由神經系統的神經膠質細胞以及一些免疫系統細胞分泌。它們負責細胞增殖(細胞生長)、細胞分化、凋亡(細胞死亡)和細胞遷移。
TGFβ存在三種不同的亞型,即TGFβ-1, TGFβ-2和TGFβ-3。這三種形式的TGFβ由身體的許多不同細胞表達,同樣,身體中的大多數細胞也擁有TGFβ受體位點用於結合。
TGFβ總是以失活複合物的形式產生。為了使TGFβ能夠結合到其受體併發揮其功能,它必須被啟用。整合素,它充當細胞與其周圍組織之間的介質,實際上負責將失活的TGFβ複合物啟用為活性複合物。TGFβ以失活形式產生的原因是,其作用只在正確的時間和地點發生。活性TGFβ的功能是結合到其受體,這會導致訊號級聯,並導致基因轉錄的啟用或抑制[1]。這些通路及其調節的生化機制,由於其對人類健康的重要性以及在疾病中的作用而備受關注。對控制TGFβ啟用的整合素的進一步瞭解可能導致新的治療方法。此類有益療法的例子包括治療癌症,因為TGFβ在腫瘤形成過程中具有異常功能[1]。
三種TGFβ亞型中的每一種都包含一個25kDa的N端前肽,被稱為潛伏期相關肽(LAP),以及一個12.5 kDA的C端活性TGFβ。N端LAP和C端TGFβ由不同的基因編碼,它們共同形成一個同二聚體LAP- TGFβ前肽複合物。前肽是一個短序列,它決定了其相關蛋白的摺疊方式[3]。為了使TGFβ發揮功能,必須在高爾基體中裂解LAP和TGFβ。然而,TGFβ受體被裂解的LAP- TGFβ阻斷,使TGFβ保持其失活形式[1]。LAP- TGFβ複合物被稱為小潛伏複合物(SLC)。潛伏TGFβ和SLC的共價結合形成了大潛伏複合物(LLC)。當TGFβ定位於細胞外基質並被細胞啟用時,這具有重要影響[1]。研究表明,LAP中的一些疏水區域在潛伏TGFβ的形成中起著重要作用[4]。由於它控制著TGFβ,因此LAP不含突變至關重要,因為當TGFβ功能得不到適當控制時,這些突變會導致疾病[1]。
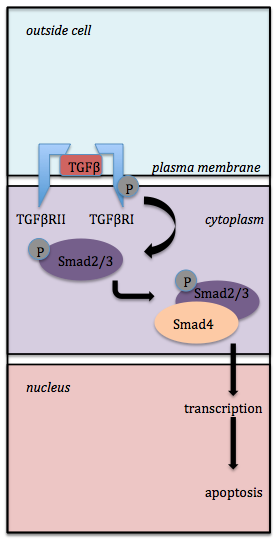
許多不同的過程已被提出來解釋TGFβ的啟用,包括熱量、酸性pH值、活性氧、各種蛋白酶、膜糖蛋白血小板反應蛋白-1和剪下應力,但是,有力的證據表明,整合素是負責TGFβ啟用的。整合素是細胞粘附和訊號受體家族的一部分。它們由一個α亞基和一個β亞基組成,它們共同構成一個異二聚體跨膜受體I。哺乳動物共有24種整合素受體,由18個α亞基和8個β亞基形成[5]。一旦被啟用,TGFβ就會結合到其跨膜受體TGFβRI和TGFβRII。這兩個受體與TGFβ形成複合物,以使TGFβ能夠發出訊號。TGFβ訊號傳導的簡單通路可以在下面的圖中顯示。圖1顯示,當TGFβ結合到TGFβRII時,TGFβRII隨後與TGFβRI結合,觸發細胞內訊號,並導致轉錄的啟用或抑制。TGFβ必須處於其活性形式才能與TGFβ RII結合。當TGFβ結合到TGFβ RII時,TGFβRII會磷酸化TGFβRI。然後,Smad2或Smad3被TGFβRI磷酸化。磷酸化的Smad2或Smad3可以與Smad4結合。由此產生的複合物可以轉運到細胞核,以啟用轉錄或誘導凋亡[1]。
不同整合素對TGFβ的啟用可以改變TGFβ的功能。在哺乳動物中,24種整合素中有6種可以透過潛伏複合物中潛伏期相關肽(LAP)區域中的三肽RGD整合素結合基序結合潛伏TGFβ。整合素αvβ3和αvβ5,當在某些成纖維細胞中表達時,啟用TGFβ,導致肺成纖維細胞分化為肌成纖維細胞。αvβ6介導的TGFβ啟用有助於維持上皮細胞中的免疫穩態。據推測,αvβ6啟用的TGFβ透過上調MMP9參與腫瘤進展,透過腫瘤侵襲,但需要進一步研究來了解該過程。αvβ8啟用的TGFβ調節腦血管發育,當αvβ8啟用亞型TGFβ1和TGFβ3時,細胞因子有助於控制神經血管發育。整合素αvβ8在樹突狀細胞中啟用的TGFβ也參與控制自身有害的T細胞反應。整合素αvβ1和α8β1啟用的TGFβ的功能尚待確定,需要進一步研究。[1]
整合素可以透過兩種不同的方式結合TGFβ。整合素(如αvβ5和αvβ6)結合到細胞外的LAP區域,並且由於連線到整合素胞質結構域的肌動蛋白細胞骨架產生的拉力,發生了構象變化。TGFβ複合物的這種構象變化還需要LTBP1結合到ECM,這為構象變化創造了保持力。潛伏複合物構象變化的機制可以透過增強細胞收縮的途徑來改善,例如凝血酶。這將導致TGFβ的啟用。由於目前沒有整合素-潛伏TGFβ複合物的結構資訊,因此對構象變化機制的瞭解僅限於此程度。[2]
整合素結合TGFβ的第二種方式是透過細胞特異性機制。例如,在肺和氣道細胞中,當細胞表面金屬蛋白酶MT1-MMP蛋白水解裂解LAP區域時,αvβ8結合到TGFβ。這種蛋白酶依賴性機制尚未在已知啟用TGFβ的其他表達αvβ8的細胞型別中進行測試,因此尚不清楚這是否是αvβ8誘導的TGFβ啟用機制。[3]
- ↑ Worthington, John J., Joanna E. Klementowicz, and Mark A. Travis. Cell Press, Jan. 2011..
- ↑ Worthington, John J., Joanna E. Klementowicz, and Mark A. Travis. Cell Press, Jan. 2011..
- ↑ Worthington, John J., Joanna E. Klementowicz, and Mark A. Travis. Trends in Biochemical Sciences. Vol. 36. Iss.1. ScienceDirect.com. Cell Press, Jan. 2011. Web.
3. Wang J, Wang D, Mei ZH, Liu , Yu HW. Applied Microbiology and Biotechnology. Volume 96. Number 2. 2012. Pubmed.gov. Web.
4. Walton, K.L. et al. (2010) Two distinct regions of Latency-associated Peptide coordinate stability of the Latent Transforming GrowthFactor-b1 complex. J. Biol. Chem. 285, 17029–17037
5. Humphries, M.J. (2000) Integrin structure. Biochemistry. Soc. Trans. 28, 311–340