結構生物化學/化學鍵/共價鍵

共價鍵是由相鄰原子之間共享價電子形成的化學鍵。這種型別的鍵合主要出現在非金屬的相互作用中。共價鍵使元素能夠與其他分子和原子形成多個鍵,這是形成大分子所必需的。在共價鍵中,隨著原子核之間距離的減小,每個原子核開始吸引另一個原子的電子,從而降低了系統的勢能。然而,當吸引力增加時,原子核之間以及電子之間的排斥力也隨之增加。在共價鍵中,每個原子都實現了完整的外部(價)電子層。共價鍵中的每個原子都將共享的電子視為完全屬於自己。大多數共價物質的電導率很低,因為電子是局域化的,並且不存在離子。總的來說,共價鍵中的原子會振動,這些振動的能量可以用紅外光譜進行研究。
觀察共價鍵時,需要遵循的一般規則是八隅體規則,也稱為惰性氣體構型。參與共價鍵的原子(除少數例外)必須遵循八隅體規則,該規則指出原子周圍必須有八個電子。這些電子可以是共享的或非共享的。這兩個原子不需要平等地共享它們的電子;可以從一個原子捐贈電子對,而不是每個原子都捐贈一個電子。可以使用元素週期表來確定原子中價電子的數量。一般規則是,如果所有原子周圍有八個電子,它們將是穩定的。因此,不同的原子可以與其他具有未配對電子的原子共享其未配對電子以獲得八隅體。
這個規則有一些例外。兩個非常重要的例外是氫 (H) 和氦 (He)。這些原子沒有八隅體,只需要總共兩個電子才能穩定。這是因為氫和氦只包含一個 1s 電子層,該電子層只能容納兩個電子。其他例外發生在分子或兩個分子之間總電子數為奇數時。這些分子往往非常活潑。此外,週期表中第二行之後的原子周圍可以有超過八個電子。 [1] 例如,在五氟化磷 (PF5) 中,磷與 10 個電子鍵合,而在六氟化硫 (SF6) 中,硫原子與 12 個電子鍵合。分子也可能缺電子,這意味著沒有足夠的可用電子來完成分子中所有原子的八隅體。硼三氯化物 (BCl3) 就是一個缺電子的分子。在這個分子中,硼原子只與三個電子對鍵合,而氯原子周圍是完整的八隅體。 [2]
原子之間可以形成多個共價鍵,這些鍵比單鍵更強,具有更高的鍵能和更短的鍵長。鍵級用於確定共價鍵中電子對的數量。當分子具有雙鍵和單共價鍵時,它可以具有能量相同的不同化學形式作為共振結構,這具有更高的穩定性,並且鍵是雙鍵和單共價鍵的平均值。共價鍵的特性也會受到它連線的兩個原子的影響。

單鍵是較弱的共價鍵型別之一。單共價鍵也稱為 σ 鍵。當僅共享兩個電子時,就會形成它們。這會導致軌道重疊和電子密度雲的合併。單鍵往往非常靈活,允許原子繞鍵旋轉。碳-碳 (C-C) 共價鍵就是一個單鍵的例子,其鍵長為 1.54 埃,鍵能為 356 kJ/mol。
請注意,單鍵的性質不僅取決於它連線的兩個原子,還取決於這些原子周圍的原子。 σ 鍵沒有節點平面。
一些共價單鍵也具有雙鍵性質,它們更短、更硬且不可旋轉。一個例子是蛋白質中的肽鍵,它將每個氨基酸連線在一起形成多肽。肽鍵為 1.32 埃,短於 1.54 埃 (C-C)。斷裂肽鍵所需的能量遠高於單鍵,並且這種不可旋轉的單鍵有助於多肽鏈的平面性質,這也使肽鍵比正常的單鍵更穩定。雙鍵性質是由肽鍵的共振結構貢獻的。
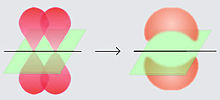
當共價鍵包含四個共享電子時,就會發生雙鍵。雙共價鍵包含一個 σ 鍵和一個 π 鍵。π 鍵適用於重疊的 p 軌道。軌道只能以側對側的方式重疊,從而導致在核間軸上有一個節點平面。單共價鍵只包含一個 σ 鍵。雙鍵往往比其單鍵等效物更短且更強。雙鍵還在鍵周圍產生電子密度。與單鍵不同,雙鍵不靈活,兩個相鄰的原子不能繞鍵旋轉。

三共價鍵包含一個 σ 鍵和兩個 π 鍵,其中共享了六個電子。這些鍵比雙鍵更強,也更短。它們比雙鍵更硬,並且具有更大的電子密度。最常見的三鍵是在碳上,如 C2H2。繪製三鍵的骨架形式是將三個直線連線兩個原子。
共價鍵可以根據鍵合在一起的原子的電負性值分為極性和非極性。如果兩個原子電負性值之間存在很大差異,就會形成極性共價鍵。原子不需要具有相同的電負性值或屬於相同的元素,但它們需要在數值上相對接近。如果電負性值越接近,原子之間的共價鍵就越強。該規則的例外情況是當分子具有對稱性時。當總偶極矩為零時,例如 CO2 的線性分子,該分子被認為是非極性的。電負性更大的原子會吸引電子,使自身帶部分負電荷,並使另一個原子帶部分正電荷。這些部分負電荷和正電荷是偶極-偶極相互作用、偶極-誘導偶極相互作用和誘導偶極-誘導偶極相互作用的原因。這種吸引力-排斥力穩定性賦予共價鍵穩定性。除了原子之間的電負性差異外,共價鍵還取決於相鄰原子彼此之間的角度。[3]
確定鍵型別的典型公認值
電負性差異 - X < 0.5 - 非極性共價鍵
電負性差異 - 0.5 ≤ X ≤ 1.9 - 極性共價鍵
電負性差異 - 1.9 < X - 離子鍵
共價鍵的特定型別
[edit | edit source]二硫鍵在化學相互作用中,某些化合物可以反應形成二硫鍵,這是一種通常由兩個硫醇 (-S-H) 偶聯產生的共價鍵。這些相互作用也可以稱為SS-鍵或二硫鍵,這些相互作用的連線主要是 R-S-S-R。
蛋白質摺疊中的作用二硫鍵在蛋白質的第三級結構中起著至關重要的作用,它們對蛋白質摺疊和穩定性有影響。蛋白質之間的這些二硫鍵通常在半胱氨酸殘基的硫醇基團之間形成。另一個含有硫的氨基酸是蛋氨酸,它不能形成二硫鍵。

二硫鍵透過多種方式幫助穩定蛋白質分子的三級結構,例如,二硫鍵透過降低其總熵或狀態或混亂度來使蛋白質的未摺疊形式不穩定。此外,當二硫鍵連線蛋白質鏈的兩個片段時,這會增加蛋白質殘基的有效區域性濃度並降低特定區域中水的效應。由於已知水分子會攻擊醯胺-醯胺鍵,因此降低這些二硫鍵區域中水的效應有助於穩定蛋白質。
共價鍵:鍵長和鍵能
[edit | edit source]鍵能 (BE) 是原子之間吸引或斷裂所需的能量。由於它是斷裂原子之間吸引力所需的能量,因此鍵能是吸熱的,並且為正值。但是,形成鍵所需的能量是放熱的,並且為負值。鍵長是兩個共價鍵合原子的原子核之間的距離。它可以根據鍵合原子的總半徑計算。因此,當共價半徑增加時,鍵長也會增加。鍵長越短,斷裂原子之間吸引力所需的鍵能就越高,因為原子之間的距離越短意味著鍵將更強,更難斷裂。另一方面,鍵長越長,斷裂較弱鍵所需的鍵能越低。可以使用鍵能來確定 ΔHrxn。在反應中,當兩個原子彼此反應形成不同原子的產物時,存在兩種型別的鍵能。一種是反應物斷裂所需的能量,另一種是產物形成所需的能量。因此,兩種鍵能之差是反應的焓或功。ΔH0rxn= ΔH反應物鍵斷裂 + ΔH產物鍵形成[4]
參考文獻
[edit | edit source]- ↑ Vollhardt 和 Shore 的有機化學
- ↑ http://chemed.chem.wisc.edu/chempaths/GenChem-Textbook/Exceptions-to-the-Octet-Rule-573.html
- ↑ Berg, Jeremy; Tymoczko, John; Stryer, Lubert. 生化,第 6 版。W.H. Freeman and Company. 2007. (7)
- ↑ Silberberg, Martin S. (2010)。普通化學原理(第 2 版)。麥格勞-希爾出版公司。ISBN978-0-07-351108-05
Silberberg, Martin S. 化學“物質和變化的分子性質”。第五版。
