結構生物化學/化學鍵/二硫鍵
二硫鍵,也稱為S-S鍵或二硫橋,是由兩個硫醇基團衍生而來的共價鍵。在生物化學中,術語R-S-S-R連線通常用於描述整體連線。建立這種鍵的最常見方法是透過硫醇基團的氧化。(2 RSH → RS-SR + 2 H+ + 2 e-)這種氧化過程可以產生穩定的蛋白質二聚體、聚合物或複合物,其中硫化物鍵可以幫助蛋白質摺疊。這個過程主要發生在半胱氨酸的硫醇基團。[1]
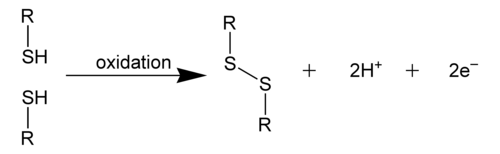
二硫鍵可以以兩種方式出現:分子內和分子間。分子間二硫鍵發生在多肽鏈之間,而分子內二硫鍵發生在多肽鏈內,通常負責穩定蛋白質的三級結構。另一方面,分子間二硫鍵被認為是穩定蛋白質四級結構的因素。[1]

蛋白質膜中的二硫鍵存在於細菌和真核生物中。胞外蛋白通常具有多個二硫鍵,而胞內蛋白通常缺乏二硫鍵。在蛋白質中,這些鍵形成於兩個半胱氨酸氨基酸的硫醇基團之間。多個線性多肽鏈之間的交聯在蛋白質中並不罕見。大多數交聯來自兩個半胱氨酸氨基酸氧化形成的二硫鍵。結果是將多肽鏈連線起來的稱為胱氨酸的二硫鍵。半胱氨酸氨基酸基團是唯一能夠形成二硫鍵的氨基酸,因此只能與其他半胱氨酸基團形成二硫鍵。這些鍵負責穩定球狀結構,是蛋白質可以擁有的最強的鍵型別之一,是將蛋白質保持在其各自構象中的主要力量之一,因此在蛋白質摺疊和穩定性中起著重要作用。
二硫鍵的典型鍵解離能為 60 kcal/mol,鍵長為 2.05 Å。產生圍繞 S-S 鍵旋轉所需的能量相當低,因此這些旋轉很常見。在接近 90° 的二面角處,鍵往往更穩定。但是,在接近 0° 和 180° 的角度處,鍵變得明顯更好的氧化劑。二硫鍵已在 E. Coli 的蛋白質摺疊中被發現。它們用於許多過程,包括 DNA 複製。
大多數環狀肽鍵是在二硫鍵之間形成的。因此,環狀肽的變性通常可以歸因於二硫鍵的穩定性。在肽 1(cyclo(1,4)-Cys-Gly-Phe-Cys-Gly-OH)的研究中,它在 pH 1-11 的緩衝溶液中於 70 攝氏度下進行。發現最大的穩定性來自 pH ~ 3 和 pH ~1-~5 之間的 V 形。隨著 pH 從中性變為鹼性,在 Gly2-Phe3 之間發現了降解,這是由於二硫鍵的斷裂造成的。

製造二硫鍵的多種方法
在 Neil J. Bulleid 和 Lars Ellgaard 的期刊文章“製造二硫鍵的多種方法”中,他們討論了二硫鍵如何在內質網 (ER) 中形成,以及催化形成途徑的不同酶。二硫鍵增加了蛋白質的穩定性,還“調節氧化還原依賴性功能”,多年來,我們對蛋白質中二硫鍵是如何形成的認識發生了巨大變化。[2]
二硫鍵是在蛋白質二硫鍵異構酶 (PDI) 家族中的酶存在下產生的。它們充當氧化劑,氧化蛋白質上的硫醇基團。如果蛋白質的氨基酸殘基,特別是半胱氨酸,彼此靠近,即使它們沒有正確摺疊,它們也會形成二硫鍵。如果在蛋白質沒有正確摺疊時形成二硫鍵,他們稱之為非天然二硫鍵。這可能是錯誤摺疊的蛋白質,也可能是蛋白質摺疊成天然狀態之前的中間體之一。PDI 透過充當異構化過程的催化劑來幫助非天然二硫鍵變成天然二硫鍵(它們必須幫助破壞非天然二硫鍵,以便蛋白質能夠在形成天然二硫鍵之前正確完成摺疊)(圖 1)。[2]
Ero1
Bulleid 和 Ellgaard 研究了酵母中的一種酶,以瞭解二硫鍵是如何從頭(拉丁語意為“在開始時”)形成的。他們研究的酶是內質網氧化還原酶 (Ero1p)。實驗表明,“Ero1p 和哺乳動物同源物 ERO1(alpha) 和 ERO1(beta) 能夠透過將從頭二硫鍵形成與氧氣還原為過氧化氫 (H2O2) 偶聯來催化氧化。” Ero1p 被證明可以氧化 PDI,這使 PDI 能夠交換蛋白質上的二硫鍵。使用敲除實驗,他們能夠證明,雖然在酵母中,Erop1 的敲除會中斷二硫鍵的形成,但在高等真核生物(例如,小鼠和人類)中,ERO1(beta) 的敲除只會導致胰島素原的錯誤摺疊,而 ERO1(alpha) 和 ERO1(beta) 的雙敲除不會比 ERO1(beta) 的單敲除更糟糕。事實上,一段時間後,“雙敲除細胞在強還原性挑戰後重新建立了正常的內質網氧化還原條件,儘管速度比野生型細胞慢。” 這告訴我們,ERO1 在高等真核生物中不像在酵母中那麼必要,這意味著還有其他形成二硫鍵的途徑。[2]
PRDX4
由於透過 ERO1 催化形成二硫鍵時會產生過氧化氫,而 H2O2 會造成生物分子的損傷,因此 Bulleid 和 Ellgaard 認為必須有其他蛋白質才能去除 H2O¬2¬。這就是過氧化還原蛋白 (PRDX4) 的作用所在。PRDX4 是一組位於內質網中的酶,它們既能去除 H2O2,又能形成二硫鍵。在這個過程中,PRDX4 中的過氧化酶半胱氨酸從 H2O2 中獲取一個氧原子生成水和一個 –SOH 基團,然後它與相鄰的 –SH 基團反應形成二硫鍵(圖 2)。現在,它可以與一些 PDI 蛋白上的 –SH 基團交換,以便它可以與底物蛋白交換(圖 1)。[2]
1. He, HT. "模型環狀五肽中二硫鍵的合成和化學穩定性:cyclo(1,4)-Cys-Gly-Phe-Cys-Gly-OH。"堪薩斯大學,堪薩斯州勞倫斯 66047,美國。
2. Neil J. Bulleid,Lars Ellgaard,製造二硫鍵的多種方法,生物化學趨勢,第 36 卷,第 9 期,2011 年 9 月,第 485-492 頁,ISSN 0968-0004,10.1016/j.tibs.2011.05.004。(http://www.sciencedirect.com/science/article/pii/S096800041100082X)
