結構生物化學/趨化性
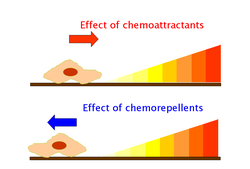
趨化性是對化學刺激的趨向性反應,生物體要麼向刺激移動,要麼遠離刺激。導致生物體靠近它的化學物質稱為吸引劑,而導致生物體遠離它的化學物質稱為驅避劑。
細胞使用鞭毛馬達來移動,要麼朝向吸引劑移動,要麼遠離吸引劑移動。當細胞遠離吸引劑時,受體發出訊號,使一個或多個鞭毛的旋轉方向從逆時針 (CCW) 切換到順時針 (CW)。當旋轉開關以逆時針方向旋轉時,細胞會朝一個方向執行,通常朝向吸引劑,這是有利的。當鞭毛馬達以順時針方向旋轉時,鞭毛會破壞執行,導致細胞翻滾。每次翻滾都會使細胞向一個新的方向遊動。逆時針旋轉使細胞比細胞翻滾時移動得更快。
由交替的游泳和翻滾產生的運動模式是“有偏見的隨機遊走”,其中細胞有時隨機移動,但總體上趨向於遷移到吸引劑處。當沒有吸引劑存在時,運動會導致“隨機遊走”,翻滾次數更多。

從細菌中分離和純化完整的鞭毛,例如大腸桿菌。然後透過電子顯微鏡確定大腸桿菌的結構。正是利用這些資料,才能理解鞭毛的結構和功能。對細菌鞭毛運動的進一步研究表明,有幾種基因是進行趨化性所必需的,稱為che 基因。Jerry Hazelbaur 和 Bob Mesibov 發現了不能對單一吸引劑進行趨化性的突變體,並將其稱為“特異性非趨化性突變體”(Adler 2011)。這些突變體後來用於測試以確定哪些化學物質是吸引劑,哪些是驅避劑。
運動細菌對環境線索做出反應,以移動到更合適的位置。介導這些反應的趨化性訊號轉導系統的組成部分在原核生物中高度保守,包括真細菌和古細菌物種。研究得最透徹的系統是在大腸桿菌中發現的。吸引劑和驅避劑化學物質透過與跨膜趨化受體蛋白的相互作用而被感知,這些受體蛋白與一個或兩個細胞極上的多聚體組裝體一起定位,以及組氨酸蛋白激酶 CheA、SH3 樣銜接蛋白 CheW 和磷蛋白磷酸酶 CheZ。這些多聚體蛋白組裝體控制響應調節劑 CheY 的磷酸化水平,CheY 指示鞭毛運動。細菌趨化性是最容易理解的訊號轉導系統之一,該系統的許多生化和結構細節已被闡明。這是一個令人興奮的研究領域,因為現在的知識深度使得能夠研究跨膜訊號傳導和訊號處理的詳細分子機制。
John Armstrong 與大腸桿菌一起研究,發現了第一個非趨化性突變體。這些突變體基本上是不表現出對化學刺激的任何吸引或驅避反應的細菌。但是,細菌仍然是運動的。透過進一步分析,發現三個 che 基因是大腸桿菌進行趨化性所必需的。這些 che 基因是 cheA、cheB 和 cheC。Jerry Hazelbauer 和 Bob Mesibov 在另一項研究中對 che 突變體進行了進一步研究,這導致了趨化吸引劑和趨化驅避劑的發現。
Che 基因負責趨化過程中的 Che 蛋白,Che 蛋白緊隨接收化學刺激的 MCP(甲基化接受趨化蛋白)受體,在鞭毛之前。Che 蛋白執行“激發”和“適應”過程。發現了另外四個 che 基因 (cheW、cheY、cheZ 和 cheR),這些基因在細菌趨化性中發揮著重要作用。在 MCP 受體接收吸引劑或驅避劑刺激後,cheA、cheW、cheY 和 cheZ 向鞭毛髮出訊號以執行激發,cheB 和 cheR 向鞭毛髮出訊號以執行適應。這些 che 基因常見於細菌(使用鞭毛進行移動的細菌和使用菌毛進行移動的細菌)和古細菌中。(Adler 2011)
攜帶運動性 (mot) 和趨化性 (che) 基因的雜合大腸桿菌 ColE1 質粒被轉移到一個微細胞產生菌株。雜合質粒上的 mot 和 che 基因指導微細胞中的蛋白質合成。在微細胞中合成的多肽與先前使用雜合λ和紫外線照射宿主細胞鑑定出的 motA、motB、cheA、cheW、cheM、cheX、cheB、cheY 和 cheZ 基因的產物相同 (Silverman 和 Simon, J. Bacteriol. 130:1317-1325, 1977),從而證實了這些基因產物的分配。一些 che 基因 (cheA 和 cheM) 的產物在聚丙烯醯胺凝膠電泳上表現為多個條帶,但對這些多肽部分肽消化分析表明,這些多種形式是由單個基因編碼的。測量雜合質粒的物理長度,可以估算出克隆的脫氧核糖核酸中用於合成 mot 和 che 基因產物的編碼能力。這些估計值也與 cheA 和 cheM 的多個多肽是單個基因的產物的假設一致。
大腸桿菌中三個趨化性特異基因 cheM、cheD 和 cheZ 的產物被甲基化。cheZ 基因編碼合成一種 24,000 分子量的多肽,該多肽出現在細胞質中。cheM 編碼合成一種 61,000 分子量的膜結合多肽。cheD 編碼合成另一種 64,000 分子量的膜結合多肽。CheM- 突變體表現出對某些吸引劑的趨化性 (Tar- 表型),而 CheD- 突變體對其他吸引劑做出反應 (Tsr- 表型)。雙突變體 (CheD-、CheM-) 不對任何測試的吸引劑或驅避劑做出反應。因此,這些多肽在趨化性中起著核心作用。它們收集來自兩個趨化受體子集的資訊,並作為趨化受體途徑的最後一步以及將訊號傳輸到鞭毛轉子的普遍訊號處理的第一步。建議它們可能參與反映趨化受體瞬時狀態的初始過程以及整合性適應過程。另外兩個基因 cheX 和 cheW 是 cheD 和 cheM 基因產物甲基化所必需的。
Bob Mesibov 對大腸桿菌進行了針對 53 種氨基酸和相關化學物質的吸引性測試。這是透過使用在 L-絲氨酸和 L-天冬氨酸中反應無關的突變體來完成的。Jerry Hazelbauer 和 Marge Dahl 還測試了大腸桿菌對 85 種常見糖和相關化學物質的吸引性。此類別中測試的吸引性最高的有:D-半乳糖、D-葡萄糖、D-甘露醇、D-核糖、D-山梨醇、麥芽糖和海藻糖。Wolfgang Epstein 和 Julius Adler 後來進行的一項研究表明,磷酸轉移酶糖也是吸引劑。還發現一些無機鹽是吸引劑。(Adler 2011)
白細胞遷移的研究繼續為二級淋巴器官中淋巴細胞啟動的調節和炎症組織中的效應反應提供新的見解。趨化因子受體一直被認為是細胞進入組織的促進劑。隨著鞘氨醇-1-磷酸受體的發現,這一整體概念現在必須進行修訂,鞘氨醇-1-磷酸受體控制細胞從淋巴組織的退出。調節淋巴組織歸巢的趨化因子通常與調節白細胞募集到炎症組織的趨化因子不同。然而,有證據表明淋巴結中白細胞募集的炎症途徑,以及外周組織中組成型途徑。最後,趨化因子受體及其訊號通路的拮抗劑(或激動劑)代表了治療多種炎症性疾病(包括過敏)的最有吸引力的策略。
對趨化驅避劑的測試方式與對趨化吸引劑的測試方式類似。對於大腸桿菌,Wung-Wai Tao 測試了 164 種不同的化學物質。這些測試的結果表明,最有效的驅避劑是:短鏈脂肪酸、疏水性氨基酸、苯甲酸鹽、吲哚、糞臭素、水楊酸鹽以及離子 Co2+、Ni2+、H+ 和 OH-。(Adler 2011)
雖然草履蟲已被廣泛用作模型感覺細胞來研究對熱、機械和趨化性刺激的細胞反應,但對其對趨避物的反應知之甚少。一項方便的毛細管趨避物生物測定法描述了四種對草履蟲具有趨避性的化合物,並將其反應與四膜蟲的反應進行了比較。經典的草履蟲 T 型迷宮趨化性測試也用於驗證這是一種可靠的趨避物測定法。前兩種化合物,GTP 和氧化劑 NBT,已知在草履蟲中是去極化趨避物,但這首次報道了它們在四膜蟲中作為趨避物。後兩種化合物,分泌促進劑 Alcian 藍和染料 Cibacron 藍,以前從未在這些纖毛蟲中被描述為趨避物。另外兩種化合物,分泌促進劑 AED 和氧化劑細胞色素 c,被發現對草履蟲具有趨避性,但對四膜蟲則沒有。這些化合物的趨避性與其毒性無關。原因是因為細胞在所有這些化合物中都完全存活。更重要的是,所有這些趨避物在微摩爾到納摩爾濃度下都是有效的,這為在未來關於其膜受體和可能的受體操作離子通道的研究中將它們用作興奮性配體提供了機會。
雙組分系統
[edit | edit source]雙組分系統由不參與趨化性的 che 蛋白構成。相反,這些 che 基因與細胞中的轉錄調節因子關係更為密切。在雙組分系統中發生一個重要現象,它影響細菌鞭毛的旋轉和運動。當第一個組分的組氨酸殘基被 ATP 磷酸化時,磷酸被轉移到第二個組分的門冬氨酸殘基,這會影響鞭毛的旋轉和運動。雙組分系統中的磷酸化也控制著蛋白質合成所需的基因。雙組分系統主要存在於細菌、古細菌和單細胞真核生物中。趨避物引起 cheA 和 cheY 的磷酸化。因此,這會導致細菌鞭毛的翻滾。這使得細菌能夠遠離趨避物。趨化物阻止 cheA 和 cheY 的磷酸化,因此翻滾停止。另一方面,這使得細菌能夠朝向趨化物奔跑。細菌與趨避物和趨化物的相互作用被稱為激發。激發決定了細菌的運動。適應,繼激發之後的過程,決定了細菌的旋轉。趨避物導致甲基化的 MCP(甲基接受趨化性蛋白)的去甲基化,而趨化物導致其甲基化。一般來說,趨避物會導致細菌以順時針方向旋轉,而趨化物會導致細菌以逆時針方向旋轉。http://www.pnas.org/content/94/14/7263/F1.expansion.html (Adler 2011)
其他刺激的反應
[edit | edit source]瞭解環境是決定細胞行為的主要因素,除了化學物質之外,還有其他感官刺激。大腸桿菌被發現會被藍光(趨光性)所排斥,這是由大腸桿菌中的趨化受體對光的反應決定的,因為大多數細菌物種是以前的光合生物。利用光固定碳,它們產生了行為訊號,現在允許大腸桿菌對光作出反應。(Adler 2011) (Berg 2011)
大腸桿菌已經表現出對熱的一些反應。進行了更多測試以觀察趨化系統對趨熱性的影響。如果大腸桿菌缺少 3 種趨化蛋白(cheY|W|A),那麼它們就不會對溫度變化做出反應,而是趨化受體(Tsr、Tar、Trg、Tap)都表現出對細菌趨熱性有一定的作用。分為兩類,冷受體是 Tap,而 Tsr、Tar、Trg 在溫度下降時表現出翻滾增加,反之,冷受體則會產生相反的反應。如果受體靠近其吸引物,則在甲基化後會表現出不同的行為。如果有絲氨酸,則由於 Tsr,不會有任何反應。可能提供的解釋是,大腸桿菌“游泳”的原因是高溫會導致變性,使其更具流動性。(Adler 2011) (Jeffory,Salman,Libchaber 2011)
滲透壓在大腸桿菌被高滲透壓和低滲透壓排斥,而尋求最佳滲透壓方面起著重要作用。這種趨滲性高度依賴於大腸桿菌的環境,變化會產生不同的影響。如果水從細胞中快速流動,它將是膨脹的,從而導致一個試圖恢復原始條件的過程。細胞質水的量和濃度是生長控制因素,滲透壓越低/越高,它移動的越少,反之,在最佳滲透壓狀態下移動的更多。(Adler 2011)
電生理學
[edit | edit source]如果對環境有不同的反應,那麼電學特性也必須在 E. Coli 中發揮作用。儘管實驗已經研究了 E. Coli 的動作電位,但還沒有任何證據。事實證明,E. Coli 記憶體在電學變化,但沒有接近動作電位的變化。E. Coli 的尺寸也證明是一個難題,因為它非常小。如果我們要測量電壓,它會降解細胞壁並破壞細胞的功能。為了測量它們,到目前為止,科學家們監測了 E. Coli 菌株的閃爍行為並確定其功能。(Adler 2011) (McDonald 2011)
電生理學是所有心血管學科中發展最快的學科。電生理學家是心血管專家,他們接受了關於心律失常診斷和治療的額外教育和培訓。電生理學家與治療心臟病患者的其他醫生的密切合作非常重要。
電生理學研究 (EPS) 是一種可以幫助預測個人是否處於心源性猝死高風險的測試。以特定模式向心肌傳送訊號,以檢視它們是否會刺激室性心動過速 (VT)。該測試在醫院或診所的安全且受控的電生理實驗室中進行,患者沒有危險。在 EP 研究中,區域性麻醉劑用於麻醉腹股溝或頸部附近的區域,並將細小的導管送入心臟以記錄其電訊號。在研究過程中,醫生會研究電訊號透過心臟的速度和流動,識別節律問題並查明心臟肌肉中產生異常電訊號的區域。無論如何,電生理學 (EP) 是一門新興的醫療保健科學和療法。EP 是心臟病學的一個亞專科,專注於心律失常的診斷和治療。心臟電生理技術員可能來自各種盟友健康專業人員(RT、RN、CVT、EMT、RRT 和 PA),在診斷和侵入性程式中協助 EP 心血管專家,包括程式性電刺激、無菌擦洗技術、電解剖 3D 對映、心律失常的導管消融以及心臟節律管理的裝置植入,如起搏器和其他先進的可植入裝置。
電生理學研究可以:1) 識別哪些先前發生過心臟病或心肌梗塞的患者有發生嚴重室性心律失常的風險,可能還有 SCA。2) 幫助確定哪些患者可能需要積極治療以預防心源性猝死。3) 識別心臟無法誘發危險心律失常的個體。他們似乎處於發生自發性、持續性 VT 的風險較低,這可能導致室顫和心源性猝死。
我們可能需要進行 EP 研究:1) 確定異常心律的原因。2) 確定異常心律起源的位置。3) 決定治療異常心律的最佳方法。
參考文獻
[edit | edit source]Adler, Julius (2011). "我與自然的生活". 生物化學年度評論. Retrieved 2011-10-27.
Berg, Howard (2004). "大腸桿菌的運動". 生物學和醫學物理學生物醫學工程. Retrieved 2011-10-29.
Jeffory,Salman,Libchaber, Marie,Hanna,Albert (2004/05). "大腸桿菌的趨熱性" (PDF). 洛克菲勒大學. Retrieved 2011-10-29. {{cite web}}: Check date values in: |date= (help)CS1 maint: multiple names: authors list (link)
McDonald, Casey (2011). "大腸桿菌伏特計". 生物技術. 檢索於 2011-10-29.
Foster, John W., Slonczewski, Joan L.. 微生物學. 第 1 版. 紐約. 2009.
