結構生物化學/DNA修復
由於DNA包含所有遺傳資訊和蛋白質生產的指令,因此確保DNA變化很少至關重要。DNA不斷受到輻射和化學誘變劑的轟擊,這些誘變劑會導致突變。然而,由於四種主要型別的DNA修復,突變率非常低。
人類基因組不斷受到正常細胞條件(如自由基或DNA複製錯誤)以及外在條件(如紫外線輻射)的毒性壓力。為了對抗這些壓力並正確維護基因組,DDR途徑,或DNA損傷反應途徑已經進化。該途徑的作用是檢測錯誤或異常,傳播檢測訊號,並激活系統來糾正問題。如果損傷無法修復,細胞將發生凋亡,或程式性細胞死亡,以避免將潛在的致命DNA錯誤傳遞下去。細胞不斷遇到DNA損傷,因此DDR途徑對細胞存活至關重要。
最致命的DNA損傷形式來自電離輻射,它會導致雙鏈斷裂。修復蛋白RAD51迅速在DNA損傷部位聚集。有人建議,損傷誘導的組蛋白變體H2AX磷酸化表明DNA斷裂部位;許多其他修復蛋白也聚集在H2AX積累的這些部位。在缺乏H2AX的小鼠中,發現了免疫系統退化和腫瘤發生率增加。
細胞對DNA損傷反應的主要調節劑是ATM和ATR激酶(共濟失調毛細血管擴張突變)透過調節超過700種蛋白質的磷酸化。這種磷酸化是DNA損傷訊號傳導的初始步驟。
“DNA損傷訊號傳導和修復中的結構動力學”是一篇由JJ Perry、Elizabeth Cotner-Gohara、Tom Ellenberger和John A. Tainer撰寫的文章。在這篇文章中,DNA損傷反應是在揭示蛋白質在這些途徑中的作用的方面進行研究的。DNA不斷受到代謝物和毒物的損傷。因此,DNA修復和損傷反應對於生命的功能至關重要。DNA損傷涉及三個步驟。首先檢測到損傷,然後將其移除,最後用正確的DNA序列替換。該途徑再生一個3'末端,該末端將使用DNA聚合酶以未受損的鏈作為模板進行延伸。修復透過連線酶重新封閉DNA骨架來完成。由於修復過程會產生有毒的中間體,因此在修復DNA時需要強大的“遺傳選擇”。發現蛋白質結構與DNA損傷反應和修復途徑內步驟的協調有關。這一點非常重要,因為蛋白質再次與DNA複製過程有關。
當不同的方法結合在一起時,可以詳細研究DNA修復複合物的動力學。這些方法包括X射線晶體學、NMR、SAXS - 小角X射線散射、DXMS - 氫-氘交換質譜法等。這些方法提供了從奈米級到原子級的微小資訊。例如,SAXS提供了關於溶液中大分子柔性的資訊。它還提供了有關整個途徑及其在溶液中的相互作用的資訊。此外,DXMS顯示了修復過程中發生的構象變化,詳細程度相當於單個氨基酸的解析度。因此,結合不同的結構生物化學方法有助於科學家發現DNA修復和損傷反應系統之間不同的協調。目前的研究發現,“不同酶構象之間的轉變可能涉及非天然相互作用,從而降低了不同狀態之間相互轉換的能量勢壘”(1)。這一發現非常重要,因為它描述了DNA修復複合物(構象變化)的變化與透過這些變化發生的生物學結果之間的聯絡。例如,如上所述,酶構象的變化會導致修復受損DNA過程中不同狀態之間轉換的活化能降低。另一個例子是,改變修復蛋白系統的正常蛋白質柔性和穩定性會導致嚴重的遺傳疾病。發現DNA和ATP結合的變化與癌症有關,以及DNA修復框架的柔性和穩定性缺陷如何與衰老疾病(如Cockayne綜合徵或TTD)有關。
損傷修復是由多結構域核苷酸切除修復解旋酶(NER)執行的。這種酶從要修復的DNA的一條鏈中去除體積大且扭曲的切割。這是一個非常精確的過程,只有缺陷鏈被去除,而不影響未受損的DNA鏈,因為未受損的DNA鏈作為修改和修復過程的模板。NER蛋白以一種允許在實際去除DNA骨架之前驗證損傷部位的方式組裝。DNA修復過程的一個例子是酵母Rad4的執行,Rad4是一種多結構域蛋白,它與NER修復的螺旋的扭曲部分結合。該蛋白的結合被證明可以穩定扭曲的DNA結構。觀察表明,Rad4透過DNA螺旋插入一個β髮夾來重新定位其鹼基。一個令人驚訝的發現是,Rad4不是與受損的DNA鏈結合,而是與未受損的DNA鏈結合。結果是,由於受損的DNA鏈,螺旋軸發生了偏移,導致結構彎曲,從而增加了Rad4與相鄰髮夾區域的DNA相互作用表面。這種延伸的相互作用創造了一個更穩定的受損DNA,儘管其鹼基現在暴露在溶劑中。這種穩定性有助於NER修復受損鏈。
DNA損傷反應和修復中的另一個重要組成部分是BER - 鹼基切除修復途徑。BER和NER之間的區別在於BER能夠檢測和去除單個核苷酸,這些核苷酸具有最小的修飾,例如新增一個單一的甲基。因此,它在修復扭曲的DNA鏈方面非常有效。在BER中,發現氧化損傷特異性糖基化酶OGG1和MutM與8-oxoG鹼基相互作用。8-oxoG鹼基由氫鍵供體N9和受體O8組成。它們與OGG1相互作用,並提供對受損DNA的選擇性切割。整個複合物被稱為假米氏複合物。總體而言,從NMR、X射線晶體學到SAXS等方法的組合觀察到了DNA損傷反應和修復過程中的不同機制。
下面是DNA修復過程的影像,其中DNA連線酶I正在修復染色體損傷。

DNA修復包括檢測現有損傷和實際修復這種損傷。9-1-1是一種異三聚體蛋白,由三個亞基組成,其中至少一個亞基與其他兩個亞基不同,它圍繞DNA包裹,以啟動特定檢查點蛋白的募集並暫時凍結細胞週期。更具體地說,它會導致Sc-Mec1/Hs-共濟失調毛細血管擴張突變的磷酸化,其中Sc-和Hs-字首分別指釀酒酵母(一種真核生物)和智人,以及Rad3。Chk1和Sc-Rad53/Hs-CHK2蛋白激酶被啟用,導致細胞週期G1/S、S內或G2/M階段的抑制。修復基因的積累、複製叉的固定以及細胞週期蛋白(促進細胞週期的蛋白質)產生的減少也是這種啟用的結果。9-1-1與Sc-Cdc28協同作用,選擇性地積累Sc-Ddc2。Sc-Ddc2/Hs-ATRIP、Sc-Mec1/HS-ATR和9-1-1的共同存在激活了檢查點,無論是否檢測到DNA損傷。
錯配修復糾正了複製過程中DNA聚合酶校對能力無法糾正的核苷酸配對錯誤。錯誤配對的鹼基核苷酸會導致DNA二級結構的變形。MSH2和MSH6二聚體結合到鏈上的錯配處。然後,內切核酸酶MLH1將與MSH結合,並切斷該鏈。然後,外切核酸酶將降解兩者之間的區域,然後允許DNA聚合酶δ放置正確的核苷酸,而DNA連線酶將重新連線該鏈。利用這種能力,該酶切除了新DNA鏈的扭曲部分,然後使用舊DNA鏈作為模板填補空白。在大腸桿菌中,錯配修復酶透過某些序列上甲基的存在來識別舊DNA鏈。在真核細胞中,尚不清楚該酶如何區分舊DNA鏈和新DNA鏈。

在直接修復中,不是替換整個核苷酸,而是將錯誤的核苷酸結構改變為正確的核苷酸。來自太陽的紫外線透過在相鄰嘧啶之間形成共價鍵而導致嘧啶二聚體。一些真核細胞有一種叫做光解酶的酶。這種酶利用光能來打破嘧啶二聚體之間的共價鍵。
DNA 修復是由核苷酸切除修復 (NER) 解旋酶執行的,這是一種由多個結構域組成的蛋白質。NER 以逐步的方式組裝在受損 DNA 區域周圍(由於其錯誤,包含凸起或病變,鼓勵 NER 結合),從而可以在執行實際切除之前仔細驗證損傷。例如,酵母 Rad4 蛋白(哺乳動物 XPC 的類似物)透過結合附近的未損傷區域間接檢測 DNA 損傷。受損的 DNA 鏈是靈活的,允許形成一個穩定的複合物,其中包括 Rad23,該蛋白實際上修復了損傷。
如果 XPC-Rad4 無法檢測到受損位點,則一種替代方案涉及 DDC1-DDC2 二聚體。該二聚體與受損 DNA 區域和泛素連線酶形成複合物。該複合物泛素化 XPC 和 DDC2,後者隨後釋放 DNA 分子,將其傳遞給 XPC 和正常的 NER 過程。
核苷酸切除修復可以分為兩類:全域性基因組修復和轉錄偶聯修復。
全域性基因組修復涉及 XPC 和 hHR23B 二聚體結合受損 DNA,然後轉錄因子 2H (TFIIH) 結合該複合物。然後 XPG 結合,DNA 被進一步解旋。核酸酶 XPG 和 XPF 切割 DNA,這基本上去除了受損的 DNA。然後 DNA 聚合酶 delta 用正確的核苷酸填補間隙,然後 DNA 連線酶重新連線該鏈。
轉錄偶聯修復是當 RNA 聚合酶在受損位點停滯時,然後 Cockayne 綜合徵 B 蛋白 (CSB) 取代 RNA 聚合酶並招募 TFIIH 和 XPG。在核酸酶 XPG 和 XPF 切割 DNA 之前,DNA 被解旋。然後去除受損部分,DNA 聚合酶 delta 填補間隙,連線酶重新連線該鏈。
來源:分子細胞生物學,Lodish 等人,第 6 版(2008 年),第 145-160 頁
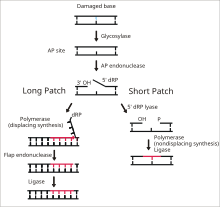
並非所有損傷都大到足以導致 NER 檢測到的病變。鹼基切除修復 (BER) 途徑修復單核苷酸錯誤,有時僅限於新增一個甲基。雖然這些損傷很小,但它們通常足以阻礙 DNA 複製或產生非功能性蛋白質。BER 途徑中的損傷檢測很困難,因為除了錯誤很小之外,還有很多錯誤。許多酶用於檢測不同的微小錯誤並啟動 BER 途徑。
鹼基切除修復的第一步是切除修飾的核苷酸。稱為 DNA 糖基化酶的酶,每種酶都有其自身的識別特定型別修飾鹼基的能力,它們切斷脫氧核糖糖的 1'-碳和鹼基之間的鍵並去除鹼基。然後稱為脫嘌呤或脫嘧啶 (AP) 核酸內切酶的酶斷裂磷酸二酯鍵,另一種酶去除脫氧核糖糖。DNA 聚合酶來臨並向遊離的 3'OH 基團新增正確的核苷酸。最後,DNA 連線酶透過形成磷酸二酯鍵連線 DNA 鏈。
DNA 的糖-磷酸主鏈的損傷由 DNA 連線酶修復。由於 DNA 主鏈對所有生物體都是通用的,因此這些連線酶也存在於所有使用 DNA 作為其遺傳物質的生物體中。DNA 連線酶透過三個步驟過程密封主鏈中的斷裂。在第一步中,酶的幾個結構域採用特定構象,使活性位點賴氨酸殘基腺苷酸化。在最後兩個步驟中,酶環繞斷裂的 DNA 鏈並融合兩個末端。
DNA 雙鏈中的斷裂很常見,但對細胞特別有害,因為遺傳突變的可能性增加。雙鏈斷裂的主要原因包括來自氧化代謝的活性氧、電離輻射和酶錯誤。該鏈可以以兩種主要方式之一修復:同源重組修復和非同源 DNA 末端連線途徑 (NHEJ)。
任何二倍體生物體都可以使用同源重組修復,即使二倍體是暫時的,就像在細菌中一樣。同源重組修復的型別包括同源重組、單鏈退火和斷裂誘導複製。在同源重組中,在細胞週期中的 S 期,需要一個相同或幾乎相同的 DNA 序列作為修復的模板,該階段僅發生在 DNA 複製期間和之後不久,以及有絲分裂之前。然後核苷酸序列在相似的鏈之間交換。
NHEJ 作為同源重組修復的替代方案出現,因為模板供體通常在非分裂細胞中不可用。NHEJ 具有非凡的靈活機制,具有廣泛的底物多樣性,可以轉化為所需的產物。與其他 DNA 修復過程一樣,它需要三種主要蛋白質:一種核酸酶來切除受損的 DNA、一種聚合酶來填充新的 DNA 以及一種連線酶來修復該鏈。關鍵成分包括 Ku、DNA-PKcs、Artemis、Pol x 聚合酶以及由 XLF、XRCC4 和 DNA 連線酶 IV 組成的連線酶複合物。然後每個 DNA 末端可以被獨立地修改多次,並且由於其靈活的性質,允許用其他酶進行替換。雙鏈斷裂處連線異質 DNA 末端的問題被證明在原核生物和真核生物中是趨同進化的。
- Huen, M. SY. "DNA 損傷位點的檢查點和修復機制的組裝。" 生物化學科學趨勢,第 35 卷,第 2 期,101-108,2009 年 10 月 28 日
- Perry JJ, Cotner-Gohara E, Ellenberger T, Tainer JA。“DNA 損傷訊號和修復中的結構動力學”。Curr. Opin. Struct. Biol. 2010 年 6 月;20(3)
- Pierce,Benjamin A.,Jung H. Choi 和 Mark E. McCallum。遺傳學:概念方法。紐約,紐約:W.H. Freeman,2008 年。印刷版。
- Lieber MR。非同源 DNA 末端連線途徑修復雙鏈 DNA 斷裂的機制。Annu Rev Biochem。2010;79:181–211。
- Perry, J. Jefferson P.,Elizabeth Cotner-Gohara,Tom Ellenberger 和 John A Tainer。“DNA 損傷訊號和修復中的結構動力學”。結構生物學現狀。 (2010):283-294。ScienceDirect。
- Eichinger, S. Christian 和 Stefan Jentsch。“9-1-1:PCNA 的專業表親”。生物化學科學趨勢,第 36 卷,第 11 期,563-568,2011 年 10 月 4 日。

