結構生物化學/血紅蛋白

血紅蛋白(在許多英語變體中拼寫為 Haemoglobin,通常縮寫為“Hb”)是一種四聚體,由兩個二聚體組成,它們與氧氣結合。血紅蛋白是紅細胞中運輸氧氣的蛋白質,是一種具有四級結構的球狀蛋白。血紅蛋白由四個多肽亞基組成;兩個 α 鏈和兩個 β 鏈。血紅蛋白將氧氣從肺部運輸到身體的其他部位。血紅蛋白的三維結構是由馬克斯·佩魯茨在 1959 年使用 X 射線晶體學解決的。血紅蛋白的結構與肌紅蛋白中的單多肽鏈非常相似,儘管它們在 83% 的殘基處氨基酸序列不同。這突出了蛋白質結構中一個相對常見的主題:非常不同的初級序列可以指定非常相似的三維結構。
血紅蛋白存在兩種狀態,即 T 狀態(緊張狀態)和 R 狀態(鬆弛狀態)。T 狀態對氧氣的親和力低於 R 狀態。在協同性的協調模式中,血紅蛋白必須處於 T 狀態或 R 狀態。在協同性的順序模式中,單體的構象狀態在它與氧氣結合時發生變化。對血紅蛋白的實際實驗觀察表明,它比這兩種模型都更復雜,介於兩者之間。血紅蛋白的構象也會隨著氧氣與鐵的結合而發生變化,從而提高了結合鐵和組氨酸殘基的水平。氧氣結合使鐵離子的位置改變了大約 0.4 Å。在氧合之前,鐵離子略微位於卟啉平面之外,在氧合後,它移動到血紅素平面上。血紅蛋白對氧氣的親和力隨著 pH 值的降低而降低。這很有用,因為血紅蛋白在肺部對氧氣的親和力很高,可以有效地與更多的氧氣結合。一旦它到達肌肉,那裡的 pH 值較低,降低的氧氣親和力使血紅蛋白可以將氧氣釋放到組織中。當二氧化碳擴散到紅細胞中時,它的解離也會導致 pH 值下降。
血紅蛋白對氧氣的親和力低於其結構類似物肌紅蛋白。有趣的是,然而,這並不影響血紅蛋白對身體的有用性;相反,它使血紅蛋白成為比肌紅蛋白更有效的氧氣載體。這是因為血紅蛋白比肌紅蛋白更容易釋放氧氣。雖然將氧氣輸送到身體的不同部位很重要,但更重要的是氧氣在需要時被釋放。給定蛋白質對氧氣的親和力越高,該蛋白質在需要時釋放氧氣的難度就越大。因此,血紅蛋白對氧氣的親和力較低,對它有利,因為它使血紅蛋白更容易在體內釋放氧氣。另一方面,肌紅蛋白對氧氣的親和力明顯更高,因此一旦結合,它將不太願意釋放它。因此,血紅蛋白對氧氣的親和力低於肌紅蛋白,使其在結合和隨後釋放氧氣物種方面具有更高的整體效率。出於這個原因,身體往往更頻繁地使用血紅蛋白來分配氧氣,儘管肌紅蛋白也被使用,特別是用於將氧氣輸送到肌肉細胞。可以在相應的章節中瞭解更多關於肌紅蛋白的資訊。
同樣值得一提的是,胎兒血紅蛋白對氧氣的親和力明顯高於母體血紅蛋白。這對人類女性(以及其他懷孕的哺乳動物女性)的妊娠期間至關重要,因為它使胎兒能夠在發育過程中獲得所需的氧氣。基本上,存在於胎兒體內的血紅蛋白能夠在母體血液接觸胎兒物質時從母體血紅蛋白中剝奪氧氣物種。母體血液中沒有接觸胎兒的那一部分會像正常一樣將氧氣轉移到母體的器官系統。
當氧氣與血紅蛋白結合時,顏色會變成深紅色。當氧氣未結合時,顏色會變成深“樸素”的紅色[2]。血紅蛋白對氧氣的親和力隨著與氧氣結合的氧氣越多而增加。解離曲線表示血紅蛋白如何透過其 S 形曲線對氧氣具有協同性。 - 左移表示氧氣親和力的增加。血紅蛋白有更好的機會抓住氧氣。這通常發生在環境因素髮生變化時,例如低溫、低代謝率和高 pH 值。
- 右移表示親和力的降低。血紅蛋白更容易釋放氧氣。這是由於高溫、高代謝率和低 pH 值引起的。
雖然血紅蛋白有 4 個亞基,但肌紅蛋白只有一個亞基。它是細胞內氧氣儲存的酶(存在於骨骼肌細胞中)。肌肉呈紅色是因為它們含有大量的肌紅蛋白。潛水哺乳動物等生物體內含有大量的肌紅蛋白,因此它們可以在長時間內不呼吸。
如上所述,血紅蛋白存在兩種不同的狀態:T 狀態和R 狀態。血紅蛋白的 T 狀態是兩者中更“Tense”的;這是血紅蛋白的脫氧形式(意味著它缺乏氧氣物種),也稱為“脫氧血紅蛋白”。血紅蛋白的 R 狀態更“Relaxed”,是完全氧合的形式;它也稱為
“氧合血紅蛋白”。

血紅蛋白的獨特特徵之一是它表現出協同性。這意味著血紅蛋白可以向其各種功能基團傳遞分子內資訊,以幫助它獲得對目標配體的最大親和力,在本例中是氧氣。當血紅蛋白的一個單體與氧氣結合時,它會提醒附近其他血紅蛋白單體開始結合過程。這意味著,隨著越來越多的氧氣被血紅蛋白單體結合,血紅蛋白的親和力也會越來越高。換句話說,血紅蛋白的親和力與其在給定時間結合的氧氣數量成正比。這使血紅蛋白能夠隨著時間的推移增加其對氧氣的親和力,這種特性將其標記為體內最靈活的蛋白質之一。因為它可以改變其對氧氣的親和力,所以血紅蛋白可以表現出一系列不同的親和力。如前所述,這使其在氧氣結合量方面非常靈活,因此它可以釋放多少氧氣。這是身體更喜歡使用血紅蛋白而不是肌紅蛋白進行氧氣運輸的原因之一:血紅蛋白可以改變其自身對氧氣的親和力以適應當前情況,使其能夠處理更廣泛的化學環境和器官系統,同時仍然能夠有效地分配氧氣。


血紅蛋白的協同作用主要有兩種模型。其中一個是協同模型。該模型指出,血紅蛋白分子在 R 狀態和 T 狀態之間快速轉換,以最大程度地提高其對氧氣的親和力。根據該模型,血紅蛋白不斷地在兩種狀態之間“翻轉”,試圖儘可能多地結合氧氣。另一個模型是順序模型。該模型認為,血紅蛋白的一條鏈會啟動一系列構象變化,從而提高其對氧氣的親和力。當血紅蛋白的一條鏈結合氧氣時,血紅蛋白會以有利於額外氧氣結合的方式重新排列。當下一個氧氣結合時,會發生另一種構象變化,以進一步補充結合;因此,血紅蛋白可以隨著其越來越多的鏈結合氧氣而順序地提高其對氧氣的親和力。
從血紅蛋白動力學實驗獲得的實驗資料表明,協同模型和順序模型都沒有得到強烈支援。如果有的話,資料表明血紅蛋白的行為代表了兩種模型的混合;因此血紅蛋白的協同作用介於協同模型和順序模型之間。
眾所周知,血紅蛋白在與氧氣結合時會發生多種構象變化。首先,一旦血紅蛋白中的鐵陽離子開始移動,血紅蛋白的組氨酸殘基和α-螺旋也會開始移動,以穩定鐵離子移動引起的改變。其次,α-螺旋的羧基末端通常位於構成血紅蛋白的兩個α-和β-二聚體之間的介面。最後,羧基末端的位移變化為血紅蛋白的 T 狀態和 R 狀態之間的轉換創造了有利條件。
以上描述清楚地表明,協同模型和順序模型不能完全解釋血紅蛋白的行為,也不能解釋相關蛋白類的行為。為了解釋這種差異,人們設計了更復雜的模型,更準確地反映了從血紅蛋白結合實驗中獲得的動力學資料。
氧氣結合曲線
[edit | edit source]氧氣與血紅素中鐵的結合會從亞鐵離子中拉出部分電子密度到氧氣分子。重要的是,當氧氣釋放時,要將肌紅蛋白留在雙氧形式而不是超氧化物形式,因為超氧化物可以自行生成新的形式,對許多生物材料產生負面影響,而且超氧化物還會阻止鐵離子以其三價鐵狀態 (Metmyoglobin) 結合氧氣。與穩定的 O2 分子相比,超氧化物和超氧化物衍生的氧物種反應性很強,它們可能會對細胞內部及其環境產生破壞性影響。肌紅蛋白中一個遠端的組氨酸殘基調節血紅素基團的反應性,使其更適合結合氧氣。它是透過與氧氣分子形成氫鍵來實現的;氧氣分子的額外電子密度使氫鍵異常牢固,因此作為穩定劑更加有效。
氧氣結合曲線是顯示部分飽和度與氧氣濃度關係的曲線圖。根據定義,部分飽和度表示存在結合了氧氣的結合位點。部分飽和度範圍可以從零(所有位點為空)到一(所有位點都被填充)。氧氣濃度由分壓決定。
與肌紅蛋白對氧氣的親和力相比,血紅蛋白對氧氣的親和力相對較弱。血紅蛋白的氧氣結合曲線呈S形曲線。這是由於血紅蛋白的協同作用。當血紅蛋白從肺部運輸到組織時,其周圍環境的 pH 值會降低,與之反應的 CO2 量也會增加。這兩種變化都會導致血紅蛋白失去對氧氣的親和力,從而使其將氧氣釋放到組織中。這導致血紅蛋白在氧氣結合曲線中呈現 S 形曲線,證明了其協同作用。
 File:Oxygen binding curve with hemoglobin and myoglobin.jpg
File:Oxygen binding curve with hemoglobin and myoglobin.jpg
這張圖顯示了血紅蛋白與肌紅蛋白的氧氣結合親和力對比,以及如果血紅蛋白不表現出協同作用則必須遵循的假設曲線。從這張圖中,你可以看到血紅蛋白的 S 形曲線,它一開始與肌紅蛋白的親和力略低,但在肺部與氧氣的親和力相當。隨著壓力的下降以及肌紅蛋白和血紅蛋白向組織移動,肌紅蛋白仍然保持著對氧氣的很高親和力,而血紅蛋白由於其協同作用,突然失去了其親和力,因此使其比肌紅蛋白更有效地運輸氧氣。灰色曲線表示沒有協同作用,表明為了在組織中獲得所需的低氧氣親和力,血紅蛋白的初始氧氣親和力將會更低,因此在從肺部輸送氧氣方面效率較低。
血紅蛋白的氧氣結合曲線
[edit | edit source]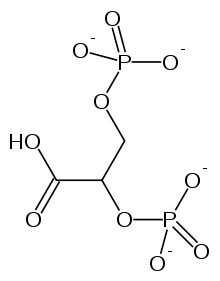
在紅細胞中,血紅蛋白的氧氣結合曲線呈現“S”形,稱為 S 形曲線。S 形曲線表明氧氣結合是協同的;也就是說,當一個位點結合氧氣時,其餘未被佔據的位點結合氧氣的機率會增加。
協同行為的重要性在於它使血紅蛋白能夠更有效地運輸氧氣。例如,在肺部,血紅蛋白的飽和度為 98%。但是,當血紅蛋白存在於組織中並釋放氧氣時,飽和度下降到 32%;因此,66% 的潛在氧氣結合位點參與了氧氣的運輸。
純化的血紅蛋白與氧氣結合得更緊密,使其在氧氣運輸中作用不大。這種特性差異是由於人體血液中存在 2,3-二磷酸甘油酸 (2,3-BPG),它充當變構效應物。變構效應物在一個位點結合並影響另一個位點的結合。2,3-BPG 結合到血紅蛋白 T 狀態的口袋中,並在其形成 R 狀態時釋放。2,3-BPG 的存在意味著必須有更多的氧氣與血紅蛋白結合,才能發生向 R 形式的轉變。
其他調節,如血紅蛋白的波爾效應,也可以透過氧氣結合曲線來描述。透過分析氧氣結合曲線,可以觀察到氧氣親和力與 pH 值之間存在比例關係。隨著 pH 值降低,血紅蛋白對氧氣的親和力也會降低。因此,當血紅蛋白接近低 pH 值區域時,會釋放更多的氧氣。這種波爾效應的化學基礎是由於形成四級結構的兩個鹽橋。一個鹽橋是由 β-組氨酸 146(羧基末端基團)與 α-賴氨酸 40 之間的相互作用形成的。這種連線將有助於將組氨酸殘基定向,以便在另一個鹽橋的形成中與帶負電荷的天冬氨酸 94 相互作用。第二個橋是在組氨酸殘基上額外加一個質子的幫助下形成的。
當二氧化碳擴散到紅細胞中時,它會在內部與水反應形成碳酸。碳酸解離導致 pH 值降低,並穩定 T 狀態。
氧氣結合曲線還可以顯示二氧化碳存在對血紅蛋白的影響。二氧化碳的調節作用類似於波爾效應。比較二氧化碳在血紅蛋白中缺失和存在的影響發現,當二氧化碳存在時,血紅蛋白更有效地將氧氣從組織運輸到肺部。這種效率的原因是二氧化碳也會降低血紅蛋白對氧氣的親和力。二氧化碳的加入會導致 pH 值下降,進而導致血紅蛋白對氧氣的親和力降低。這在組織中非常明顯,因為組織中儲存的二氧化碳被釋放到血流中,然後發生反應,將 H+ 釋放到血流中,增加酸度並降低 pH 值。
File:Reason carbon dioxide decreases pH.jpg
血紅蛋白的變構效應物
[edit | edit source]變構調節是透過其他分子控制蛋白質行為的過程;執行這種調節的分子被稱為變構調節劑。該過程涉及變構調節劑分子與目標蛋白質的結合;結果是對蛋白質功能產生明顯的影響。增加或補充給定蛋白質功能的變構調節劑被稱為變構啟用劑。降低或中斷給定蛋白質功能的變構調節劑被稱為變構抑制劑。
血紅蛋白與其他蛋白質一樣,也擁有變構調節劑。對於血紅蛋白這樣重要的蛋白質來說,調節是必不可少的,因為它對氧氣的親和力必須適合其當前處理的特定器官系統。因此,血紅蛋白大多數變構調節劑的主要任務是微調其氧氣親和力,以匹配當前的情況。
細胞使用變構抑制劑的優勢: - 在典型的代謝途徑中,途徑的最終產物充當變構抑制劑。 - 它會抑制途徑中的第一個酶,從而節省細胞在最終產物過剩的代謝途徑中消耗資源。
二磷酸甘油酸或 BPG 是血紅蛋白的眾多變構調節劑之一。該分子結合到血紅蛋白脫氧形式 (T 狀態) 的中央腔並穩定它。T 狀態的穩定性增加導致對氧氣的親和力降低,因為通常是 T 狀態的強烈應變推動脫氧血紅蛋白結合氧氣;一旦結合了氧氣,T 狀態就會失去應變並鬆弛到 R 狀態。因此,透過穩定通常緊張的 T 狀態,BPG 使血紅蛋白不太可能為了釋放應變而結合氧氣。這種機制是必要的,因為血紅蛋白的 T 狀態非常不穩定,平衡非常強烈地有利於 R 狀態,幾乎沒有氧氣被釋放。換句話說,純血紅蛋白與氧氣結合非常緊密。因此,需要 2,3-BPG 來穩定 T 狀態。由於 BPG 降低了血紅蛋白對氧氣的親和力,因此它是血紅蛋白的變構抑制劑。如果沒有 2, 3-BPG,血紅蛋白將是將氧氣從肺部運輸到組織的極其低效的運輸者,僅釋放其氧氣含量的約 8%。然而,在存在 2,3-BPG 的情況下,血紅蛋白四聚體中必須填充更多的氧氣結合位點,才能從 T 狀態轉變為 R 狀態。為了使血紅蛋白從低親和力 T 狀態轉變為高親和力 R 狀態,必須達到更高的氧氣濃度。
2,3-BPG 的結合還有其他生理後果。胎兒血紅蛋白比母體血紅蛋白具有更高的氧氣結合親和力。胎兒紅細胞比母體紅細胞對氧氣具有更高的親和力,因為胎兒血紅蛋白不像母體血紅蛋白那樣能很好地結合 2,3-BPG。這種氧氣親和力差異的結果是氧氣能夠有效地從母體紅細胞轉移到胎兒紅細胞。
**pH值** 或溶液中的質子濃度是血紅蛋白的另一個變構調節劑。有趣的是,pH值既可以作為變構啟用劑,也可以作為抑制劑,這取決於pH值變化的方向。例如,當pH值下降時,血紅蛋白對氧氣的親和力也會下降。這是因為質子有助於在血紅蛋白的T狀態下構建鹽橋。一般來說,血紅蛋白的T狀態受三個形成兩個鹽橋的氨基酸的青睞;其中一個鹽橋需要一個額外的質子才能成功形成。因此,溶液中質子濃度越高(或pH值越低),該鹽橋就越容易形成。更好的鹽橋形成會導致更好的、更穩定的T狀態,如前所述,更穩定的T狀態意味著血紅蛋白對氧氣的親和力下降。由於較高的質子濃度對應於較低的pH值,這意味著pH值越低,T狀態就越穩定。最終,T狀態越穩定,血紅蛋白分子對氧氣的親和力就越低;因此,當pH值下降時,pH值起著血紅蛋白變構抑制劑的作用。因此,當pH值升高時,會發生相反的效果。這將意味著較低的質子濃度,意味著更難形成鹽橋,因此形成速度較慢且不太穩定的T狀態。不太穩定的T狀態更容易與氧氣結合;因此,pH值升高會導致血紅蛋白對氧氣的親和力增加。結果是,當pH值升高時,pH值起著血紅蛋白變構啟用劑的作用。 
**二氧化碳** 或CO2 也是血紅蛋白的另一種變構抑制劑。造成這種情況的原因有很多。首先,**碳酸酐酶** 可以幫助二氧化碳與水反應生成碳酸,碳酸會解離成碳酸氫根和質子。因此,在存在足夠多的碳酸酐酶的情況下,二氧化碳會導致溶液pH值下降,因為其與水反應會產生大量的質子。如前一段所述,更多的質子意味著更低的pH值,進而意味著血紅蛋白對氧氣的親和力下降。二氧化碳還會中和血紅蛋白氨基末端(氨基通常以其質子化形式存在於生物系統中)的正電荷。這種電荷中和會導致負電荷的氨基甲酸酯基團的產生,這些基團會形成鹽橋,導致血紅蛋白T狀態的穩定,進而導致對氧氣的親和力下降。因此,二氧化碳是一種有效的血紅蛋白變構抑制劑。
波爾效應
[edit | edit source]波爾效應是指血紅蛋白的一種性質,即在較低的pH值(更酸性的環境)下,血紅蛋白對氧氣的結合親和力會下降。由於二氧化碳與血液中質子濃度直接平衡,血液中二氧化碳濃度升高會導致pH值下降,最終導致血紅蛋白對氧氣的親和力下降。
**生理作用** 波爾效應有助於氧氣運輸。血紅蛋白在肺部與氧氣結合,並在組織中釋放氧氣,主要釋放給最需要氧氣的組織。當組織的代謝率升高時,其二氧化碳產生量也會升高。二氧化碳透過以下反應生成碳酸氫根:
- CO2 + H2O H2CO3 H+ + HCO3−
該反應通常進行得很慢。在碳酸酐酶的幫助下,紅細胞中碳酸氫根和質子的形成加速。這會導致組織的pH值下降,並促進氧氣從血紅蛋白中解離到組織中,從而使組織獲得足夠的氧氣以滿足其需求。相反,在肺部,氧氣濃度很高。氧氣的結合會導致血紅蛋白釋放質子,質子與碳酸氫根結合,驅使二氧化碳在呼氣時排出體外。由於這兩個反應密切匹配,血液的pH值變化很小。


2,3-二磷酸甘油酸(BPG)與血紅蛋白結合並影響氧氣結合:BPG結合在血紅蛋白T狀態的中心腔中。BPG的陰離子基團位於Hb鍵和兩個β亞基的N末端氨基之間的離子配對距離內。BPG僅與T狀態的血紅蛋白結合並使其穩定。這將T R平衡向T狀態移動,從而降低了O2的結合親和力。BPG對我們體內O2的運輸非常重要。一個例子是高海拔適應。高海拔會導致紅細胞中合成的BPG數量迅速增加。BPG數量增加會使氧氣結合曲線從海平面位置移至較低的親和力位置(向右移動)。這會減少肺部對O2的結合量,但更大程度上會增加組織中釋放的O2量。因此,血紅蛋白可以將更多O2從肺部輸送到組織。
鐮狀細胞會使運輸氧氣到心臟和身體各部分的血紅蛋白細胞改變形狀。這使得運輸過程不順利,並會導致疾病。
鐮狀細胞性貧血
[edit | edit source]影響許多人血紅蛋白功能的一種疾病是鐮狀細胞性貧血,這種疾病是由氨基酸序列中第6位氨基酸的穀氨酸被纈氨酸取代引起的。症狀發生在個人幾個月大的時候。鐮狀細胞性貧血的特徵是呼吸急促、生長發育遲緩、發燒、黃疸、心跳加速以及許多其他疾病。問題在於這些人的血紅蛋白髮生了突變。這種突變形式的血紅蛋白被稱為血紅蛋白S,其溶解度低於正常血紅蛋白形式。對血紅蛋白S結構的檢查表明,新的纈氨酸殘基位於T狀態分子的表面。由於這種改變,脫氧血紅蛋白在其表面具有疏水性斑塊。疏水性斑塊與其他疏水性斑塊相互作用,導致分子聚集形成鏈,這些鏈排列成不溶性纖維。由於這種突變形式在血液中積累時不能自由移動,因此它們最終會在輸送氧氣時破壞或扭曲紅細胞的形狀。紅細胞最終會變成鐮刀形或新月形。這些受影響的細胞在透過身體迴圈輸送氧氣的效率要低得多。它們很容易在較小的血液流動區域阻塞,導致血液流動中斷。鐮狀細胞性貧血不應與血友病混淆,血友病是一種人體不能形成血栓的疾病。如果沒有得到適當的治療,患有這種疾病的人通常會在20到40歲之間死於器官衰竭。更好的技術和關於這種疾病的資料導致了治療方法的出現,這些方法包括葉酸補充劑,這些補充劑可以啟用新的健康紅細胞的生成。治療必須持續進行,目的是限制疼痛和緊急情況的數量。總體免疫系統也會受到這種疾病的影響,因此人們經常服用抗生素和疫苗來防止生病。
鐮狀細胞性貧血是遺傳的,只有父母雙方都患有這種疾病,孩子才會患上鐮狀細胞性貧血。大約每12個非洲裔美國人中就有1人具有這種特徵。鐮狀細胞性貧血高發地區與瘧疾高發地區之間存在顯著相關性。患有鐮狀細胞性狀的人對瘧疾有抵抗力,因為攜帶這種疾病的寄生蟲在其生命中的某個階段需要生活在紅細胞中,而它無法在鐮狀細胞中存活。因此,由於自然選擇,隨著時間的推移,患有鐮狀細胞性貧血的人數增加了,因為在瘧疾還沒有治癒方法之前,大多數感染瘧疾的人都會死亡。現在可以在懷孕期間診斷出鐮狀細胞性貧血。建議患者多喝水、吸入足夠的氧氣、對感染迅速做出反應。應避免劇烈的體力活動,應避免吸菸,也應避免過度暴露在陽光下。鐮狀細胞性貧血的嚴重後果無疑包括死亡,但其他後果包括失明、脾臟功能障礙、組織壞死、中風和急性胸痛。以下是健康紅細胞與受鐮狀細胞性貧血影響的紅細胞的對比圖片。
地中海貧血
[edit | edit source]就像鐮狀細胞性貧血是單個氨基酸的差異一樣,地中海貧血也是一種遺傳性疾病,會導致血紅蛋白鏈的減少或缺失。這會導致血紅蛋白水平降低,患有這種疾病的人會患上貧血、疲勞、皮膚蒼白以及脾臟和肝臟功能障礙。地中海貧血分為兩種型別:α-地中海貧血和β-地中海貧血。在α-地中海貧血中,血紅蛋白的α-螺旋供應不足。這使得血紅蛋白對氧氣的親和力很高,沒有協同作用,因此氧氣在組織中的釋放很差。這是由於16號染色體上的4個等位基因的破壞造成的,這種情況比較罕見。在β-地中海貧血中,β-鏈供應不足。額外的α-螺旋會聚集並在紅細胞內沉澱,導致貧血。β-地中海貧血是由11號染色體上兩個等位基因的破壞引起的。
一氧化碳中毒
[edit | edit source]一氧化碳(CO)是一種危險的氣體,因為它無色無味。一氧化碳的來源包括執行的汽車和燃氣裝置。吸入後,它會與氧氣在相同的部位結合,並會對人體吸收氧氣的能力產生負面影響。一氧化碳與血紅蛋白的結合能力是氧氣的200倍。即使在低分壓下,一氧化碳也會阻止血紅蛋白將氧氣輸送到體內。一旦一氧化碳與血紅蛋白的一個部位結合,血紅蛋白就會轉變成R狀態,這會增加氧氣的親和力,並防止氧氣在組織中解離。
一氧化碳中毒的治療包括在較高分壓下吸入100%的氧氣。由於壓力較高,這將使大多數一氧化碳從血紅蛋白中置換出來。
吸入 100% 的氧氣有助於減少 COHb(一氧化碳血紅蛋白)的半衰期,COHb 是紅血球中 CO 和血紅蛋白形成的穩定複合物,CO 的存在會導致這種複合物的形成。測量紅血球中 COHb 的水平可用於確認是否接觸過 CO,並評估中毒的嚴重程度。對於非吸菸者,COHb 水平超過 2% 被認為是升高的;對於吸菸者,則超過 9%。
CO 會取代血紅蛋白中的氧氣,從而切斷組織和細胞的氧氣供應,這會導致成年人出現神經系統問題,兒童出現學習障礙和發育問題,以及孕婦流產。
CO 中毒的症狀並不明顯,包括頭痛、頭暈、噁心、疲勞和虛弱。這些症狀可能被誤診為食物中毒、流感、偏頭痛或藥物濫用。
CO 中毒主要有兩種型別:急性中毒,由短時間內暴露於高濃度 CO 中引起;慢性或亞急性中毒,由長時間內暴露於低濃度 CO 中引起。
CO 中毒對人體系統的影響
- 神經系統:中樞神經系統抑制,輕度病例會導致頭痛、頭暈,嚴重病例會導致昏迷、癲癇發作。
- 心臟:心肌功能下降、血管擴張,以及心肌氧氣輸送和利用減少,會導致胸痛、低血壓、心率加快。
- 代謝:輕度病例出現過度換氣,嚴重病例出現代謝性酸中毒。
- 肺:急性病例中 10-30% 會出現肺水腫。
- 多器官功能衰竭:發生在高濃度 CO 中毒的情況下。
胎兒血紅蛋白是主要的氧氣運輸蛋白。它在發育的最後 7 個月內產生,並在出生後 8 個月內保持。
胎兒血紅蛋白
[edit | edit source]
胎兒從母體的肺部獲取氧氣。母體血液中的氧氣附著在紅血球中的血紅蛋白分子上,並在胎盤處擴散到胎兒的血液中。當血液到達胎兒時,壓力會低很多,這對於正常的成年人來說是不夠的。
在整個胎兒形成過程中,會產生三種不同型別血紅蛋白,後一種血紅蛋白會使其前一種血紅蛋白失活。所有三種類型都具有相同的血紅素分子和鐵原子,但在結構上略有不同。在前八週,大部分血紅蛋白是一種稱為胚胎血紅蛋白的型別。血紅蛋白的產生隨後由胎兒血紅蛋白(**血紅蛋白 F**)接管。它是胎兒發育過程中表達的主要血紅蛋白形式。血紅蛋白 F 在受孕後幾周出現,直到出生後幾個月才消失。在懷孕的第 35 周左右,成人血紅蛋白(**血紅蛋白 A**)開始產生。最終,血細胞中只包含血紅蛋白 A,這是人類一生中唯一產生的血紅蛋白。
成人血紅蛋白和胎兒血紅蛋白之間的結構差異
從結構上看,成人血紅蛋白由 4 個血紅素基團、2 個**α**鏈和 2 個**β**鏈組成。胎兒血紅蛋白(也稱為血紅蛋白 F)也由 4 個血紅素基團、2 個**α**鏈和 2 個**γ**鏈組成。γ 鏈被稱為 γ 亞基,與成人血紅蛋白的 β 鏈同源。此外,胎兒血紅蛋白和成人血紅蛋白在 2,3-BPG 結合位點附近存在差異。2,3-BPG 與胎兒血紅蛋白的脫氧形式的結合程度不如與成人血紅蛋白的脫氧形式的結合程度。
此外,另一種稱為血紅蛋白 A2 的血紅蛋白,由兩個**α**和兩個**δ**珠蛋白鏈組成,在兒童期和成年期以少量產生。血紅蛋白 A2 佔血紅蛋白總量的 2-3% 左右。
血液興奮劑
[edit | edit source]還有一種激素可以誘導紅血球產生增加。促紅細胞生成素是一種糖蛋白激素,它控制紅細胞生成,也稱為紅血球產生。它是一種紅細胞前體在骨髓中的蛋白訊號分子(細胞因子)。這種激素由腎臟的間質成纖維細胞和肝臟的竇周細胞產生。
參考文獻
[edit | edit source]生物學,第八版。皮爾遜,本傑明·卡明斯,2008 年。
伯格,傑里米。生物化學。第 7 版。W.H. 弗里曼公司,2011 年。
大衛·海姆斯,尼格爾·胡珀。生物化學。第三版。紐約。泰勒和弗朗西斯集團,2005 年。
http://www.mdconsult.com/das/article/body/305467842-2/jorg=journal&source=&sp=20829759&sid=0/N/818895/s0735675707006584.pdf?issn=0735-6757 http://www.testbreath.com/carbon_monoxide_in_breath.asp https://www.atsdr.cdc.gov/toxprofiles/tp201-c7.pdf http://obitet.gazi.edu.tr/makale/makale/internalcombustionengines/060.pdf http://www.physio-control.com/uploadedFiles/learning/clinical-topics/Detecting%20Carbon%20Monoxide%20Poisoning%20in%20the%20Emergency%20Dept.pdf http://sickle.bwh.harvard.edu/hbsynthesis.html



