結構生物化學/分子幾何
分子幾何
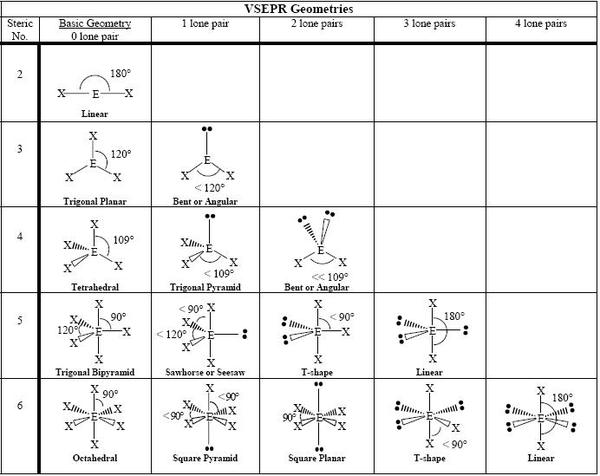
分子幾何是指分子在空間中佔據的三維形狀。它由中心原子和周圍原子以及電子對決定。大多數分子的形狀可以使用價層電子對互斥 (VSEPR) 方法預測。該方法提出了一些規則,可以幫助人們在不使用 X 射線晶體學、核磁共振波譜法或電子顯微鏡等高科技方法的情況下確定物質的形狀。一些最常見的形狀包括線性、三角平面、四面體、錐體和角形(或彎曲)。
價層電子對互斥 (VSEPR) 理論:中心原子周圍的電子對會以儘可能遠地彼此分離的方式排列。價層是原子最外層被電子佔據的殼層,它容納了參與鍵合的電子。在共價鍵中,一對電子被兩個原子共享。在多原子分子中,幾個原子使用兩個或多個電子對與中心原子鍵合。鍵閤中的負電荷電子對或孤對之間的排斥會導致它們儘可能地散開。 "電子對排斥 "的概念可以透過將幾個充氣的氣球系在一起來演示。每個氣球代表一個電子對。氣球會試圖減少擁擠,並儘可能地分散開來。根據 VSEPR 理論,可以透過從中心原子周圍的電子對幾何形狀開始,並向一些或所有電子對新增原子來預測分子幾何形狀。該模型對於簡單分子產生了與實驗測定結果非常一致的結果。有了這個模型,就可以用系統的方式確定分子幾何形狀。然後可以將分子分為兩組:第一組:沒有孤電子對的分子。在這種情況下,分子幾何形狀與電子對幾何形狀相同。第二組:具有一個或多個孤電子對的分子。在這種情況下,需要一個額外的步驟來將電子對幾何形狀轉換為最終的分子幾何形狀,因為在分子幾何形狀中只考慮了鍵合原子的位置。
VSEPR 理論指出
1) 中心原子周圍的電子對和原子將賦予分子其形狀。
2) 分子中中心原子周圍的電子對會盡量彼此遠離。
3) 中心原子周圍的孤對會對整個分子的形狀產生影響,就像原子一樣。
4) 孤對電子之間的排斥力比孤對和共享對之間的排斥力更強,而孤對和共享對之間的排斥力又比兩個共享對(或中心原子與另一個原子之間的鍵)之間的排斥力更強。
這些只是 VSEPR 理論的一些基本假設,這些假設與分子的路易斯點結構一起,使我們能夠確定其將具有的形狀。
許多有機化合物含有碳原子或其他原子(如氧或氮)的環。最簡單的環狀化合物包含 3 個碳原子,如環丙烷。最常見的環狀化合物包含 5 個或 6 個碳原子。這些化合物也被稱為環狀化合物。
由 4 個等距的 sp3 雜化軌道構成的分子,形成大約 109.5o 的鍵角。軌道的形狀是四面體。兩個軌道包含孤對電子。連線到中心原子的兩個原子形成一個具有彎曲形狀的分子。
原子雜化與其幾何形狀之間存在著簡單的關係,即其他原子如何在空間中圍繞它排列。本模組考察了代表元素 B、C、N、O 和 F 的允許鍵合模式,以及它們的幾何形狀與其雜化和形式電荷的關係。
**尋找雜化** 對於分子的雜化:1. 計算價電子總數 2. 除以 8,如果 e- 數量 > 8。除以 2,如果 e- 數量 ≤ 8。
分子的幾何形狀決定了許多性質,如極性、反應活性、狀態等等。極性與形狀直接相關,因為許多具有極性鍵的分子由於分子的對稱性而可能成為非極性分子,這種對稱性具有相等的向外或向內電子拉力。二氧化碳就是一個例子。碳的兩側都有負電性的氧原子,氧原子將原子拉向自己,導致每個末端出現部分負電荷,而負電性較低的碳則帶部分正電荷。氧原子都與碳雙鍵,沒有孤對電子使分子彎曲,分子是線性的,鍵角為 180 度。由於部分負電荷的大小相等且方向完全相反,因此兩個部分負電荷的拉力相互抵消,整個分子是非極性的。

另一方面,一個分子可以具有極性鍵和不同的形狀,這種形狀不能平衡負電性的拉力。例如,過氧化氫分子,它也含有三個原子,但形狀不同。水是四面體形狀的彎曲形狀,因為它有兩個額外的電子對,它們將氫原子推到 109.5 度角。因此,氧原子上的部分負電荷在兩側平衡,但指向向上和向內,使整個分子具有極性。

反過來,極性本身會影響許多性質,如熔點、沸點、蒸氣壓、溶解度以及可以形成的鍵的型別,這只是一些例子。極性分子由於分子之間的吸引力而具有更高的熔點和沸點以及更低的蒸氣壓。極性分子也往往溶解其他極性分子,而非極性分子也溶解其他非極性物質。這通常被稱為 "相似相溶",這是一種記憶這種性質的簡便方法。
分子幾何形狀決定的另一個性質是反應活性。反應活性在許多方面受到影響。一個例子是分子根據極性形成的鍵的型別。例如,一些極性分子可以在氫鍵中反應,而非極性分子可以在倫敦色散力中反應。但還有其他一些方法,即幾何形狀直接影響分子參與的反應部位。體積大的分子通常使用未受阻礙的一側反應,即使它不是最有利的產品,因為反應更容易。另一個例子是酶及其根據自身的形狀和底物的形狀 "適應" 特定的底物的方式。這些只是分子形狀如何幫助確定反應活性的眾多例子中的兩個例子。

雖然 VSEPR 和一些類似的方法可以用來確定分子的幾何形狀,但有一些高科技方法可以毫無疑問地顯示出我們比以往更大分子(通常是蛋白質)的形狀。這些方法包括 X 射線晶體學、核磁共振波譜法和電子顯微鏡。X 射線晶體學由於波長非常接近原子間鍵的波長,因此具有非常高的解析度,因此是最好的方法之一。
該方法的第一步是將蛋白質轉化為晶體,這可以透過新增某些鹽來實現,這些鹽會使大分子結晶。一旦蛋白質以晶體形式存在,就會用X射線束照射它,並觀察光線的變化。一些光會被吸收,一些會被散射,一些會被衍射。所有射線都被仔細研究,它們的資訊,例如振幅,為生物化學家提供了有關分子中原子資訊的。

另一種技術叫做核磁共振譜,它允許在蛋白質結構被轉化為晶體之前進行研究。它是少數幾種允許在溶液中研究物質的方法之一,通常在CDCl3中。由於元素的磁共振,常用的兩種NMR是質子NMR和碳NMR。對於H-NMR,當一個分子暴露在磁場中並且質子被激發並排成一行時,可以觀察到四件事,它們告訴我們每個相同質子組的環境。化學位移(訊號下移多少)告訴我們哪些官能團包圍了質子。訊號積分給我們一個比例,比較了每個家族中質子的數量。分裂(一個訊號中峰的數量,例如雙峰、三峰等)告訴我們有多少個鄰近的氫原子。最後,訊號的數量本身告訴我們有多少個不同的質子家族。C-NMR的工作方式相同,除了積分,在C-NMR中積分並不總是像在H-NMR中那樣清晰。所以所有這些資訊都收集在一個分子中,它的精確連通性通常可以確定,即使它是一個未知的分子。

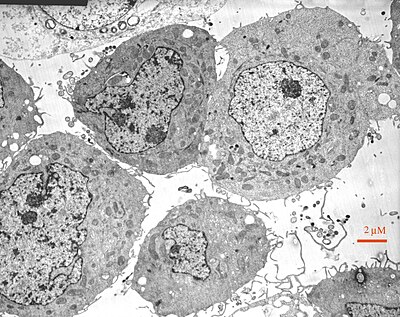
第三種方法是電子顯微鏡,它使用電子顯微鏡,電子顯微鏡發射電子束。電子束照射大分子,然後在熒光或照相膠片上生成分子及其結構的影像供我們觀察。有時它們甚至直接傳送到螢幕上,比如電腦螢幕。這張影像是黑白的,但仍然非常有用,可以用來確定結構。
來源
http://chem-guide.blogspot.com/2010/04/valence-shell-electron-pair-repulsion.html
http://www.rcsb.org/pdb/101/static101.do?p=education_discussion/Looking-at-Structures/methods.html
Berg, Tymoczko, 和 Stryer 編著的《生物化學》第六版
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Molecular_Geometry
