結構生物化學/蛋白質功能/抗體
抗體是一種蛋白質,由動物在體記憶體在外來物質(稱為抗原)時合成。它們在免疫系統中起著重要作用,通常存在於血液和其他體液中。抗體由白細胞或更具體地說由 B 細胞產生。有五種抗體亞型,每種都起著自衛作用,以抵抗我們體內的外來物體。抗體是對抗原的反應產生的,這些抗原包括但不限於外來蛋白質、多糖和核酸。抗體識別抗原的一個小部分,稱為抗原決定簇或表位。每種抗體都以鎖鑰模型識別並結合特定的抗原。鑑於抗原數量眾多,抗體的選擇也同樣多樣。
抗體是 γ 球蛋白,其氨基酸鏈上連線有糖基。它們可以被歸類為 **糖蛋白**。最基本的形式是免疫球蛋白單體,它只有一個免疫球蛋白單位。抗體也可以以二聚體形式出現,具有兩個免疫球蛋白單位,四聚體形式具有四個免疫球蛋白單位,甚至五聚體形式具有五個免疫球蛋白單位。
**免疫球蛋白 G** 是最常見的抗體型別,由 4 條鏈組成。有 2 條輕鏈和 2 條重鏈。兩條重鏈透過二硫鍵 (S-S) 結合在一起,兩條輕鏈透過二硫鍵結合到重鏈上。它們共同形成了一個大致的 Y 形。
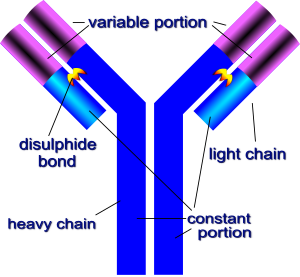
在 Y 形免疫球蛋白的頂部有兩個識別並結合抗原的位點。**免疫球蛋白 G (IgG)** 具有相同的通用結構,僅在抗原結合位點有所不同。該區域稱為 **可變區 (V)**,由高變環組成。這些高變環賦予抗原結合位點極大的多功能性,使其能夠結合多種不同的抗原。**可變區 (V)** 構成兩個相同的抗原結合位點,在每種特定型別的抗體中都不同,使這些位點具有特定的形狀,適合某些抗原表位。該分子的其餘部分由輕鏈和重鏈 **恆定區 (C)** 組成,其中這些氨基酸序列在不同抗體之間變化很小。
抗體透過兩個過程獲得其多樣性。第一個階段稱為體細胞或 V(D)J,代表可變、多樣化和連線區域,重組。在三個區域中的每一個區域中都位於幾組基因。在細胞成熟過程中,B 細胞將從每個區域的多個基因中剪接除一個基因之外的所有基因,並將剩餘的三個基因組合在一起以形成一個 VDJ 片段。該片段與一個恆定區域基因一起,構成了隨後抗體產生的基礎。據估計,考慮到三個區域中每個區域的變異數量,大約可以產生 10,000-20,000 個獨特的抗體。
重組的第二階段發生在 B 細胞被抗原啟用後。當抗原與 B 細胞結合時,B 細胞將開始快速繁殖。在此分裂過程中,基因的可變區域將經歷快速突變,稱為體細胞超突變。這種超突變有助於微調抗體與抗原的結合。對抗原具有更強親和力的細胞將收到更強的增殖訊號,導致逐漸選擇對抗原結合最強的抗體。
在 IgG 中,重鏈有四個亞基,CH3、CH2、CH1(恆定部分)和 VH(可變部分)。輕鏈有兩個亞基,CL 和 VL。兩個 CH3 單位直接連線,而 CH2 單位透過寡糖分離。CH1 位於重鏈的 “鉸鏈” 處,透過二硫鍵與 CL 單位連線。
由於抗體可以產生數千種變異,因此產生不能正確摺疊或無法正常發揮作用的抗體的可能性很高。因此,摺疊是抗體生產中非常重要的一步,抗體生產高度依賴於 **內質網 (ER)** 的 “質量控制” 機制。重鏈和輕鏈分別合成並在翻譯過程中轉運到內質網;它們在翻譯完成之前就開始摺疊。
**Ig 摺疊** 是一種高度保守的蛋白質拓撲結構,其在自然界中廣泛存在,以至於賦予 **Ig 超家族 (IgSF)** 以其名稱,該家族包含含有 Ig 摺疊的蛋白質。Ig 摺疊由兩個反平行 β 摺疊組成,總共包含 7 到 9 個 β 鏈,形成類似三明治的結構。通常,Ig 摺疊透過連線兩個 β 鏈並垂直於這些鏈本身執行的內部二硫鍵穩定。IgG 的兩個可變區域和一個恆定區域都包含 Ig 摺疊。Ig 摺疊形成過程中的一個重要步驟是脯氨酸異構化。雖然大多數肽鍵具有 *反式* 構象,但脯氨酸的環狀結構意味著它在 *順式* 構象中只有略微不穩定,並且可以以這種構象存在於自然界中。在 Ig 摺疊中的兩個 β 鏈之間存在一個脯氨酸殘基,並且該殘基從 *反式* 到 *順式* 構象的異構化通常是 Ig 摺疊形成的限速步驟。
雖然最終結構通常非常相似,但 Ig 結構域可以根據其摺疊過程大致分為三類。
在第一類中,結構域在內部二硫鍵的引導下自主摺疊,最終狀態為單體。在展開的多肽及其天然摺疊狀態之間存在一個主要中間體。該中間體持續存在一段明顯的時間,因為它包含一個 *順式* 脯氨酸殘基,而在最終的摺疊狀態中,該殘基為 *反式*,並且從 *順式* 到 *反式* 的轉變相對緩慢。中間體的中心 β 鏈幾乎完全摺疊,小的螺旋連線兩對鏈,使該中間體高度穩定。中間體高度穩定的原因是,小的螺旋在抗體中充當組織中心,它們將體積大的疏水分子定位在蛋白質的中心。這些螺旋最常見於恆定結構域中,而不是在可變結構域中或在容易錯誤摺疊的免疫球蛋白分子中,這表明這些內部連線是抗體摺疊的關鍵。此類別中蛋白質結構域的例子包括輕鏈的恆定區域 (CL) 和 IgG 的重鏈的第二個恆定區域 (CH2)。
第二類摺疊方式類似於第一類:它形成一個部分摺疊的單體,具有一個 *反式* 脯氨酸殘基,然後異構化為一個 *順式* 殘基。此時,該結構域無法完成摺疊,除非它與自身二聚化。該結構域的代表是 IgG 的重鏈的第三個恆定區域 (CH3)。在完全形成的 IgG 中,兩個重鏈在該結構域處直接連線(與 CH2 不同,CH2 由糖分離),因此它透過此過程摺疊是有意義的。
第三類與前兩類有更大的區別。IgG 的重鏈的第一個恆定區域 (CH1) 無法自主摺疊,必須與已摺疊的 CL 結合,形成二聚體中間體。與其他兩類一樣,摺疊結構域包含一個 *反式* 脯氨酸殘基,必須在摺疊完成之前變為 *順式*。與其他兩個過程不同,這種異構化在 CH 與 CL 結合之前無法發生。這導致 CH1 摺疊成為所有 IgG 結構域中最慢的摺疊;它只有在重鏈和輕鏈已經結合在一起後才會發生。
每種抗體的摺疊的一個共同點是緩慢的脯氨酸異構化反應,即從反式脯氨酸到順式脯氨酸的轉化。該反應的活化能非常高(約 80 kJ/mol),這使其成為非常緩慢的反應。由於這個事實,脯氨酸異構化反應充當抗體摺疊的限速步驟。在這三個類別中的每一個類別中,都存在非常重要的過渡態。限速脯氨酸異構化反應允許反應進行得更慢,並使過渡態被填充,因為脯氨酸必須處於順式構象才能在摺疊過程中繼續進行。
B 細胞在產生抗體時會經過一系列的“質量檢測”以確保抗體的功能性。在 pre-B 細胞狀態下,重鏈上所有結構域的摺疊都會被檢測。重鏈基因重排後,pre-B 細胞會產生 IgM,一種不含輕鏈的短重鏈,並與免疫球蛋白重鏈結合蛋白 (BiP) 結合。BiP 結合於未摺疊的 CH1 結構域,該結構域是重鏈恆定區的一部分。然後,pre-B 細胞會產生一種“替代”輕鏈,該輕鏈來自 pre-B 細胞的變異區。如果替代輕鏈能夠誘導 BiP 與 IgM 解離,並且 CH1 結構域能夠正確摺疊,那麼重鏈就會移至質膜。如果該質量檢測失敗,IgM 就會作為內質網相關降解 (ERAD) 的底物。因此,該質量檢測失敗會導致重鏈降解。當重鍊形成,並形成常規輕鏈時,與之前相同的過程會重複進行,常規輕鏈充當替代輕鏈。常規輕鏈必須誘導 BiP 從 CH1 結構域解離,並允許重鏈 CH1 結構域摺疊,以防止抗體進行 ERAD。一旦重鏈和輕鏈通過了這兩項質量檢測,重鏈和輕鏈之間就會形成二硫鍵,抗體隨後就可以分泌。
其他狀態
[edit | edit source]與大多數蛋白不同,大多數蛋白可以簡單地認為存在於特定的摺疊形式或變性多肽形式中,而抗體能夠在特定條件下形成一些替代結構。例如,在 pH 3 以下,抗體可以存在於一種穩定的形式中,與它們的典型形式不同。雖然這不太可能直接導致任何人類健康問題(血液 pH 值為 3 會在錯誤摺疊的抗體引起任何問題之前就致命),但它會對抗體生產產生影響。工業抗體生產包括在低 pH 值下進行的步驟,這可能會影響最終產品的生產。
另一個與抗體替代狀態直接相關的問題是,輕鏈或截斷的重鏈從 B 細胞中分泌出來,卻沒有形成完整的抗體。這些片段會聚集並沉積在各種器官中,從而抑制其功能。這種沉積最常見的致命併發症是輕鏈澱粉樣變性,其中單克隆輕鏈被產生、分泌,並在腎臟中形成沉積物。輕鏈的變異區更容易形成澱粉樣沉積物,這可能是因為其結構需要高度變異,使其更容易逃逸細胞,而不被檢測到錯誤。
功能
[edit | edit source]抗體功能
- 結合外來物體並阻止它們攻擊正常細胞
- 在巨噬細胞的幫助下,可以幫助清除病原體
- 可以透過啟動補體途徑(另一種免疫反應)來直接損傷病原體。
抗體功能的一個例子是血型。例如,血型為 A 的人會產生識別 B 抗原的抗體。如果一個血型為 A 的人接受了血型為 B 或血型為 AB 的輸血,識別這些血細胞上的 B 抗原的抗體會導致該人開始凝血。這種現象解釋了為什麼 AB 型血的人可以接受 A 型或 B 型血的輸血,但 A 型或 B 型血的人不能接受 AB 型血的輸血。當血液捐獻量不足,需要為醫療目的找到匹配血液時,通常會出現這種情況。
五種主要的抗體類別
1)IgM
a.這是一種在首次接觸抗原後產生的抗體類別,但之後,其在血液中的濃度會開始下降。免疫球蛋白可以中和抗原,並負責抗原的凝集。因此,它在補體啟用方面非常有效。
b.IgM 是一種五聚體。它含有 µ 重鏈,並與另一種稱為 J 鏈的多肽一起以五聚體的形式存在,J 鏈負責啟動聚合以形成五聚體結構。由於 IgM 具有大量的抗原結合位點,因此每個 IgM 分子可以非常緊密地結合到其表面上具有多個相同抗原複製的任何病原體上。這種結合會誘導 Fc 區啟用補體途徑,最終導致病原體死亡。IgM 還會啟用巨噬細胞以吞噬病原體。考慮到這些功能,IgM 是動物對新抗原產生反應時首先產生的抗體,這並不令人意外。
2)IgG
a.這種抗體類別存在於組織液中。它是初次免疫反應後期和繼發免疫反應期間血液中最豐富的類別。IgG 促進抗原的中和、凝集和調理,也是唯一能夠穿過胎盤的抗體類別。它分泌到母乳中,並被新生動物從腸道吸收進入血液,因此它為胎兒提供了被動免疫。
b.IgG 是一種單體。
3)IgA
a.IgA 透過中和抗原以及凝集來防禦黏膜。這種抗體存在於唾液、眼淚、母乳、黏液以及肺部和腸道的分泌物中。母乳中的 IgA 也為哺乳嬰兒提供了被動免疫。
b.IgA 是一種二聚體。
4)IgE
a.當 IgE 被觸發時,肥大細胞、嗜鹼性粒細胞會釋放組胺和其他引起過敏反應的化學物質。IgE 存在於組織中,在那裡它會結合抗原。其中一些會反過來啟用白細胞(稱為嗜酸性粒細胞)殺死各種型別的寄生蟲。然而,肥大細胞也會釋放具有生物活性的胺類,包括組胺,這會導致血管擴張和通透性增加,從而導致過敏反應(如花粉症和哮喘)的症狀。
b.IgE 是一種單體
5)IgD
a.在抗原刺激的 B 細胞增殖和分化中,IgD 作為抗原受體發揮作用。這種抗體類別存在於未接觸過抗原的幼稚 B 細胞的外部。
b.IgD 是一種單體。
此外,抗體被證明非常出色,因為它們可以阻斷體內特定的蛋白質合成,而不會傷害人體細胞。這是因為細菌和真核細胞的核糖體結構存在差異。細菌和人類核糖體的形狀有非常具體的差異,這在開發僅針對細菌核糖體以阻止其蛋白質合成的抗生素時非常方便。如果成功,抗生素應該結合並干擾細菌中蛋白質合成起始複合物的形成,或對細菌信使 RNA 的轉錄產生一些影響。試圖開發這些抗生素的科學家成功地利用了核糖體的這些結構差異,試圖創造出停止細菌核糖體功能而不影響其所在的人類的方法。例如,線粒體細胞含有類似於細菌的核糖體,而宿主線粒體的真核細胞則具有完全不同的核糖體結構。因此,抗生素可以靶向線粒體中類似細菌的核糖體,而不會損害真核細胞本身,這只是一個微不足道的例子,證明了結構和特異性在藥物開發中可以發揮的作用。[1]
抗病毒抗體
[edit | edit source]抗體靶向病毒的功能位點。抗體無法靶向功能位點通常會導致抗體無法抵抗病毒變異。如果無法靶向功能位點,則第二個目標應該是宿主分子(而不是病毒編碼的分子)。抗體與目標的天然配體越相似,抗體越有效。
產生雙特異性抗體
[edit | edit source]抗體治療是一種寶貴的疾病治療方法,部分原因是它們對靶蛋白的選擇性。然而,由於某些疾病具有多種不同的機制,因此存在一些缺點。雙特異性抗體 (BsAb) 創造了一種有趣的可能替代方法,具有更大的優勢。這些抗體可以有效地靶向兩個不同的結合位點。一些優勢包括逃避治療的可能性有限,腫瘤靶向性更高以及更有效的細胞毒性選擇性。BsAb 的主要缺點是生產難度大。透過單鏈可變片段雙特異性抗體、串聯雙特異性抗體、二合一抗體和雙可變結構域抗體等新技術已經出現在抗體生產中。儘管這些技術存在過於頻繁的給藥或偶聯問題。
CovX-Bodies 是一種基於醛縮酶催化抗體的技術。這使得能夠快速生成具有適當靶向性的所需抗體。CovX 體由兩個共價結合的藥效團組成。它們連線到支架抗體的 Fab 臂中第 93 位的賴氨酸上。它們是透過將支鏈氮雜環丁烷酮連線體與醛縮酶抗體中的肽藥效團異二聚體混合而產生的。肽負責功能活性,而抗體則起到改善半衰期和分佈特性的作用。這些抗體能夠以特定的結合親和力、效力和藥代動力學特性生成。CovX-Body,CVX-241 目前正在利用血管生成素-2 (Ang2) 和血管內皮生長因子 (VEGF)。該藥物在齧齒動物和非人靈長類動物中顯示出令人印象深刻的藥代動力學特性。異種移植模型顯示出有效的療效。CVX-241 正在完成 1 期臨床試驗。
參考文獻
[edit | edit source]- ↑ 美國國立衛生研究院,“細胞內部”,2005 年,第 10 頁
1. Buchner J, Feige M, Hendershot L. “抗體如何摺疊。” *生物化學趨勢。* **35** (4): 189-198.
2. Colman,Peter M. “新抗病毒藥和耐藥性”,Walter 和 Eliza Hall 醫學研究所
3. David Hames,Nigel Hooper。生物化學。第三版。泰勒和弗朗西斯集團,紐約,2005 年。
4. Venkata R. Doppalapudi 等人。“雙特異性抗體的化學生成。” *《美國國家科學院院刊》* **107** (52): 22611.full#ref-list-1。Richard A. Lerner。2010 年 11 月 9 日。CovX。2011 年 11 月 30 日。
