結構生物化學/蛋白質功能/結合位點
結合位點是蛋白質上的一個位置,它與一個相對較小的傳入分子(稱為配體)結合。
在蛋白質中,結合位點是三級結構上的小口袋,配體透過弱力(非共價鍵合)與之結合。只有少數殘基真正參與配體的結合,而蛋白質中的其他殘基則充當框架以提供正確的構象和取向。大多數結合位點是凹形的,但凸形和平坦的形狀也存在。
配體結合位點是蛋白質上的化學特異性和親和力位置,它與其他分子和離子或蛋白質配體結合或形成化學鍵。蛋白質和配體結合的親和力是蛋白質和配體之間的化學吸引力。因此,不同的配體可能競爭蛋白質的相同結合位點,化學反應將導致結合和非結合配體之間的平衡狀態。結合位點的飽和度定義為單位時間內被配體佔據的結合位點的總數。高親和力配體具有較高的分子間力,能夠停留更長的時間,因為它具有較低的濃度,並導致受體發生變化。
最常見的酶結合位點模型是誘導契合模型。它不同於更簡單的“鎖鑰”理論,因為誘導契合模型指出酶的底物不能完美地契合結合位點。“鎖鑰”模型假設底物是一個相對靜止的模型,它不改變其構象,只是完美地結合到活性位點。根據誘導契合模型,酶的結合位點與其對應底物的過渡態互補,而不是正常的底物態。酶透過使其 NH3+ 殘基穩定過渡態底物的負電荷來穩定這種過渡態。這導致完成預期反應所需的活化能急劇降低。然後,透過讓反應更快地達到平衡,底物被轉化為其產物。
蛋白質對我們的身體很重要。蛋白質是由肽鍵連線的氨基酸鏈。透過理解蛋白質功能,我們可以解決我們體內不同的問題,因為蛋白質是主要的生物成分之一。為了理解蛋白質功能,將有四個主要研究方向,例如:結構、結合、催化和轉換。然而,如果我們瞭解蛋白質結合,這些想法將更容易理解。蛋白質結合在生物化學中起著極其重要的作用。蛋白質結合通常是可逆的,可以根據其結構和活性而穩定或不穩定。此外,這也是蛋白質結合會影響藥物在體內生物半衰期的原因。事實上,許多科學家試圖對結合結構進行實驗和研究,以發現疾病及其破壞方法。
蛋白質結合和未結合分數(表示為未結合藥物濃度與藥物總濃度的比率),取決於幾個因素。它取決於藥物對蛋白質的親和力、結合蛋白的濃度以及藥物濃度與結合蛋白濃度的比率。
蛋白質結合對於血紅蛋白和肌紅蛋白也至關重要。血紅蛋白參與其他氣體的運輸。此外,它還攜帶一些身體的呼吸二氧化碳,其中 CO2 與珠蛋白結合。血紅蛋白表現出蛋白質三級結構和四級結構的特徵。血紅蛋白主要由蛋白質組成,這些蛋白質反過來又由氨基酸序列組成。肌紅蛋白存在於肌肉組織中,它是第一個被揭示其三維結構的蛋白質。儘管血紅蛋白存在於血液中,而肌紅蛋白存在於肌肉中,但它們透過功能以及氧氣的傳遞和運輸而相互聯絡。
互補性 分子識別取決於酶的三級結構,它在活性/結合位點創造獨特的微環境。這些特殊的微環境有助於結合位點催化。
靈活性 三級結構允許蛋白質適應其配體(誘導契合),並且對於生物化學功能的多樣性至關重要(靈活性程度因功能而異)。靈活性對於生物化學功能至關重要。
表面 結合位點可以是凹形的、凸形的或平坦的。對於小配體 - 裂縫、口袋或空腔。催化位點通常位於域和亞基介面。催化位點通常發生在域和亞基介面。
非共價力 非共價力也是結合位點的特徵。這些特徵是:高於平均水平的暴露疏水錶面(小分子 - 部分凹形和疏水),以及水的置換可以驅動結合事件,以及弱相互作用可以導致夥伴的輕鬆交換。
親和力 酶對底物的結合能力(可以繪製成底物的分壓增加與親和力增加的圖表)。
酶抑制劑是結合到酶並導致其活性降低的分子或化合物。抑制劑可以結合到酶並阻止底物進入酶的活性位點和/或阻止酶催化化學反應。抑制劑有兩種類別。
- 不可逆抑制劑
- 可逆抑制劑
抑制劑也可以天然存在,並參與代謝調節。例如,抑制劑引起的負反饋可以幫助維持細胞的穩態。其他細胞酶抑制劑包括特異性結合並抑制酶靶點的蛋白質。這對於消除有害酶(如蛋白酶和核酸酶)很有用。此外,許多不同的合成物質能夠抑制酶。例如,氟化膦酸酯(即沙林、VX)不可逆地結合到膽鹼酯酶,導致體內乙醯膽鹼積累。此外,藥物(如 MAOIs(單胺氧化酶抑制劑))可逆地結合到單胺氧化酶,允許單胺神經遞質的積累,這在治療某些疾病方面很有用。
competitive inhibition, the inhibitor and substrate compete for the enzyme (i.e., they can not bind at the same time).[58] Often competitive inhibitors strongly resemble the real substrate of the enzyme. For example, methotrexate is a competitive inhibitor of the enzyme dihydrofolate reductase, which catalyzes the reduction of dihydrofolate to tetrahydrofolate. The similarity between the structures of folic acid and this drug are shown in the figure to the right bottom. Note that binding of the inhibitor need not be to the substrate binding site (as frequently stated), if binding of the inhibitor changes the conformation of the enzyme to prevent substrate binding and vice versa. In competitive inhibition the maximal velocity of the reaction is not changed, but higher substrate concentrations are required to reach a given velocity, increasing the apparent Km.
不可逆抑制劑與酶共價結合,導致酶的活性位點發生化學變化,並且無法逆轉。不可逆抑制劑的主要作用包括修飾酶活性所需的關鍵氨基酸殘基。它們通常包含反應性官能團,如醛、烯烴或苯磺酸酯。這些親電子基團能夠與氨基酸側鏈反應形成共價加合物。氨基酸成分是包含親核側鏈(如羥基或巰基)的殘基,如絲氨酸、半胱氨酸、蘇氨酸或酪氨酸等氨基酸。
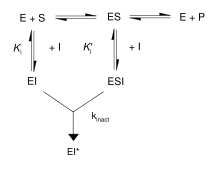
首先,不可逆抑制劑與酶形成可逆的非共價複合物(EI 或 ESI)。然後,這種複合物反應生成共價修飾的不可逆複合物 EI*。EI* 的形成速率稱為失活速率或 kinact。可以透過與底物或第二個可逆抑制劑競爭來阻止不可逆抑制劑的結合,因為 EI 的形成可能與 ES 競爭。
此外,一些可逆抑制劑可以透過與靶酶緊密結合形成不可逆產物。這些緊密結合的抑制劑表現出類似於共價不可逆抑制劑的動力學。如圖所示,這些抑制劑以低親和力 EI 複合物迅速結合到酶上,然後緩慢重排成非常緊密結合的 EI* 複合物。這種動力學行為被稱為慢結合。慢結合通常涉及酶在抑制劑分子周圍“閉合”的構象變化。它稍微改變形狀以容納底物,足以使反應在動力學上向前進行。這些慢結合抑制劑的一些例子包括重要的藥物,如甲氨蝶呤和別嘌呤醇。
基團特異性試劑
基團特異性試劑透過與氨基酸上的特定側鏈反應來失活酶。一個例子是碘乙醯胺與半胱氨酸側鏈反應,完全失活酶,並在此過程中產生 I- 和 H+ 離子。另一個例子是二異丙基氟磷酸 (DIPF) 透過與乙醯膽鹼酯酶中關鍵的絲氨酸側鏈反應來失活酶。
反應性底物類似物(親和標記)
親和標記對酶上的結合位點具有特異性。它們以底物的形式共價結合到活性位點,從而修飾關鍵的側鏈並抑制酶的活性。例如,溴乙醯磷酸在三磷酸甘油醛異構酶 (TPI) 的活性位點結合。共價鍵合抑制酶活性,因為活性側鏈(即穀氨酸)不再活躍。
機制型抑制劑(自殺抑制劑)
機制型抑制劑在初始底物已與酶結合並經過正常催化機制後才影響酶。催化通常會產生一箇中間體,該中間體共價抑制酶。
可逆抑制劑以非共價方式結合到酶上。根據酶的結構以及抑制劑結合到的位置,可能會發生許多不同型別的抑制。抑制劑和酶之間的非共價相互作用包括氫鍵、疏水相互作用和離子鍵。許多這些弱鍵組合起來產生強烈的特異性結合。與底物和不可逆抑制劑相反,可逆抑制劑在與酶結合時通常不會發生化學反應,並且可以透過稀釋或透析輕鬆去除。
可逆抑制劑有三種類型
1)競爭性
2)混合性
3)非競爭性/混合性
- **競爭性抑制劑**,顧名思義,與底物競爭同時結合到酶上。抑制劑對酶的活性位點具有親和力,底物也結合到該位點。這種抑制可以透過增加底物濃度來克服,以克服抑制劑。競爭性抑制劑的結構通常與底物相似。這些抑制劑會增加 Km。File:Competitive inhibitor.docx
氧陰離子孔穩定四面體中間體。它是透過將肽 NH 基團與帶負電荷的氧原子連線的氫鍵形成的。步驟 3:當底物羰基氧上的負電荷不穩定時,會導致四面體中間體坍塌,碳重新形成雙鍵,從而破壞碳與氨基酸基團之間的肽鍵。胺離去基團被 His57 質子化,促進其位移。步驟 4:胺組分從酶中分離(被身體代謝),完成第一階段(酶的醯化)。第一個產物已製成。步驟 5:新增一個水分子。步驟 6:一個進入的水分子被酸鹼催化去質子化,產生強親核性的氫氧根離子。氫氧根對醯化酶的酯鍵的攻擊產生第二個四面體中間體。步驟 7:四面體中間體的坍塌形成第二個產物,羧酸根陰離子,並置換 Ser195。步驟 8:羧酸被釋放,酶重新形成以催化下一個反應。
- **非競爭性抑制劑**與酶的底物同時結合到酶上。然而,抑制劑的結合會影響底物的結合,反之亦然。這種型別的抑制無法克服,但可以透過增加底物濃度來減少。抑制劑通常遵循變構效應,即它與酶上與底物不同的位點結合。這種與變構位點的結合會改變酶的構象,從而降低底物對活性位點的親和力。這些抑制劑會降低 Km 和 Vm。File:Uncompetitive inhibition.docx
- **混合抑制**抑制劑可以與酶底物同時結合到酶上。如果底物濃度高於抑制劑,那麼這種型別的抑制可以減少。File:Mixed inhibition.docx
- 非競爭性抑制劑能夠結合到 E 和 ES,但它們對這兩種酶形式的親和力不同。因此,這些抑制劑會增加 Km 並降低 Vmax,因為它們會干擾底物結合並阻礙 ES 複合物中的催化作用。
- 非競爭性抑制劑對 E 和 ES 的親和力相同。它們不會改變 Km,但會降低 Vmax。

