結構生物化學/蛋白質功能/血紅蛋白

血紅蛋白存在於紅細胞中,能夠有效地將氧氣從肺部輸送到身體的組織。血紅蛋白還有助於將二氧化碳和氫離子輸送回肺部。
血紅蛋白能夠與氣態一氧化氮 (NO) 以及 O2 結合。當紅細胞經過肺部的毛細血管床、鰓(在魚類中)或其他呼吸器官時,氧氣擴散到紅細胞中,血紅蛋白結合 O2 和 NO。然後,血紅蛋白在毛細血管中解除安裝其貨物。在那裡,O2 能夠擴散到體細胞中。NO 放鬆毛細血管壁,使其擴張,這也有助於將 O2 輸送到細胞中。
血紅蛋白由四個亞基組成,每個亞基都有一個稱為血紅素基團的輔因子,該輔因子具有一個鐵原子中心。鐵是實際與氧氣結合的主要成分,因此每個血紅蛋白分子能夠攜帶四個 O2 分子。血紅蛋白分子四個亞基之間的合作對於 O2 的有效運輸是必要的。血紅蛋白的四個亞基實際上是協同地 結合氧氣的,氧氣與四個亞基中的一個位點的結合會增加其餘位點與氧氣結合的可能性。
血紅蛋白是一種蛋白質,用於將氧氣從肺部透過血液輸送到組織。這對生存至關重要。血紅蛋白對氧氣的親和力越低,氧氣濃度就越低。這對人體有重大影響,幫助我們非常有效地適應。親和力越低,濃度越低意味著當我們鍛鍊時,我們體內氧氣含量低,這意味著血紅蛋白對氧氣的親和力更低,更容易將氧氣釋放到人體組織中。這在我們依賴氧氣的狀態下為我們提供了更多的氧氣。另一方面,當氧氣濃度很高時,血紅蛋白對氧氣的親和力更高,因此不會將氧氣釋放到不需要的地方。這是一個非常複雜且智慧的系統,已經進化了很長時間,使血紅蛋白成為重要的生物分子。另一方面,血紅蛋白的表親肌紅蛋白用於在肌肉中儲存氧氣。這種肌紅蛋白對氧氣的親和力略高於血紅蛋白,尤其是在較低水平時。這是因為肌紅蛋白的工作相對容易,它只需要儲存氧氣並將其釋放到肌肉中,而血紅蛋白還需要運輸氧氣並在正確的地方釋放它。
血紅蛋白由 DNA 編碼,就像所有其他蛋白質一樣。血紅蛋白的改變或突變會導致許多與血液相關的疾病,例如鐮狀細胞性貧血,其中細胞結構扭曲,不再像正常血細胞那樣能夠以正確的方式攜帶那麼多氧氣。這突出了結構生物化學中結構決定功能的根本理念。鐮狀細胞性貧血的情況非常有趣,因為它向我們展示了疾病如何以及為何發展。鐮狀細胞性貧血的基因也提供對瘧疾的保護。因此,在瘧疾流行的國家,攜帶鐮狀細胞性貧血基因的個體數量高於平均水平。雜合狀態是最好的,因為它不使鐮狀細胞性貧血發展,同時也能預防瘧疾。而純合狀態會產生患有鐮狀細胞性貧血或瘧疾的個體。這就是為什麼在瘧疾流行地區,鐮狀細胞性貧血雜合子的數量高於平均水平,也是這種疾病不會消失的原因!攜帶狀態實際上是受到自然選擇的。 [1]
當 O2 結合到血紅蛋白的一個活性位點時,會發生構象變化,這有助於血紅蛋白協同作用。協同作用是指活性位點之間的相互作用,就血紅蛋白而言,協同作用使氧氣的結合隨著一個位點的填充而增加,其餘活性位點也更有可能與 O2 結合。

當 O2 結合到血紅蛋白分子上的一個活性位點時,鐵原子 Fe2+) 被氧化為 (Fe3+)。鐵和氧氣在血紅蛋白中產生的相互作用是共振結構的組合,一種是 (Fe2+)和 O2,另一種是在 (Fe3+) 和超離子 O2 之間-。
O2 與鐵中心的結合導致血紅蛋白分子結構中組氨酸殘基向卟啉移動的構象變化,最終導致血紅蛋白的 O2 親和力增加。含組氨酸基團的伴隨運動會導致血紅蛋白結構其餘部分的構象變化。COO- 基團現在與 α-β 介面相互作用,導致相鄰活性位點的構象變化。這些構象變化將導致血紅蛋白的 O2 親和力增加。
血紅蛋白是一種變構蛋白。它與 O2 結合到其中一個亞基的能力受到其與其他亞基相互作用的影響。如上所述,O2 與一個血紅蛋白亞基的結合會誘導構象變化,這些變化會傳遞到其他亞基,透過提高其對該分子的親和力,使它們更易於與 O2 結合。H+、CO2 和 2,3-二磷酸甘油酸都是變構效應器,因為它們有利於脫氧血紅蛋白的構象,因此促進 O2 的釋放。由於這三種分子在不同的位點起作用,因此它們的影響是累加的。
-
酶的變構調節
X 射線晶體學表明,氧合血紅蛋白(結合了四個 O2 分子的形式)在其四級結構上與脫氧血紅蛋白(未結合 O2 的形式)有很大區別。在沒有結合的 O2 時,Fe2+ 稍微偏離卟啉環的一側,而卟啉環本身略微彎曲。當一個 O2 分子結合到血紅素輔基時,它會將 Fe2+ 拉入卟啉環的平面,在這個過程中使環變平。Fe2+ 的運動導致近端組氨酸也移動。這反過來又改變了螺旋 F 的位置和螺旋兩端的肽鏈區域。因此,亞基中心的運動傳遞到表面,在那裡它導致將四個亞基結合在一起的離子相互作用斷裂並在不同的位置重新形成,從而改變了四級結構,導致 O2 協同結合到 Hb 上。
氫離子和二氧化碳對氧氣結合的調節稱為波爾效應,該效應由克里斯蒂安·波爾於 1904 年提出。波爾效應描述了 pH 對血紅蛋白氧氣親和力的影響,隨著 pH 從 7.4 的值下降,血紅蛋白對氧氣的親和力下降。當血紅蛋白移動到 pH 較低的區域時,它釋放氧氣的趨勢會增加,因此隨著環境變得更酸性,會釋放更多的氧氣。

pH效應背後有化學基礎。血紅蛋白分子結構中的組氨酸殘基是pH效應的一個因素。在高pH環境中,組氨酸的側鏈不發生質子化,組氨酸末端羧酸鹽基團與賴氨酸殘基之間的鹽橋不會形成。然而,隨著pH下降,意味著在低pH水平下,組氨酸的側鏈將發生質子化,從而與天冬氨酸形成鹽橋。這種靜電相互作用導致結構變化。鹽橋的形成穩定了血紅蛋白結構,導致血紅蛋白對O2的親和力降低,從而增加了氧氣釋放的趨勢。
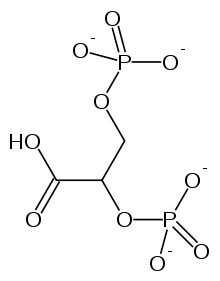
2,3-二磷酸甘油酸(2,3-BPG)對血紅蛋白的影響被描述為別構效應。2,3-BPG是一種別構效應劑,它與氧氣活性位點完全不同的位點結合。紅細胞中2,3-BPG的含量對於決定血紅蛋白的氧氣親和力至關重要。
單個2,3-BPG分子結合在脫氧血紅蛋白結構的四聚體中心,位於T型結構的中心腔中。在T狀態向R狀態轉變時,2,3-BPG被釋放。因此,為了使T狀態向R狀態轉變,血紅蛋白與2,3-BPG之間的鍵需要斷裂。在2,3-BPG存在的情況下,氧氣與血紅蛋白的結合更鬆散。構象變化允許結構穩定發生,從而使血紅蛋白失去氧氣親和力。
二氧化碳能夠透過兩種機制刺激氧氣釋放
- 高濃度二氧化碳(CO2)的存在會降低血紅蛋白的親和力,因為紅細胞的pH值下降。
CO2對血紅蛋白有催化作用。CO2與水反應形成碳酸。然而,該反應需要二氧化碳被紅細胞中的碳酸酐酶(一種酶)催化,最終生成H+和HCO3-。一旦碳酸解離成這兩種離子,pH就會下降。pH的下降穩定了T狀態,從而增加了氧氣釋放的趨勢。
CO2 ↔ CO2 + H2O ↔ H2CO3 ↔ HCO3- + H+
- (CO2)與血紅蛋白之間的直接化學相互作用會刺激O2的釋放。(CO2)能夠透過與末端氨基反應形成帶負電荷的氨基甲酸鹽基團來穩定脫氧血紅蛋白。這種相互作用導致形成穩定T狀態的鹽橋,有利於O2的釋放。
這也解釋了二氧化碳從組織到肺的運輸。組織細胞產生的CO2透過紅細胞,形成如前所述的H+和HCO3-。它允許HCO3-與Cl-交換。因此,血液毛細血管中HCO3-的濃度升高,二氧化碳以這種形式被帶到肺部。當HCO3-到達肺部時,逆反應發生,在肺部釋放二氧化碳。
有幾種分子會導致血紅蛋白將氧氣運輸到組織的能力大幅降低。最常見的是一氧化碳(CO),它與血紅蛋白的結合親和力比氧氣高200倍。一旦一氧化碳與血紅蛋白結合,氧氣親和力就會增加,因為血紅蛋白是一種四聚體,可以促進協同配體結合。然而,這會阻止氧氣釋放到需要氧氣的組織中。CO和血紅蛋白的複合物被稱為碳氧血紅蛋白。這被稱為一氧化碳中毒,CO與氧氣競爭性結合並阻止氧氣運輸。因此,即使是少量的一氧化碳也會對個體造成嚴重傷害。CO濃度低至0.02%就會引起頭痛,而0.1%會導致昏迷。其他競爭性配體包括氰化物、硫化物、二氧化氮和硫化物。
胚胎和胎兒血紅蛋白在亞基水平上與成人血紅蛋白不同,其亞基介面強度不同。胚胎血紅蛋白的亞基介面比胎兒血紅蛋白的亞基介面弱得多,胎兒血紅蛋白的亞基介面又比成人血紅蛋白的亞基介面弱得多。在人類紅細胞中,血紅蛋白可以有八種不同的二聚體形成組合。每種形成都可以比其他形成更多,或者只在發育的不同時間存在。在胚胎髮育中,有三種不同的型別:ζ_2 γ_2 (Hb Portland-1)、ζ_2 ε_2 (Hb Gower-1) 和 α_2 ε_2 (Hb Gowler-2)。胎兒血紅蛋白由α_2 γ_2(HbF)組成,成人血紅蛋白由α_2 β_2 (HbA) 以及微量的α_2 δ_2(HbA2)組成。雖然所有這些不同型別血紅蛋白的三級結構幾乎相同,但它們的初級結構在特定替換上有所不同,這些替換解釋了它們不同的O_2親和力以及它們與別構效應劑的相互作用。這些氨基酸替換會影響亞基的組裝方式以及它們的相互作用方式。胚胎ζ_2 γ_2 (Hb Portland-1)、ζ_2 ε_2 (Hb Gower-1) 和 α_2 ε_2 (Hb Gowler-2) 在生命的最初幾個月內被發現,以及第四種,ζ_2 β_2 (Hb Portland-2)。ζ_2 β_2 (Hb Portland-2) 是一種罕見的血紅蛋白形式。每種血紅蛋白中單體單元介面之間的強度差異很大,在脫氧狀態下差異更大,在配體狀態下變得更加強。四聚體[檢查拼寫]-二聚體解離常數根據它們所含的亞基而不同。例如,在兩個相似的胚胎亞基ζ_2 ε_2 (Hb Gower-1) 和 α_2 ε_2 (Hb Gowler-2) 之間,從α到ζ亞基的解離常數有13倍的差異。因此,透過將不同型別的血紅蛋白與具有一個相似亞基的血紅蛋白進行比較,它們的解離常數可以提供廣泛的資訊。關於Hb Portland-2 的瞭解很少,因為它很罕見,只發生在一種α-地中海貧血(遺傳缺陷)中。Hb Portland-2 與其他血紅蛋白不同,因為它更容易從四聚體解離成二聚體,甚至更容易從二聚體解離成單體,而其他型別的人類血紅蛋白會迅速從四聚體解離成二聚體,但不會從二聚體解離成單體。所討論的解離發生在pH 7.5,但在pH降低後會發生顯著變化。在HbA(成人血紅蛋白)中,四聚體向二聚體的解離隨著pH的降低而增加,每降低1個pH單位,解離就會增加10倍。當pH改變為6.3時,HbA中的解離主要為二聚體,而在Hb Portland-2中,解離主要為單體。由於這種情況,HbA中四聚體的形成比Hb Portland-2中四聚體的形成更有利,因為ζ_2 β_2 二聚體比α_2 β_2 二聚體弱得多。在HbA中,α和β亞基不穩定,但在Hb Portland-2中,ζ和β亞基作為二聚體介面較弱,但作為單體則穩定。胚胎血紅蛋白在pH 6.3 下能夠輕易解離,但Hb Portland-1 和 Gowler-1 比 Hb Gowler-2 解離更快。當混合胚胎血紅蛋白 Hb Gowler-2 和 Portland-2 的單體並使其重新結合時,更強的四聚體形成是結果。而不是形成α_2 ε_2 (Hb Gowler-2) 和 ζ_2 β_2 (Hb Portland-2),而是形成了α_2 β_2 (HbA),以及ζ_2 ε_2,因為αβ介面最強,因此最有利。當將ζ_2 γ_2 (Hb Portland-1)、α_2 ε_2 (Hb Gower-2) 經過相同的處理時,胎兒血紅蛋白α_2 γ_2(HbF) 的介面是結果,因為它遠遠強於胚胎血紅蛋白。當混合ζ_2 γ_2 (Hb Portland-1)、α_2 ε_2 (Hb Gower-2) 和 ζ_2 β_2 (Hb Portland-2) 時,最有利的結果是HbA,而HbF 則無法檢測到。所有三個實驗都證明了亞基競爭有助於重排,並且由於更強的介面,α_2 β_2 的形成明顯高於任何其他四聚體。Hb Portland-2 的罕見可能是由於四聚體-二聚體和二聚體-單體介面比任何其他人類血紅蛋白都要弱。亞基競爭與為什麼某些血紅蛋白更容易形成有很大關係,因為具有更強介面的血紅蛋白的形成優先於具有較弱介面的血紅蛋白的形成。以及從較弱的形成中形成更強的形成。
血紅蛋白是由負責表達血紅蛋白的基因形成的。這些基因的缺陷會導致不規則的血紅蛋白和貧血,這些情況被稱為“血紅蛋白疾病”。不規則血紅蛋白出現在以下三種情況下。
1. 血紅蛋白分子結構異常。兩種血紅蛋白亞基鏈(α鏈和β鏈)的基因變化被稱為突變。通常,突變會改變亞基中的單個氨基酸組成部分。大多數情況下,這種變化是無害的,不會影響血紅蛋白分子的結構或功能。然而,偶爾,單個氨基酸的改變會顯著擾亂血紅蛋白分子的行為,並導致疾病。鐮狀血紅蛋白就是這種現象的代表。
2. 血紅蛋白分子兩種亞基中的一種產量減少。導致這種情況的突變被稱為“地中海貧血”。正常功能需要等量的血紅蛋白α鏈和β鏈。血紅蛋白鏈的不平衡會破壞並摧毀紅細胞,從而導致貧血。儘管受影響的血紅蛋白亞基會死亡,但在大多數地中海貧血患者中,產生的少量亞基在結構上是正常的。
3. 正常亞基的異常關係。單個α鏈亞基和單個β-珠蛋白基因座亞基結合形成一個正常的血紅蛋白二聚體。在嚴重的α-地中海貧血患者中,由於潛在的α鏈伴侶稀缺,β-珠蛋白亞基開始聚整合四聚體。這些β-珠蛋白亞基四聚體在功能上是失活的,不能攜帶氧氣。在嚴重的β-地中海貧血患者中,不會形成類似的α-珠蛋白亞基四聚體。在沒有β-珠蛋白基因簇伴侶的情況下,α亞基會被迅速破壞。
Berg,生物化學(第6版)和坎貝爾生物學(第5版)
Johnson RA, Lavesa M, Askari B, Abraham NG, Nasjletti A (1995年2月). "血紅素加氧酶產物,可能是一氧化碳,在老鼠中介導一種血管舒張功能" http://sickle.bwh.harvard.edu/hemoglobinopathy.html
http://www.rockefeller.edu/labheads/chait/pdf/07/07_manning_prot-sci.pdf
- ↑ [血紅蛋白和肌紅蛋白],2012年11月14日。


