結構生物化學/蛋白質功能/肌球蛋白
肌球蛋白是一個大的運動蛋白超家族,它沿著肌動蛋白絲移動,同時水解 ATP 生成可用於各種功能的機械能,例如肌肉運動和收縮。大約 20 類肌球蛋白根據其 ATP 水解運動域中氨基酸序列的差異而被區分。不同類別的肌球蛋白在其尾部結構上也存在差異。尾部結構在不同的肌球蛋白類別中具有不同的功能,包括二聚化和其他蛋白質-蛋白質相互作用。
肌球蛋白是肌肉中的一種常見蛋白質,負責使肌肉收縮和放鬆。它是一個大型的非對稱分子,有一個長尾和兩個球狀頭部。如果解離,它將解離成六個多肽鏈。其中兩個是重鏈,它們相互纏繞形成雙螺旋結構,另外四個是輕鏈。肌球蛋白的一個主要特徵是它能夠與肌動蛋白非常特異性地結合。當肌球蛋白和肌動蛋白結合在一起時,就會使肌肉產生力量。
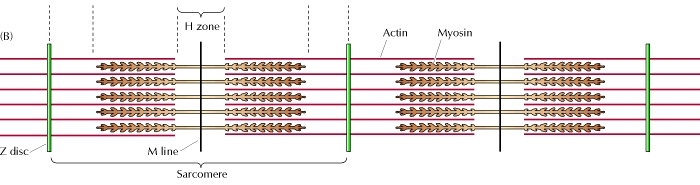
骨骼肌負責隨意運動。骨骼肌包含許多肌纖維,這些肌纖維實際上是由肌原纖維組成的,肌原纖維是由粗肌球蛋白絲和細肌動蛋白絲組成的束狀結構。肌原纖維以鏈狀方式構建和排列,形成稱為肌節的結構。肌節包含幾個區域。一個區域稱為 A 帶,它只包含肌球蛋白絲。A 帶的對應部分是 I 帶,它只包含肌動蛋白絲。每個肌節的末端稱為 Z 盤。每個肌節的中間區域稱為 H 區,它只包含肌球蛋白。
根據安德魯·赫胥黎和拉爾夫·尼德格克提出的滑行絲理論,肌肉收縮時,Z 盤彼此靠近,從而縮短肌節。I 帶的肌動蛋白絲變得非常短,而 A 帶的肌球蛋白絲的長度沒有變化。肌動蛋白絲實際上是向 H 區和 A 帶滑動,從而產生了肌球蛋白和肌動蛋白絲的重疊。當這種重疊發生時,肌球蛋白絲與肌動蛋白絲結合,使肌球蛋白能夠作為絲滑動的驅動馬達起作用。
這種肌球蛋白和肌動蛋白之間的相對運動是導致肌肉收縮的原因。肌肉收縮和作用的分子基礎將在下一節中解釋。
這種收縮機制也被稱為“滑行絲理論”。
- ATP 與肌球蛋白頭部結合會導致肌球蛋白處於低能構象。
- 活性位點關閉,ATP 水解為 ADP 和 Pi。這會誘導構象變化(頭部彎曲),導致肌球蛋白與肌動蛋白弱結合。這形成了一個橫橋。
- Pi 釋放會導致構象變化,從而導致肌球蛋白更牢固地結合,併產生動力衝程。
- ADP 解離使肌球蛋白頭部牢固地結合到肌動蛋白上。
- 新的 ATP 分子與肌球蛋白頭部結合會觸發它從肌動蛋白上釋放,迴圈重新開始。
- 在沒有 ATP 的情況下,這種狀態會導致肌肉僵硬,稱為屍僵。
肌球蛋白包含一組蛋白質,這些蛋白質將運動蛋白進行分類。運動蛋白涉及水解 ATP 的肌動蛋白絲。已經根據氨基酸序列區分了 20 種不同的肌球蛋白型別。所有 20 種肌球蛋白都具有不同的結構,其次是尾部結構。因為每個類別都具有二聚化和蛋白質相互作用的特徵。然而,已知的肌球蛋白類別包括:肌球蛋白 I、肌球蛋白 II、肌球蛋白 V 和 VI。
肌球蛋白 I
在與耳聾相關的基因的蛋白質中,有幾種型別的肌球蛋白。肌球蛋白 I 似乎將肌動蛋白絲交聯起來,以控制每個立體纖毛內的張力。這種肌球蛋白馬達沿著肌動蛋白絲的棘輪活動可能會調整毛細胞對不同聲音的敏感度。其他型別的肌球蛋白利用其馬達活性沿著肌動蛋白絲的長度重新分佈細胞成分。
肌球蛋白 II
肌球蛋白 II 由六個多肽鏈組成:兩個 220-kD 重鏈和兩對不同的大小在 15 到 22kD 之間的輕鏈,具體取決於它們的來源。每個單個重鏈的 N 末端一半呈現球狀形式,並向一個方向伸展。接下來是一個大約 100 埃長的 α 螺旋,由纏繞在其周圍的兩條輕鏈加固。當肌肉收縮時,蛋白質的這一部分充當槓桿。重鏈的 C 末端一半呈 α 螺旋形式,以長纖維鏈結束。其中兩個結合並形成左手螺旋形捲曲螺旋基序。肌球蛋白的整體形狀是長 1600 埃的桿狀結構,有兩個球狀頭部。
肌球蛋白 V
肌球蛋白 V 具有不同的馬達結構。它具有一個兩頭運動蛋白,其中重鏈發散。這意味著肌動蛋白依賴性轉運向軸突相關囊泡運動對黑色素產生影響。微管和肌動蛋白絲都導致了推測,並影響了毛髮的顏色。肌球蛋白 V 也是一個雙頭蛋白,但它不像肌球蛋白 II 那樣形成粗絲。肌球蛋白 V 單獨起作用 - 尾部末端的結構域與帶有色素作為貨物的囊泡結合。該蛋白質的槓桿區域足夠長,可以結合六條輕鏈,使其具有比肌球蛋白 II 的對應槓桿臂高三倍的輕鏈結合能力。在肌球蛋白 V 與 F-肌動蛋白絲結合的電子顯微鏡(EM)影像中,估計球狀頭部之間有 13 個肌動蛋白亞基。