結構生物化學/病毒透過內吞作用進入
儘管病毒在結構和組成成分方面並不複雜,相當簡單,但它們與宿主細胞的相互作用卻非常複雜。為了進入細胞,動物病毒利用了多種細胞過程,這些過程涉及許多細胞蛋白。儘管一些病毒能夠透過質膜進入胞質溶膠,但大多數病毒依賴於內吞攝取,透過胞質溶膠的囊泡運輸,以及運輸到內體和其他細胞內細胞器。這種攝取病毒的過程與網格蛋白介導的內吞作用、巨胞飲作用、小窩/脂筏介導的內吞作用或其他機制有關。動物病毒利用許多方法和內吞機制來允許病毒進入細胞。

最初,病毒附著在細胞表面的蛋白質、碳水化合物和脂質上。病毒受體之間的相互作用通常是特異性的,至少具有 3 個價。此外,這些相互作用會導致細胞訊號通路被啟用。細胞透過利用幾種內吞機制來整合病毒。在病毒進入內體或內質網腔之後,它們會獲得訊號,這些訊號的形式是暴露於低 pH 值、蛋白水解裂解和病毒蛋白的啟動。這些會導致病毒蛋白髮生修飾,然後它們能夠穿透液泡膜。在穿透液泡膜後,它們將病毒基因組、衣殼或保持在一起的病毒顆粒傳遞到胞質溶膠中。之後,大多數 RNA 病毒在胞質溶膠的各個位置複製。相反,大多數 DNA 病毒繼續透過它們的通道前往細胞核。一個由分解和脫殼步驟組成的過程與病毒和病毒衣殼向細胞深處的移動平行進行。整個過程導致基因組和輔助蛋白以複製 компетентной 形式被有規律地分散。
出於多種原因,研究和了解病毒-宿主細胞相互作用非常重要。首先,由於世界人口增長、國際貿易和旅行的鉅額增長以及全球變暖等許多因素,病原體和病毒可能造成的威脅和潛在損害正在呈指數級增長。因此,獲取儘可能多的資訊以幫助對抗目前存在的病毒或將來可能出現的病毒至關重要且有幫助。研究病毒與細胞之間的相互作用是一個不斷發展的領域,其中包含許多未被發現的細節,這些細節可以幫助制定應對病毒的策略。
研究病毒與細胞之間相互作用的另一個重要原因是,病毒可以作為分子醫學中的工具。病毒已經發展到可以進入細胞並帶入外源基因和大分子。這就是為什麼它們在基因治療以及將大分子和藥物運輸到細胞中非常有用的原因。此外,病毒有可能識別出癌細胞並將其消滅。病毒是一個不斷增長的重要工具,科學家可以利用和操縱它來開發分子、結構和細胞生物學領域的新策略和概念。
對噬菌體的形態學、遺傳學和生化研究表明,感染機制極其複雜。他們還表明,T4 和 T2 噬菌體的形成類似於帶有可收縮尾部的皮下注射器。這創造了一種機器,能夠穿透革蘭氏陰性細菌的兩個膜並穿透胞質溶膠以送入 DNA。研究發現,附著在宿主細胞受體上具有作為訊號的功能,該訊號會啟用注射過程。由於動物細胞的宿主細胞沒有外膜和細胞壁,因此它們不需要複雜而精密的工具和機制來進入細胞。相反,細菌具有這些細胞壁和膜,這些細胞壁和膜抑制了到達質膜的途徑。此外,動物細胞提供了內吞機制,這些機制會將進入的病毒送往宿主細胞的核周區域,在那裡感染條件得到鼓勵,並且到細胞核的距離最小。實際上,這使病毒能夠自由地穿過與細胞質堆積和皮層中微絲的複雜結構有關的障礙物。透過內吞囊泡旅行的能力對於感染神經元的病毒尤其重要,在這些病毒中,細胞體分離的軸突具有非常長的距離。此外,具有緩慢變化條件的內體的成熟,例如 pH 值降低或氧化還原環境的轉換,使病毒能夠檢測到它們在細胞內的位置以及通道。這還將允許內體利用這些資訊來確定穿透和脫殼的時間。當存在某些蛋白酶(例如弗林蛋白酶和組織蛋白酶)時,它們會提供特定病毒所需的蛋白水解啟用。此外,當動物病毒被內吞時,它們能夠避免留下它們在質膜上暴露的證據。避免在質膜上留下暴露證據很重要,因為它會導致免疫監視的檢測延遲。綜合起來,內吞作用包含許多優勢,導致病毒(如單純皰疹病毒 1 和人類免疫缺陷病毒 1)利用內吞途徑進行有效的進入,而不是直接進入。
病毒內吞作用的研究與內吞途徑的綜述相結合。瞭解這兩個方面在這些廣泛主題中的重要性。
動物病毒的大小範圍從細小病毒的約 30 nm 到痘病毒的 40 nm 不等。大多數病毒的尺寸介於 60 到 150 nm 之間。儘管病毒通常呈球形,但也有一些病毒(例如絲狀病毒、副粘病毒和流感病毒)可能是纖維狀的,並且非常分散。當它們附著在細胞上時,病毒不會變形。另一方面,質膜通常會改變形狀以適應病毒的形狀。在某些情況下,內吞作用需要內陷。病毒的外層通常覆蓋著附著在受體上的蛋白質,這些蛋白質以二十面體網格形式形成的衣殼蛋白或跨越整個病毒包膜的刺突糖蛋白形式存在。與受體的單獨相互作用通常很弱,但與許多不同受體的相互作用會導致活性大幅提高,從而導致與細胞的結合幾乎不可逆。多價結合會導致受體聚集,這可能導致與脂質域的結合和訊號通路的啟用。
當病毒顆粒到達內體時,病毒顆粒的尺寸通常與腔內囊泡相似。當它們太大而無法適應狹窄的管狀延伸時,它們通常會定位於內體的球狀、液泡區域,並且會被組織到降解途徑中。
過去,病毒通常被用作內吞作用和膜轉運研究中的模型貨物。透過使用電子顯微鏡,可以很容易地識別出這些病毒,並且可以使用熒光基團或蛋白質對其進行識別,這使得能夠在活細胞中進行單顆粒定位和監測。透過提供聚焦的光源,可以使用點擴散函式準確地勾勒出熒光病毒的質心。由於感染會導致放大,因此當病毒成功進入細胞時,即使病毒量很少,也可以很容易地測量到。此外,許多病毒學研究創造了許多工具,例如病毒突變體、熒光病毒、抗體、表達系統和修飾的宿主細胞。
脂筏的功能是控制膜上的訊號轉導、流動性和受體功能。這些通常富含膽固醇和鞘脂。使用小窩/筏依賴性途徑的病毒形成主要內吞囊泡,這些囊泡依賴於膽固醇、脂筏和複雜的訊號通路。這些途徑使用酪氨酸激酶、磷酸酶和糖鞘脂。該過程由配體啟動,這些病毒的穿透部位是內質網。使用這種途徑最常被研究的病毒之一是多瘤病毒。這些病毒利用多個可用的受體以更好地結合。
儘管一些病毒利用具有明確內吞受體功能的受體,例如轉鐵蛋白和低密度脂蛋白受體,但大多數病毒附著的分子與細胞間識別、離子轉運和附著在細胞外基質中具有不同的功能。大多數情況下,碳水化合物部分在病毒結合中起著重要的作用。
區分僅僅吸附病毒並幫助病毒集中在細胞頂端的吸附因子和作為觸發因素,修飾病毒、促進細胞訊號傳遞或啟用穿透的病毒受體,這一點很重要也很有用。許多受體的共同目標是促進內吞作用,幫助病毒進入細胞。病毒進入時,通常先與吸附因子結合,然後與其他受體相互作用。實際上,很難區分吸附因子和受體,因為它們在感染的有效性中都發揮著作用。
最常見的吸附因子是蛋白聚糖中的糖胺聚糖鏈。與這些帶負電荷的多糖的結合通常是靜電的,並且不太特異。已經發現,在某些情況下,病毒在組織培養中適應時,會進化利用GAGs。另一種常見的碳水化合物類別是唾液酸,許多病毒會與其結合。類似於流感病毒和多瘤病毒的情況,大多數情況下,這種結合非常特異,並且涉及凝集素結構域或凝集素位點。
由於結合非常特異,這是決定嗜性(tropism)和物種特異性的重要原因,因此可以瞭解病毒性疾病的性質。受體特異性的另一個方面是,它可以識別病毒進入的內吞途徑和細胞內轉運的型別。例如,與轉鐵蛋白受體結合的細小病毒利用網格蛋白介導的攝取通路。它們還可以與其受體一起迴圈到細胞表面。相比之下,鼻病毒等不太常見的病毒組與LDL受體結合,在早期內體中與受體分離,並被送往晚期內體。
一些受體負責促進病毒的修飾,從而使病毒能夠與輔助受體結合、促進內吞作用,或轉變為膜融合活性構象。最明確的例子是HIV-1。因為在這種情況下,需要兩種受體來促進構象改變,從而促進融合。腺病毒2和5含有兩種受體,它們促進構象改變並促進內吞作用。對於禽白血病病毒,進入所需的訊號是受體結合和低pH值。
病毒如何劫持細胞調控SLiMs 病毒的生命週期受其與細胞蛋白的相互作用的影響。它們可以接管和利用蛋白質來滿足其自身機制的需要。然而,病毒是緊湊的空間受限,具有很小的基因組,但它們可以控制如此多的通路和過程。它們能夠做到這一點的原因之一是,它們廣泛地模仿宿主蛋白質的短線性基序(SLiMs)。
-
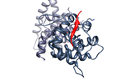
人乳頭瘤病毒E7癌基因蛋白模仿與宿主視網膜母細胞瘤蛋白(深灰色)結合的LxCxE基序(紅色)(PDB 1gux)。
當病毒進入細胞時,它們擁有自己的DNA和RNA聚合酶、解旋酶和蛋白酶,這些酶使複製、表達和成熟成為可能。但是,病毒仍然需要細胞的幫助來進行病毒複製。真核生物蛋白質組中存在被稱為SLiMs的緊湊的非球狀蛋白質相互作用介面。它們具有多種特異的功能,例如在短序列中編碼功能性相互作用介面的能力、參與蛋白質的某個區域以及獨立發揮功能和趨同進化的能力。它們的功能包括將蛋白質靶向特定目的地、充當蛋白水解切割的識別位點,以及提供特異性修飾、訊號傳導、識別、重新連線通路、分子開關等。
宿主通路的多樣性被靶向,並影響它們的功能。其中一些包括宿主靶點14-3-3,由病毒蛋白Rep68與病毒AAV以及基序RsxSxP相互作用。另一個例子是宿主靶點ALIX,由病毒蛋白Gag與HIV以及基序LYPxxxL相互作用。因此,病毒利用這些基序的機制多種多樣。
其中一種機制是細胞轉運。將蛋白質定向到目的地需要大型複合物或微管的細胞骨架結構。因此,病毒蛋白透過複製這些基序來利用龐大的細胞基礎設施。例如,訊號模仿是HIV中必需的調節蛋白Rev的重要驅動力。
另一種機制是訊號轉導。SLiMs具有較低的結合親和力和較快的脫落率,這促進了對不同刺激的快速反應。因此,病毒複製了訊號基序並解除其通路的調控。
第三種機制是控制細胞蛋白水平。病毒蛋白充當支架,透過將底物特異性重新定向到非傳統的宿主蛋白靶點。例如,在泛素連線酶募集過程中,病毒劫持細胞導致宿主多泛素化,隨後被蛋白酶體降解。透過這樣做,細胞蛋白髮生改變,這使病毒蛋白能夠存活並複製其基因組。破壞基序也可以用來抑制蛋白質的破壞,這可以延長原病毒蛋白的壽命。
第四種機制是轉錄調控,這是一個嚴格控制的細胞過程。即使如此,即使其調節也可以被基序模仿所破壞。
第五種機制是透過解除內源性修飾過程的調控來修飾宿主蛋白質組。病毒蛋白可以在宿主酶和病毒靶標之間充當支架。單個修飾最終可能導致整個基因組的修飾。
第六種機制是它們自己的修飾。病毒蛋白也可以透過模仿宿主酶的對接位點和修飾位點來指導自身的修飾。
病毒必須使用基序,因為細胞的正常功能在很大程度上受SLiMs的控制。它們是進化重新連線細胞調節通路的產物,這使得它們同樣容易受到快速進化的病毒蛋白的影響,使病毒蛋白能夠解除通路的調控。
SLiMs的長度,為3-10個殘基,使其能夠趨同進化。通常,一個或兩個突變就足以建立一個新的基序。RNA病毒通常在每代中的每個位置經歷10^-5 – 10^-3的突變,而DNA病毒通常經歷10^-8 – 10^-5的突變。可以透過病毒株和分離株來檢查這些病毒基序的趨同進化。病毒蛋白的表型變化是由於基序特異性的適應造成的。
病毒基因組的大小受到很大限制,但它們仍然與宿主細胞廣泛相互作用。一旦病毒蛋白獲得與蛋白質介面的相互作用,它就會改變預先摺疊的區域,但宿主無法在彼此靠近的多個結合位點上執行,因此它們無法與許多這些不同的伴侶相互作用,因為它們在空間上受到限制。病毒蛋白質組通常具有摺疊結構。通常,病毒接管一個過程並不需要球狀介面,但儘管如此,仍然有多種對比機制可用來操縱特定的通路或蛋白質。
真核生物調節系統很強大,因為細胞網路協作。病毒也可以利用這些機制變得強大。基序的小尺寸也使病毒蛋白能夠抵抗突變和適應。SLiMs的模仿也很強大。
Mercer, Jason, Mario Schelhaas, and Ari Helenius. "Virus Entry by Endocytosis." Annual Review of Biochemistry 79.1 (2010): 803-33.