高階無機化學/電子吸收光譜基礎
紫外-可見光譜是一種分析化學技術,用於確定各種化合物的存在,例如過渡金屬/過渡金屬離子、高度共軛的有機分子等等。然而,由於本課程的性質,這裡只討論過渡金屬配合物。紫外-可見光譜透過使用光將金屬的 d 電子從基態構型激發到激發態來工作。簡而言之,當以光形式的能量照射過渡金屬配合物時,d 電子將獲得能量,紫外-可見分光光度計測量特定波長光下具有激發電子的過渡金屬原子的丰度,從可見光區域到紫外區域。
在使用紫外-可見分光光度計時,待分析的溶液透過將樣品放入比色皿中,然後將比色皿放入分光光度計中來製備。然後,機器發出來自可見光和紫外光波長的光波,並測量樣品吸收了多少每種波長的光,然後發射。
樣品的吸光度可以透過比爾-朗伯定律計算:A=εlc,其中 A 是吸光度,ε 是樣品摩爾吸光係數,l 是所用比色皿的長度,c 是樣品的濃度。[1]當分光光度計產生吸收圖譜時,摩爾吸光係數就可以計算出來。

為了說明這看起來像什麼,你將在右側找到一個示例吸光度譜。[2] 404-5</ref> </ref> 如圖所示,y 軸表示吸光度,x 軸表示正在掃描的光的波長。這種特定的過渡金屬配合物 [CrCl(NH3)5]2+ 在紫外光區域(大約 250-275 奈米)的吸光度最高,並在分別接近 400 奈米和 575 奈米的兩個地方有輕微的吸光度峰。這兩個峰遠不如前一個峰明顯,因為電子的躍遷是部分禁戒的——這將在本章後面討論。如果躍遷被禁戒,則不會有太多過渡金屬電子會經歷激發。

眾所周知,d 軌道包含五種型別的亞軌道:dxy、dyz、dxz、dx2-y2 和 dz2,這些亞軌道都在右側顯示出來[3]。當不存在磁場時——例如,當不存在電子時——所有亞軌道組合在一起形成一個簡併的球形軌道。當引入電子或過渡金屬與一組配體鍵合時,這個單個軌道會立即重新區分成其亞軌道。 
這種區分導致了金屬配合物中顏色的起源。
當觀察過渡金屬配合物中的顏色時,有必要關注區分後的 d 軌道。這種意義上的顏色源於從一個能級到下一個能級的 d 軌道電子的激發。例如,t2g 成鍵軌道中的電子可以被光激發到 eg* 成鍵軌道,並且當它下降回基態時,能量以光的形式釋放:

激發電子到 eg* 軌道所需的特定波長直接與電子回到基態時發出的顏色相關聯。右邊的圖有助於視覺化過渡金屬顏色的特性。吸收了哪種顏色,就會發射互補色(與圖中顏色完全相反)。例如,如果金屬配合物發射綠光,我們可以推斷出該配合物吸收了波長在 630 奈米到 750 奈米之間的紅光。
發射顏色的強度基於兩個規則:[4]
- 自旋多重度:當電子被激發時,配合物的自旋多重度不能改變。多重度可以透過公式 2S+1 計算,其中 S 由 (1/2)(未成對 d 電子的數量) 計算得出。
- 如果分子中存在對稱中心(即反演中心),則不允許 g 到 g 或 u 到 u 的電子激發。
如果配合物違反了其中一條規則,我們說它是一個禁戒躍遷。如果違反了一條規則,它就是單禁戒的。如果違反了兩條規則,我們就稱它為雙禁戒,等等。雖然約定俗成地稱之為禁戒,但這並不意味著它不會發生;相反,配合物違反的規則越多,它的顏色就越淡,因為躍遷發生的可能性越小。讓我們再看看前面的例子:
如果我們將強度規則應用於它
- 躍遷前的多重度=2(0.5[1 個未成對電子])+1=3,躍遷後的多重度=2(0.5[1 個未成對電子])+1=3。兩種多重度都相同,因此這種躍遷在規則 1 下是允許的。
- 如果我們假設這個分子是八面體對稱的,這意味著它有一個反演中心,因此 eg* 到 t2g 的躍遷在規則 2 下是被禁戒的,因為這兩個軌道都是 gerade (g)。
- 我們只激發了一個電子,因此它在規則 3 下是允許的。
根據這些規則,我們可以看到這種躍遷只是單禁阻的,因此它只會顯得稍微褪色和淺色,而不是深而豐富的綠色。
事實證明,與過渡金屬鍵合的原子會影響絡合物吸收的波長,從而發出光;我們將此稱為配位場理論。雖然某些過渡金屬喜歡吸收不同於其他過渡金屬的波長,但配體在確定電子激發所需的波長方面起著最重要的作用。[5]
低自旋和高自旋這兩個術語用來描述 t2g 和 eg* 軌道的能級差異,這與從 t2g 到 eg* 激發電子的所需光波長相關。當一個絡合物被描述為低自旋時,與金屬結合的配體會提高 eg* 軌道的能量,以至於絡合物基態構型在 eg* 軌道被填充之前先填充 t2g 軌道中的前六個電子。因此,需要高能波長的光——紫光、藍光和綠光——才能成功地將電子激發到 eg* 成鍵軌道。這意味著過渡金屬絡合物將分別發出黃光、橙光和紅光。相反,高自旋絡合物的配體會降低 eg* 軌道的能級,因此低能光——紅光、橙光和黃光——甚至高能光也能成功地激發電子。因此,高自旋絡合物可以發出任何顏色。在激發電子所需的波長方面,高自旋絡合物可以被認為是全包容的,而低自旋絡合物則是半排外的。
要確定一個絡合物是高自旋還是低自旋
- 觀察過渡金屬。第一排金屬會傾向於高自旋,除非配體迫使它成為低自旋。第二排金屬會傾向於低自旋,除非配體迫使它成為高自旋。第三排金屬會是低自旋。
- 觀察配體,因為它們是最終的決定因素。如果配體在高自旋/低自旋方面與過渡金屬相匹配,那麼絡合物的自旋將是它們“一致”的。如果它們不同,則遵循配體的自旋型別。如果配體既不是高自旋也不是低自旋,則遵循過渡金屬的自旋型別。配體自旋型別在下文列出。
- 如果有多種配體具有不同的自旋型別,則選擇絡合物中最豐富的自旋型別。
以下配體從低自旋(t2g 和 eg* 之間最大的能級差)到高自旋(最小的能級差)排序:[6] 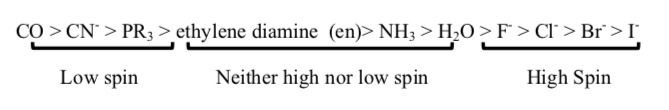
為了說明這個概念,讓我們看看以下絡合物
[Ni(NH3)6]2+, [Ni(CN)4]2-
所有鎳絡合物在金屬上的氧化態都相同(2+),因此 d 電子數量相同。在第一個絡合物中,鎳傾向於高自旋,而氨既不傾向於高自旋也不傾向於低自旋。因此,絡合物將是高自旋併發出藍光,這是對橙色——弱能量——光的吸收。對於第二個絡合物,鎳再次傾向於高自旋,但氰化物傾向於低自旋。因此,絡合物成為低自旋,並將發出黃光,這是對紫色——強能量——光的吸收。
- ↑ 無機化學,Miessler、Fischer 和 Tarr,2013 年,第 404 和 405 頁
- ↑ 化學 LibreTexts,電子光譜:解釋,https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Spectroscopy/Electronic_Spectroscopy/Electronic_Spectroscopy%3A_Interpretation
- ↑ 無機化學原理,Brian William Pfennig,2015 年,第 88 頁
- ↑ 無機化學,Miessler、Fischer 和 Tarr,2013 年,第 414 頁
- ↑ 無機化學原理,Brian William Pfennig,2015 年,第 526 頁
- ↑ 無機化學原理,Brian William Pfennig,2015 年,第 523 頁
