普通化學/各種元素的化學/過渡金屬
過渡金屬位於元素週期表的中間。對過渡金屬有兩個定義
- 所有d區元素(3-12族)
- 具有部分填充d軌道的元素,或可以形成具有部分填充d軌道的陽離子的元素
第一個定義更為普遍,在日常使用中更為常見,但第二個定義強調了過渡金屬的獨特性質,是IUPAC(國際純粹與應用化學聯合會)使用的定義。第二個定義通常被認為不包括Zn、Cd和Hg,因為這些元素具有d10電子構型(d軌道完全填充,而不是部分填充)。然而,最近報道的具有d8構型的氟化汞(IV)化合物使這種排除變得可疑,使考慮Hg(以及可能還有Zn和Cd)為過渡金屬變得合理。
過渡金屬的行為與其他金屬不同,因為它們具有部分填充的d軌道。向過渡金屬新增電子不會影響其價層,因為電子進入d軌道(它不是價層的一部分)。所有過渡金屬都具有一個或兩個價電子。
過渡金屬很有趣,因為它們可以具有多種氧化態,不像大多數其他金屬。這是因為過渡金屬在形成離子時,除了s電子之外還可以失去d電子。

記住,當電子軌道充滿或半滿(或空)時,它最穩定。研究過渡金屬的電子構型顯示出一個有趣的模式
| Sc | [Ar]4s23d1 |
| Ti | [Ar]4s23d2 |
| V | [Ar]4s23d3 |
| Cr | [Ar]4s13d5 |
| Mn | [Ar]4s23d5 |
| Fe | [Ar]4s23d6 |
| Co | [Ar]4s23d7 |
| Ni | [Ar]4s23d8 |
| Cu | [Ar]4s13d10 |
| Zn | [Ar]4s23d10 |
為了更加穩定,鉻和銅中的一個s電子“躍遷”到d軌道。這也會發生在較重的過渡金屬中,例如鉬、鎢和鉑。對於週期5、6和7中的較重過渡金屬,相對論的影響導致軌道能級的變化。在這些元素中,s電子比預期更容易“躍遷”到d層,遵循充滿/半滿規則。
當過渡金屬離子形成時,它們首先失去s電子,然後如果進一步電離,它們會失去d電子。例如,銅可以形成兩種不同的離子,鈦可以形成三種
| Cu | [Ar]4s13d10 |
| Cu+ | [Ar]4s03d10 |
| Cu2+ | [Ar]4s03d9 |
| Ti | [Ar]4s23d2 |
| Ti2+ | [Ar]4s03d2 |
| Ti3+ | [Ar]4s03d1 |
| Ti4+ | [Ar]4s03d0 |
過渡金屬及其氧化物在溶解時會形成有色化合物。1族和2族金屬溶解時是透明的,沉澱時是白色的。其他金屬,如鉛,溶解時是透明的,沉澱時可能會有顏色(鉛沉澱物是黃色的)。另一方面,過渡金屬溶解時是有色的。不同的金屬以其特定的顏色而聞名,被用作墨水或油漆。

"貨幣金屬"是銅、銀、金和釒羅。這些元素的用途遠不止硬幣,除了這些元素之外,還有許多其他元素被製成硬幣。此外,釒羅是一種放射性元素,半衰期為3.6秒,使其無法用於商業應用。因此,"貨幣金屬"更恰當地稱為11族(IB)元素。
銅、銀和金,儘管相對稀有(銅)、稀有(銀)或極其稀有(金),但它們是最早為人所知且最熟悉的元素之一。它們是柔軟、光亮、緻密的金屬,耐腐蝕,並且是良好的導電體。釒羅是一種最近發現的合成元素,壽命很短,因此其物理和化學性質尚未得到很好的定義。
銅因其電氣特性、常見性(與銀和金相比)以及黃銅和青銅合金的吸引力而成為這些元素中使用最廣泛的元素。在鋁成為常見金屬之前,銅在金屬產量中僅次於鐵。
-
銅管
-
最光亮的銀
-
金
它們很容易識別,因為銅(紅色)和金(黃色)是人們可能遇到的兩種有色金屬。銀是金屬中最光亮的,通常與銅或金一起發現,形成鮮明的對比。它們通常以遊離態存在。
由於柔軟,它們很容易被敲擊成硬幣,而且它們相對稀有和具有吸引力,再加上它們耐腐蝕,使它們成為財富的緊湊儲存器。它們太軟而沒有結構價值,但銅合金與鋅和錫等元素形成更硬的黃銅和青銅。黃銅和青銅是早期金屬工具中必不可少的;沒有它們,我們所知的文明將是不可能的。金和銀由於其吸引力和耐氧化性,已被大量用於珠寶和其他裝飾作品。金雖然非常昂貴,但它非常具有延展性,以至於少量金可以以適中的成本被錘成極薄的箔,使它可以被用作一些建築物表面的覆蓋層;少量金可以走很遠。
銅在鹵化物和氧化物中難以氧化至+1價,在硫酸銅 CuSO4 等鹽中氧化至+2價。可溶性銅化合物很容易透過其獨特的藍綠色來識別。銀在硝酸銀 AgNO3 和硫化銀 Ag2S 等物質中氧化至+1價,後者是銀的典型變黑。金極難氧化至+1價和+3價。
這些元素是弱(銅)到極弱(金)的還原劑,它們的化合物是非常好的氧化劑。銅離子氧化大多數金屬
與銀或金的反應更強。實際上,這些金屬鹽的溶液可以鍍在大多數其他金屬上。
銀是電導率最高的金屬,其次是銅,然後是金。這使得銅成為電線的首選材料。金尖電線用於需要電氣精度的場合(如高品質音訊),因為金不會變色(銅的變色導電性要低得多)。
鋅族
[edit | edit source]鋅、鎘和汞是金屬,其熔點對於金屬來說很低。這是因為它們具有特別穩定的電子構型。汞在形成金屬鍵方面非常差,以至於它在室溫下是液體。
-
一枚鋅幣
-
鎘塊
-
一灘汞
鋅和鎘是軟金屬,很容易氧化成+2價態。這兩種金屬都沒有以遊離態出現在自然界中。鋅被大量用於與銅的合金中,以製造一種更硬的金屬,稱為黃銅;作為鐵的塗層(該過程稱為“鍍鋅”),它氧化形成一層保護性的氧化鋅 (ZnO) 層,保護鐵不被氧化,也稱為生鏽。氧化鋅比氧化鉛安全得多,通常用於白漆。自1982年以來,鋅一直是美國分幣使用的主要金屬。現在它被用於新的風琴管。
鎘形成兩種物質,鎘黃(硫化鎘,CdS)和鎘紅(硒化鎘,CdSe),它們出現在油漆中。這些顏料具有強烈的顏色,許多印象派時期的大藝術家在他們的繪畫中喜愛這些顏色。但這些物質劇毒,使用它們的畫家經常英年早逝,並且殘疾。現代畫家通常使用不含這兩種有毒化學物質的不同顏料。
相反,汞在室溫下是閃亮的液體,並且很難氧化。它導電性良好。由於它是液體,它是一種不尋常的金屬——但它是一種金屬。它已被用於溫度計(但自被認定為危險毒物後就不那麼常用了),因為它會隨著熱量膨脹,以及在開關中,它可以流入封閉的空間以閉合電路。汞在氯化汞 (HgCl2) 中氧化至+2價;在一些奇怪的化合物中,兩個汞原子共享一個電子,並提供它們“剩餘”的電子來形成+1價態的物質,如氯化亞汞 (Hg2Cl2)。
鋅是生物體必需的微量元素;它具有一定的殺菌作用,並且大量存在時有毒。鋅分幣切勿吞食。鎘、汞及其化合物是劇毒物質。儘管汞具有吸引力並且具有非凡的特性,但應謹慎使用,並且只能由瞭解其危害的工人使用。
2010年命名的第112號人工元素鎶,其性質可能屬於該族的一部分,但它極難產生,而且太不穩定,無法確定其化學性質。迄今為止,這種元素只製備了很少的原子。
第8、9和10族的元素分為兩個不同的組:第一行過渡金屬中的常見元素鐵、鈷和鎳以及第二行和第三行中的鉑族金屬,以及更稀少的兩個下行過渡元素中的鉑族金屬。
鐵、鈷和鎳
[edit | edit source]這些元素是相當好的還原劑——好到它們很少以遊離態出現在自然界中。鐵是其中最常見的元素。它是宇宙中最常見的元素之一,也是在恆星中透過正常核聚變形成的最重的金屬(但只有最大的恆星)。當恆星開始在其核心產生鐵時,這顆恆星註定將在很短的時間內發生劇烈的爆炸,摧毀恆星並散佈其物質,包括它在核聚變中形成的所有元素。
遊離鐵、鈷和鎳——特別是鐵——可以在隕石中找到,隕石是撞擊地球的固體物體。鐵是過渡元素中最常見的,也是最有用的元素之一。很難計算出鐵的所有用途,鐵是幾乎所有機器中使用最多的金屬(無論是純金屬還是合金)。巨大的“玻璃盒子”摩天大樓依賴於其混凝土“骨架”內的鐵棒,以賦予它們強度和穩定性。鐵路的軌道是長長的鐵棒。混凝土公路和飛機跑道有鐵筋,以賦予它們承受重型車輛的強度。車輛本身主要由鐵和一種更硬的材料製成,稱為鋼,它是鐵、碳和通常不含鐵的金屬的合金。
鐵是最便宜的結構金屬。透過被稱為鐵匠的工匠的一些技巧,它可以被加工成許多有用的物品,如馬蹄鐵、釘子、犁、鏈條、桶、梯子和許多工具。在鑄造廠,鐵和鋼以更大的數量被塑造成傢俱和飛機、船舶、機動車和電器部件等物品。
鐵作為結構材料有一個缺陷:它容易生鏽。在有水(特別是鹽水)的情況下,它會腐蝕成氧化物
Fe(s) + 1/2 O2(g) → FeO(s) 2 Fe(s) + 3/2 O2(g) → Fe2O3(s)
以及一種稱為赤鐵礦的混合氧化物
2 Fe(s) + 3/2 O2(g) → Fe2O3(s)
是鐵最常見的礦石之一。氧化鐵呈弱鹼性,因此鐵能抵抗鹼的侵蝕;酸會侵蝕它。例如,
Fe (s) + H2SO4(l) → Fe2+(aq) + SO42-(aq) + H2(g)
即使是相對較弱的酸,如磷酸,也可以侵蝕氧化鐵。這就是“海軍果凍”反應,它可以去除鐵鏽
FeO(s) + H3PO4(l) → Fe2+(aq) + HPO4(aq)-2 + H2O(l)
人類的一大進步,即鐵器時代的開始,始於人們發現可以透過用碳(通常是木炭)燃燒來從氧氣中分離鐵,碳可以將氧化鐵還原成鐵
Fe3O4(s) + 4 C(s) → 3 Fe(s) + 4 CO(g)
現有的許多經濟活動都依賴於鐵礦石的開採、鐵礦石的還原、鐵的強化成鋼、鐵和鋼製品的製造以及保護鐵免受腐蝕的各種做法。
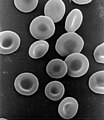
這項活動雖然重要,但我們的生活不可能沒有一種叫做血紅蛋白的重要鐵化合物,血紅蛋白透過血流將氧氣輸送到細胞,細胞可以使用氧氣從透過血流輸送到細胞的食物中釋放能量。
-
兩座懸索橋
-
一把舊的鐵犁
-
紅細胞含有血紅蛋白
-
一塊電磁鐵正在吸引廢鐵
地球本身有一個由主要由鐵和鎳組成的熱而緻密的核心。在地球核心的特徵溫度下,鐵和鎳形成了一個巨大的天然磁鐵,產生了一個磁場,該磁場延伸到地球本身之外進入大氣層。該磁場驅散了大量危險的輻射,如果這些輻射到達地球表面,將殺死地球表面的生命。
鈷和鎳都比鐵稀少得多,並且在商業上沒有鐵那樣廣泛使用,儘管它們有專門的用途。
鉑族金屬包括釕、銠、鈀、鋨、銥和鉑。這些元素位於第 8/9/10 族 (IIIB) 的最後兩行。
與這些元素在第 8、9 和 10 族中的較輕同類元素不同,它們耐腐蝕和變色。它們用作許多化學反應的催化劑,加速反應而不會被反應消耗。
鈀、鋨和其他鉑族金屬在粉末狀時會吸收氫氣。
銠用於催化轉化器 - 汽車內部的金屬結構。催化轉化器將氮氧化物(有毒汙染物)轉化為元素氮和氧氣(兩者都是可呼吸空氣的組成部分)
如果沒有銠作為催化劑,該反應就不會發生。