普通化學/八隅體規則及其例外
八隅體規則是指原子傾向於在其價層(外層軌道)中具有八個電子的趨勢。當原子具有少於八個電子時,它們往往會發生反應並形成更穩定的化合物。在討論八隅體規則時,我們不考慮 d 或 f 電子。只有 s 和 p 電子參與八隅體規則,這使得它對代表元素(不在過渡金屬或內過渡金屬塊中的元素)很有用。八隅體對應於以 s2p6 結尾的電子構型。
原子會發生反應以達到最穩定的狀態。完整的八隅體非常穩定,因為所有軌道都將被填滿。穩定性越高的原子能量越低,因此增加原子穩定性的反應會以熱量或光的形式釋放能量。降低穩定性的反應必須吸收能量,變得更熱。
原子的另一個趨勢是保持中性電荷。只有稀有氣體(元素週期表最右邊一列的元素)具有充滿價層八隅體的零電荷。所有其他元素在它們具有八個電子時都帶有電荷。這兩個指導原則的結果是對原子內觀察到的許多反應性和鍵合的解釋:原子試圖以一種最小化電荷並滿足價層八隅體的共享電子方式。
稀有氣體很少形成化合物。它們具有最穩定的構型(完整的八隅體,無電荷),因此它們沒有理由反應並改變它們的構型。所有其他元素都試圖獲得、失去或共享電子以達到稀有氣體構型。 |
食鹽的化學式是 NaCl。它是 Na+ 離子與 Cl- 離子鍵合在一起的結果。如果鈉金屬和氯氣在合適的條件下混合,它們將形成鹽。鈉失去一個電子,氯得到那個電子。在這個過程中,會釋放大量的熱和光。由此產生的鹽大多不活潑——它是穩定的。它不會發生任何爆炸反應,不像它所製成的鈉和氯。
為什麼?根據八隅體規則,原子試圖獲得稀有氣體電子構型,即八個價電子。鈉有一個價電子,所以放棄它會導致與氖相同的電子構型。氯有七個價電子,所以如果它得到一個,它將有八個(一個八隅體)。氯在得到一個電子時具有氬的電子構型。
如果氯放棄它所有的七個價電子,而鈉得到它們,那麼八隅體規則就可以得到滿足。在這種情況下,兩者都將具有稀有氣體的電子構型,具有完整的價層。然而,它們的電荷將高得多。它將是 Na7- 和 Cl7+,這比 Na+ 和 Cl- 不穩定得多。原子在沒有電荷或少量電荷時更穩定。
八隅體規則有幾個例外。
該規則的主要例外是氫,當它在價層中有兩個電子時,它處於最低能量狀態。氦 (He) 類似,因為它也只有一個價層,而且它只能容納兩個電子。
氫和氦只有一個電子層。第一層只有一個 s 軌道,沒有 p 軌道,因此它只容納兩個電子。因此,這些元素在具有兩個電子時最穩定。你偶爾會看到氫沒有電子,但 H+ 比具有一個或兩個電子的氫不穩定得多。
鋰,具有三個質子和電子,在放棄一個電子時最穩定。
其他值得注意的例外是鋁和硼,它們可以用六個價電子很好地發揮作用。考慮 BF3。硼將它的三個電子與三個氟原子共享。氟原子遵循八隅體規則,但硼只有六個電子。雖然具有少於八隅體的原子可能是穩定的,但它們通常會嘗試形成第四個鍵以獲得八個電子。BF3 是穩定的,但它會在可能的情況下形成 BF4-。大多數位於碳族左側的元素擁有很少的價電子,因此它們與硼處於相同狀態:它們是電子不足的。電子不足的元素通常表現出金屬鍵合而不是共價鍵合。
在第三週期,元素週期表右側的元素有空的 d 軌道。d 軌道可以接受電子,允許硫、氯、矽和磷等元素具有超過八隅體的電子。可以形成像 PCl5 和 SF6 這樣的化合物。這些化合物分別在其中心原子周圍具有 10 和 12 個電子。

|
六氟化氙使用 d 電子形成超過八隅體的化合物。這種化合物顯示了另一個例外:一種稀有氣體化合物。 |
甚至鈀在其價層中也有 18 個電子
一些元素,特別是氮,具有奇數個電子,會形成相對穩定的化合物。一氧化氮的化學式為 NO。無論氮原子和氧原子之間如何共享電子,氮都無法形成八隅體。它將只有七個電子。含有未配對電子的分子稱為自由基,自由基具有很高的反應活性,反應活性如此之高,以至於許多自由基只存在於不到一秒的時間內。在自由基中,NO 和 NO2 實際上非常穩定。在低溫下,NO2 會與自身反應生成 N2O4,其二聚體,不是自由基。
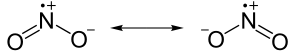
|
二氧化氮具有一個未配對電子。(注意 N 上面的正電荷)。 |
