普通化學/相變
外觀
< 普通化學
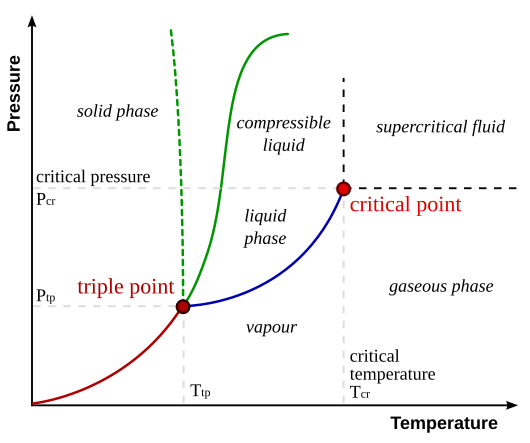
相圖預測物質在一定壓力和溫度下的相態。
三相點是所有三種物質相態可以平衡共存的點。處於線上的點表示兩種物質相態可以共存。
臨界點是三種正常相態能夠存在的最高壓力和溫度。超過這個點,物質的特性會變成液體和氣體的混合。
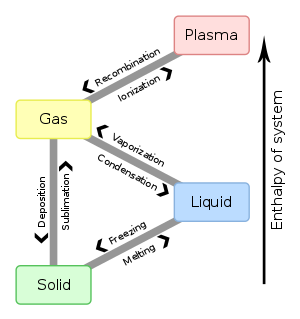
如果溫度和壓力發生變化,並且在圖上跨越一條線,相態也會發生變化。這種變化可以有六種方式:
- 固態到液態:熔化
- 液態到固態:凝固
- 液態到氣態:蒸發
- 氣態到液態:冷凝
- 氣態到固態:凝華
- 固態到氣態:昇華
右邊的圖還顯示了物質的等離子體狀態。 等離子體 僅僅是完全電離的氣體,所以它包含正離子與電子的混合物。它具有有趣的電學性質,但在普通化學的範圍內並不重要。
| 提示! | |
|---|---|
| 分子的動能與其溫度成正比。勢能用於斷開鍵。 |
如果你把水煮沸,它永遠不會超過 100 攝氏度。只有在它完全蒸發後才會變熱。這是因為一旦水達到沸點,額外的能量被用來改變物質的狀態,增加勢能而不是動能。當水結冰時,會發生相反的事情。要沸騰或熔化一摩爾物質,需要一定的能量。這些能量被稱為摩爾汽化熱和摩爾熔化熱。如果在沸點或凝固點向一摩爾物質新增這些能量,它將全部熔化或沸騰,但溫度不會改變。
該圖顯示了冰在新增熱量時的溫度變化。溫度隨著熱量線性增加,直到熔點。然後,新增的熱量不會改變溫度。這些熱量被用來斷開分子間鍵,將冰轉化為水。此時,存在冰和水的混合物。一旦所有的冰都融化,溫度會再次隨著新增的熱量線性上升。在沸點,溫度不再隨熱量增加而上升,因為能量再次被用來斷開分子間鍵。一旦所有的水都沸騰成蒸汽,溫度會隨著熱量的增加而線性上升。