有機化學/手性
手性(發音為kie-RAL-it-tee)是手性的性質。如果你試圖將你的右手疊放在你的左手之上,兩者將無法重疊,因為你的右手的拇指會與你的左手的食指重疊。你的兩隻手無法完全重疊,儘管你每隻手的手指以相同的方式連線。任何物體都可以具有這種性質,包括分子。
一個手性物體是一個不能與其映象重疊的物體。手性物體沒有對稱平面。非手性物體具有對稱平面或旋轉反射軸,即反射得到一個旋轉後的版本。
旋光異構體或對映異構體是表現出手性的立體異構體。旋光異構體由於其在無機化學、有機化學、物理化學、藥理學和生物化學中的應用而備受關注。
它們通常在存在不對稱中心時形成,例如,與四個不同基團鍵合的碳原子。一個對映異構體中的每個立體中心在另一個對映異構體中具有相反的構型。
當一個分子具有多個不對稱性來源時,兩個旋光異構體可能既不是彼此的完美映象,也不能重疊:一些但不全是立體中心發生反轉。這些分子是非對映異構體的一個例子:它們不是對映異構體。非對映異構體很少具有相同的物理性質。有時,立體中心本身是對稱的。這會導致一種反直覺的情況,即可能存在兩個手性中心,但沒有產生異構體。這種化合物被稱為內消旋化合物。
等量的兩種對映異構體的混合物被稱為外消旋混合物。
是分子的對稱性(或任何其他物體)決定了它是否為手性。從技術上講,如果一個分子只有不正則旋轉軸,則它是非手性的(非手性);也就是說,一個n次旋轉(旋轉360°/n),然後在垂直於該軸的平面上進行反射,該反射將該分子對映到自身。一個手性分子不一定是反對稱的(完全沒有對稱性),因為它可以具有例如旋轉對稱性。一個簡化的規則適用於四面體鍵合的碳原子,如插圖所示:如果所有四個取代基都不同,則該分子為手性。
重要的是要記住,溶解在溶液中或處於氣相中的分子通常具有相當大的柔韌性,因此可能採用多種不同的構象。這些不同的構象本身幾乎總是手性的。但是,在評估手性時,必須使用對應於一種化學構象的結構圖——能量最低的結構圖。
最常見的是,手性分子具有點手性,圍繞一個單原子,通常是碳原子,該碳原子具有四個不同的取代基。這些化合物的兩種對映異構體被稱為在這個中心具有不同的絕對構型。因此,該中心是立體成性的(即,可以被認為是立體異構體焦點的分子實體中的一個基團),並且以氨基酸的α-碳原子為例。
碳原子的特殊性質,其形成與不同取代基的四個鍵,意味著具有四個不同鍵的碳原子的映象將不會與原始化合物相同,無論你如何嘗試旋轉它。理解這一點至關重要,因為有機化學的目標是理解如何使用工具合成具有所需手性的化合物,因為不同的排列可能沒有影響,甚至可能具有不良影響。
如果一個碳原子(或其他型別的原子)同時與四個不同的原子或原子鏈鍵合,則該碳原子是手性的。最常見的是,這指的是一個碳原子與三個雜原子和一個氫原子鍵合,或者與兩個雜原子以及一個與另一個碳原子的鍵和一個與氫原子的鍵鍵合。它也可以指與四種不同型別的分子鍵合的氮原子,如果氮原子將它的孤對電子用作親核試劑。如果氮原子只有三個鍵,則它不是手性的,因為孤對電子可以自發地從原子的一側翻轉到另一側。
有機分子中任何與四種不同型別的原子或原子鏈鍵合的原子都可以被認為是“手性的”。
如果一個碳原子(或其他型別的原子)具有四個不同的取代基,則該碳原子形成一個手性中心(也稱為立體中心)。手性分子通常具有一個或多個立體中心。在繪製分子時,立體中心通常用碳原子附近的星號表示。
示例
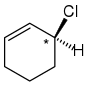
左:該碳原子具有 Cl、Br 和 2 CH3。這隻有 3 個不同的取代基,這意味著它不是立體中心。
中心:該碳原子具有一個乙基 (CH2CH3)、一個甲基 (CH3) 和 2 個 H。這不是立體中心。
右:該碳原子具有 Cl 和 1 個 H。然後你需要檢視環周圍。由於一側具有雙鍵,而另一側沒有,這意味著該碳原子的取代基是不同的。這 4 個不同的取代基使得該碳成為立體中心,並使該分子成為手性的。
一個分子可以具有多個手性中心,但整體上不一定是手性的:然後它被稱為內消旋化合物。如果存在將手性中心聯絡起來的對稱元素(鏡面或反轉中心),就會發生這種情況。
費歇爾投影(以德國化學家赫爾曼·埃米爾·費歇爾命名)是表示碳原子構型的一種巧妙方法。將碳原子視為中心,朝向觀察者的鍵水平放置。那些遠離觀察者的鍵垂直繪製。這個過程,當使用常見的虛線和楔形鍵表示時,會產生有時被稱為“領結”的圖,因為它具有其特徵形狀。這種表示進一步縮寫為兩條線:水平線(向前)和垂直線(向後),如下面的圖所示

- 在費歇爾投影中,交換兩個取代基位置會導致立體中心的翻轉
- 費歇爾投影旋轉 90°會導致翻轉
- 費歇爾投影旋轉 180°會保留構型
有三種主要系統用於描述構型:最古老的相對構型,其使用現已過時;以及當前的絕對構型。相對構型描述主要仍在糖化學中使用。構型也可以根據旋光性的純粹經驗基礎來分配。
旋光異構體可以透過它旋轉偏振光平面的方向來命名。如果一個異構體按順時針方向旋轉平面,如朝向光的傳播方向的觀察者所見,則該異構體標記為 (+)。其對應物標記為 (-)。(+) 和 (-) 異構體也分別被稱為 d- 和 l-(代表右旋和左旋)。這種標記很容易與 D- 和 L- 混淆,因此不鼓勵使用 IUPAC。
一個對映異構體可以順時針旋轉偏振光(d- 或 +- 對映異構體)的事實與其相對構型(D- 或 L-)無關。
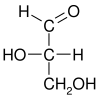
費歇爾的研究興趣是碳水化合物化學,他以甘油醛(最簡單的糖,系統命名為 2,3-二羥基丙醛)為模板手性分子,用 D- 和 L- 表示兩種可能的構型,分別使偏振光順時針和逆時針旋轉。

如果可以透過取代從甘油醛正式獲得手性中心,則所有其他分子都被分配 D- 或 L- 構型。因此,D- 或 L- 命名方案被稱為相對構型。
|
可以透過其原子的空間構型來命名光學異構體。D/L 系統透過將分子與甘油醛相關聯來做到這一點。甘油醛本身也是手性的,其兩種異構體分別標記為 D 和 L。某些化學操作可以在不影響其構型的情況下對甘油醛進行,並且它在歷史上用於此目的(可能與它作為最常用的手性分子之一的便利性相結合)導致了它在命名法中的使用。在這個系統中,化合物是透過類比甘油醛命名的,這通常會產生明確的命名,但最容易在類似於甘油醛的小型生物分子中看到。

一個例子是氨基酸丙氨酸:丙氨酸有兩種光學異構體,它們根據它們來自甘油醛的哪種異構體進行標記。甘氨酸,從甘油醛衍生的氨基酸,恰好不保留其光學活性,因為其中心碳不是手性的。然而,丙氨酸本質上是甲基化的甘氨酸,並顯示光學活性。
D/L 標記與 (+)/(-) 無關;它不指示哪種對映異構體是右旋的,哪種是左旋的。相反,它表示該化合物的立體化學與甘油醛的右旋或左旋對映異構體的立體化學相關。在蛋白質中常見的 19 種 L- 氨基酸中,有 9 種是右旋的(在 589 奈米的波長下),D- 果糖也被稱為左旋糖,因為它也是左旋的。
甘油醛的右旋異構體實際上是 D 異構體,但這是一個幸運的猜測。在建立這個系統的時候,還沒有辦法確定哪種構型是右旋的。(如果猜測是錯誤的,那麼現在的標記情況會更加混亂。)
確定氨基酸 D/L 異構體形式的經驗法則是“CORN”法則。這些基團
- COOH、R、NH2 和 H(其中 R 是未命名的碳鏈)
圍繞手性中心碳原子排列。如果這些基團圍繞碳原子順時針排列,那麼它是 L- 型。如果逆時針排列,那麼它是 D- 型。此規則僅在氫原子指向頁面外時有效。[1]
透過絕對構型:R- 和 S-
[edit | edit source]主要文章:R-S 系統
絕對構型系統源於Cahn-Ingold-Prelog 優先規則,它允許對立體中心進行精確描述,而無需使用任何參考化合物。實際上,其基礎現在是立體中心取代基的原子序數。
R/S 系統是另一種透過其構型命名光學異構體的方法,不涉及甘油醛等參考分子。它根據一個系統對每個手性中心進行 R 或 S 標記,該系統根據 Cahn Ingold Prelog 優先規則對每個配體進行優先順序分配,基於原子序數。
該系統標記了分子中的每個手性中心(並且也有一個擴充套件到不涉及手性中心的非手性分子)。因此,它比 D/L 系統更具普遍性,並且可以例如標記 (R,R) 異構體與 (R,S)——非對映異構體。
R/S 系統與 (+)/(-) 系統沒有固定關係。R 異構體可以是右旋的,也可以是左旋的,具體取決於其確切的配體。
R/S 系統與 D/L 系統也沒有固定關係。例如,甘油醛的配體之一是羥基,-OH。如果將一個硫醇基,-SH,換成它,則根據其定義,D/L 標記不會受到取代的影響。但這種取代將反轉分子的 R/S 標記,因為硫的原子序數高於碳,而氧的原子序數低於碳。[注意:這似乎不正確。氧的原子序數高於碳。硫的原子序數高於氧。此示例中優先順序分配發生變化的原因是,CH2SH 基團的優先順序高於 CHO,而在甘油醛中,CHO 的優先順序高於 CH2OH。]
出於這個原因,D/L 系統在某些領域仍然被廣泛使用,例如氨基酸和碳水化合物化學。將所有高等生物的常見氨基酸標記為相同的方式很方便。在 D/L 中,它們都是 L。在 R/S 中,它們並非都是 S——大多數都是,但例如半胱氨酸是 R,這又是因為硫的原子序數更高。
術語“外消旋體”源於拉丁語中的葡萄詞;該術語起源於路易·巴斯德的工作,他從葡萄酒中分離出外消旋酒石酸。
沒有立體中心的非手性化合物
[edit | edit source]一個分子也可以在沒有實際點手性(立體中心)的情況下成為手性的。常見的例子包括 1,1'-聯-2-萘酚(BINOL)和 1,3-二氯-丙二烯,它們具有軸向手性,以及 (E)-環辛烯,它具有平面手性。
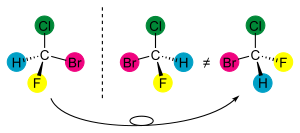
例如,下圖所示的異構體是不同的。由於雙鍵旋轉的限制,這兩個異構體不能自發地相互轉換。

其他型別的沒有立體中心的非手性化合物(如由於空間位阻導致單鍵旋轉的限制)也存在。考慮以下 R 和 S 聯萘分子的例子
如果 X 和 Y 基團引起空間位阻,則聯苯 C-C 鍵無法旋轉。
該化合物表現出螺旋手性。
光學異構體的性質
[edit | edit source]對映異構體具有——當存在於對稱環境中時——相同的化學和物理性質,除了它們使平面偏振光旋轉相同量但方向相反的能力。等量光學活性異構體及其對映異構體的溶液被稱為外消旋溶液,它對平面偏振光的淨旋轉為零。
對映異構體在它們如何與其他化合物的不同光學異構體相互作用方面有所不同。在自然界中,大多數生物化合物(如氨基酸)以單一對映異構體的形式存在。因此,化合物的不同對映異構體可能具有明顯不同的生物學效應。相同手性藥物的不同對映異構體可能具有非常不同的藥理作用,主要是因為它們結合的蛋白質也是手性的。
例如,薄荷葉和孜然籽分別含有 L- 香芹酮和 D- 香芹酮——香芹酮的對映異構體。對於大多數人來說,它們聞起來不同,因為我們的味覺感受器也包含手性分子,它們在存在不同對映異構體時表現不同。

D- 型氨基酸往往嚐起來很甜,而 L- 型通常是無味的。這再次歸因於我們手性的味覺分子。橙子和檸檬的氣味是 D 和 L 對映異構體的例子。
青黴素的活性具有立體選擇性。該抗生素僅作用於細菌細胞壁中存在的 D- 丙氨酸的肽鍵——但在人類中沒有。該抗生素只能殺死細菌,而不能殺死我們,因為我們沒有這些 D- 氨基酸。
偏振光的電場和磁場在幾何平面上振盪。垂直於該平面的軸給出了能量傳播的方向。光學活性異構體旋轉場振盪的平面。偏振光實際上在外消旋混合物中也被旋轉,但它被兩種對映異構體之一向左旋轉,被另一個向右旋轉,它們抵消為零淨旋轉。
生物學中的手性
[edit | edit source]許多具有生物活性的分子都是手性的,包括天然存在的氨基酸(蛋白質的組成部分)和糖。有趣的是,在生物系統中,大多數這些化合物具有相同的手性:大多數氨基酸是 L,糖是 D。生物學中這種同手性的起源是許多爭論的主題。

手性物體與其他手性物體的兩種對映異構體具有不同的相互作用。酶是手性的,它們通常區分手性底物的兩種對映異構體。想象一下,酶就像一個手套狀的空腔,它可以結合底物。如果這個手套是右手的,那麼一種對映異構體將適合在裡面結合,而另一種對映異構體將很不適合,不太可能結合。

許多配位化合物是手性的;例如,著名的[Ru(2,2'-聯吡啶)3]2+配合物,其中三個聯吡啶配體採用手性螺旋槳狀排列[7]。在這種情況下,Ru原子可以被視為一個手性中心,該配合物具有點手性。[Ru(2,2'-聯吡啶)3]2+之類的配合物的兩種對映異構體可以分別用Λ(由配體描述的螺旋槳的左旋扭轉)和Δ(右旋扭轉)表示。六醇是一種手性鈷化合物。
- 任何非外消旋手性物質被稱為對映體富集
- 當兩種可能的對映異構體中只有一種存在時,手性物質稱為對映體純或同手性。
- 當一種對映異構體過量存在,但並非完全排除非另一種對映異構體時,手性物質稱為對映體富集或異手性。
- 對映體過量或ee是衡量一種對映異構體與另一種對映異構體的比例。例如,在ee為R的40%的樣品中,剩餘的60%為外消旋,其中R佔30%,S佔30%,因此R的總量為70%。
存在多種策略用於製備對映體純化合物。第一種方法是將外消旋混合物分離成其異構體。路易斯·巴斯德在其開創性工作中能夠分離酒石酸的異構體,因為它們從溶液中結晶出來時,形成的對稱性不同的晶體。另一種不太常見且最近才發現的方法是透過對映體自歧化,這是一種先進的技術,涉及透過柱色譜分離主要為外消旋的部分和幾乎為對映體純的部分。
在非對稱環境(如生物環境)中,對映異構體可能以不同的速度與其他物質反應。這是手性合成的基礎,它透過與手性分子反應或用它們催化來保留分子的所需手性,這些手性分子能夠在所需構象中維持產物的手性(使用某些手性分子來幫助它保持其構型)。有機化學家還使用其他方法來合成給定反應中僅(或可能只是大部分)所需的對映異構體。
工業化學工藝的進步使製藥公司能夠將最初以外消旋形式銷售的藥物分離成單個對映異構體,每個對映異構體可能具有獨特的性質。對於某些藥物,如佐匹克隆,只有一種對映異構體(左佐匹克隆)具有活性;FDA已經允許這些曾經的通用藥物以另一個名稱獲得專利並上市。在其他情況下,如布洛芬,兩種對映異構體產生相同的效果。類固醇受體位點也顯示出立體異構體特異性。
外消旋混合物和對映異構體的例子,它們已經被上市銷售,包括
- 氧氟沙星(氟哌酸)和左氧氟沙星(樂伐沙星)
- 布比卡因(馬卡因)和羅哌卡因(納洛芬)
- 哌甲酯(利他能)和右旋哌甲酯(專注達)
- 西替利嗪(息斯敏)和左西替利嗪(開瑞坦)
- 沙丁胺醇(喘樂寧)和左沙丁胺醇(舒喘寧)
- 奧美拉唑(洛賽克)和埃索美拉唑(耐信)
- 西酞普蘭(賽樂特/希普拉密)和艾司西酞普蘭(樂思羅/希普拉克)
- 佐匹克隆(依眠寧)和左佐匹克隆(倫那特)
- 莫達非尼(思諾思)和阿莫達非尼(醒必泰)——莫達非尼中手性中心是硫,而不是碳。
許多手性藥物必須以高對映體純度製備,因為其他對映異構體可能存在潛在的副作用。(另一個對映異構體也可能僅僅是無活性的。)
考慮外消旋的沙利度胺樣品。一種對映異構體被認為對治療妊娠嘔吐有效,而另一種現在已知具有致畸作用。不幸的是,在這種情況下,僅僅給孕婦服用一種對映異構體仍然非常危險,因為兩種對映異構體在體內很容易相互轉換。因此,如果一個人服用任何一種對映異構體,D和L異構體最終都將存在於患者的血清中,因此化學過程可能無法減輕其毒性。