結構生物化學/化學鍵/偶極相互作用
外觀

偶極鍵的性質始於原子電負性的差異,電負性量化了單個原子吸引電子的能力。一個典型的電負性原子是氟。
當兩個原子之間形成共價鍵時,電子將不均勻地分佈在兩個原子之間;電負性更大的原子將具有更大的電子密度。這種不均勻的電子共享會產生電荷分離,被檢查的分子將形成部分電荷,其中電負性原子將形成部分負電荷,而其相鄰原子將形成部分正電荷。由於這種電荷分離,該分子被稱為極化。當分子表現出這種電荷分離時,分子之間存在部分電荷之間的偽靜電力。
偶極鍵的關鍵是分子內的電荷分離。
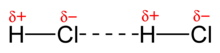
- 偶極矩
- 當分子中的共價鍵極化時,分子的一部分會形成正電荷,而另一部分會形成負電荷。這種相反電荷的分離會產生電偶極子。根據兩個偶極子的方向,分子可以相互吸引,因為部分負電荷被部分正電荷吸引。
- 例如: 一氧化碳 (CO)
非極性分子與極性分子中非極性分子之間的永久偶極和誘導偶極相互作用,形成了更穩定的結構。
此外,當極性分子彼此靠近,例如在液體和固體中時,它們的區域性電荷就像微小的電場,使其定向併產生偶極-偶極力。因此,偶極-偶極力是指一個分子的正極吸引另一個分子的負極。偶極矩越大,分子之間的偶極-偶極力就越大。
誘導偶極發生是因為電子在分子中不斷運動。對於非極性分子來說,分子內的平均電荷分佈表明不存在永久偶極。但是,瞬時電荷分佈表明存在瞬時偶極。想象一下,如果你拍一張分子的照片,你可以看到一個電子和一個原子核以固定排列的方式排列。這種固定排列意味著存在偶極矩,即使只是短暫的一瞬。我們將這種型別的瞬時偶極稱為誘導偶極。短暫的部分負電荷會吸引短暫的部分正電荷。
誘導偶極是典型的非極性分子,例如脂肪酸鏈、脂肪族鏈和芳香烴。
- 疏水效應
- 當非極性分子被極性分子包圍時,它們會聚在一起。
- 非極性分子之間沒有鍵相互作用,這就是為什麼它被稱為瞬時偶極-誘導偶極相互作用的原因。這種現象是由於包圍分子疏水部分的水分子數量減少造成的。
- 籠狀化合物
- 當發生疏水相互作用時形成的結構(當親水分子排列在疏水分子的外部時)。這迫使疏水分子變得高度有序。
- 示例:當水分子包圍脂類時
