結構生物化學/DNA突變
一般來說,DNA序列突變有兩種方式。
改變核苷酸鹼基: File:Environmental agents damage DNA.jpg環境影響,如紫外線、輻射或有毒化學物質,可以改變核苷酸鹼基,使其看起來像其他核苷酸鹼基,導致DNA損傷。例如,某些環境因素會改變鳥嘌呤鹼基的結構,使其具有類似腺嘌呤的形狀。因此,在DNA複製過程中,該“鳥嘌呤鹼基”將無法與胞嘧啶結合,而是因為其具有腺嘌呤的形狀,它將與胸腺嘧啶結合。
斷裂磷酸骨架:環境因素還可以斷裂氧和磷酸基團之間的磷酸二酯鍵。透過斷裂基因內DNA的磷酸骨架,可以形成該基因的突變形式。這種突變基因可能會導致功能不同的突變蛋白,並可能導致蛋白質錯誤摺疊疾病。
然而,細胞通常會嘗試修復斷裂的DNA片段,透過將遊離端連線到細胞中的其他DNA片段。這會產生“易位”,另一種型別的突變。如果這種易位斷點發生在基因內部或附近,該基因的功能可能會受到影響。
在DNA複製過程中,DNA解旋酶首先將DNA雙鏈分離成兩條單鏈。然後,DNA聚合酶幫助在兩個模板鏈上新增相應的核苷酸,形成兩個雙鏈DNA分子。然而,DNA聚合酶在該過程中可能會出現錯誤,每1億個鹼基發生一次錯誤。結果是基因突變,這可能導致翻譯蛋白的許多功能障礙。
事實上,大多數錯誤可以在複製過程的後期由一種型別的蛋白質修復。這種蛋白質會用正確的核苷酸替換配對錯誤的核苷酸。因此,DNA突變的數量實際上更低。
移碼突變是由從DNA序列中插入或刪除的核苷酸數量(不是3的倍數)引起的。它通常發生在當新增或丟失DNA鹼基破壞基因的閱讀框架時。閱讀框架由三個DNA鹼基(密碼子)組成,每個密碼子代表一個特定的氨基酸。由此產生的蛋白質通常沒有功能,因為基因的錯誤閱讀框架從正常的閱讀框架翻譯出非常不同的蛋白質序列。
例如,具有序列AUG CAG AUA AAC GCU UAA的mRNA的正常氨基酸序列閱讀框架應該是:MET GLN ILE ASN ALA STOP。然而,錯誤的閱讀框架(刪除第一個鹼基'A')會產生mRNA的翻譯:UGC AGA UAA ACG CUU AA,異常的氨基酸序列翻譯將是:CYS ARG STOP。
在上述情況下,移碼突變導致突變後所有密碼子的讀取都編碼不同的氨基酸。停止密碼子(“UAA”)無法讀取,可以在更早或更晚的位置建立停止密碼子。上面建立的蛋白質異常短,包含錯誤的氨基酸;因此,它沒有功能。
移碼突變會導致嚴重的遺傳疾病,如泰-薩克斯病,它是由遺傳突變導致的酶缺失引起的,這種突變導致神經系統中脂肪物質(神經節苷脂)的積累。然而,移碼突變可能是有益的。例如,移碼突變導致了尼龍酶的產生,它能夠消化尼龍6生產的某些副產品。
另一種可能發生的DNA突變是染色體易位,它是一種染色體異常,由非同源染色體片段的重排引起。在某些情況下,兩個分離的基因會連線在一起,形成一個融合基因,這在癌症中很常見。這種融合基因可以在受影響細胞的核型圖上檢測到。染色體易位主要有兩種型別:相互(非羅伯遜)易位和羅伯遜易位。易位也可以是平衡的,其中遺傳物質的交換是均勻的,沒有多餘或缺失的資訊,也可以是不平衡的,其中染色體物質的交換是不均勻的,導致多餘或缺失的基因。一些由易位引起的疾病包括癌症、不育症和唐氏綜合症。
相互易位通常是非同源染色體之間物質的交換。這些易位在很大程度上是無害的,因為交換的遺傳物質數量是相同的。它們通常可以透過產前診斷檢測到。然而,平衡相互易位攜帶者有更大的風險產生具有不平衡染色體易位的配子,最終導致流產,甚至導致患有畸形的兒童。
羅伯遜易位最常見於唐氏綜合症兒童中。唐氏綜合症兒童的父母是導致流產和/或異常後代的不平衡配子的攜帶者。唐氏綜合症兒童易位的情況稱為三體性。

倒位是指染色體重排,其中染色體的一部分端到端反轉。當單個染色體發生斷裂並在自身內重排時,就會發生倒位。倒位有兩種型別:臂間倒位和臂內倒位。臂間倒位不包括著絲粒,因此兩個斷裂都發生在染色體的一個臂上。臂內倒位包括著絲粒,因此每個臂上都有一個斷裂點。
倒位通常不會導致攜帶者出現任何異常,只要排列是平衡的。這意味著沒有多餘或缺失的遺傳資訊。然而,那些對倒位雜合的個體會增加異常染色單體的產生,這會導致生育能力下降,因為會產生不平衡的配子。
點突變是指遺傳物質DNA或RNA中單個鹼基核苷酸被另一種核苷酸替換的突變。點突變通常也包括單個鹼基對的插入和/或缺失。點突變可以分為兩種型別:
轉換:嘌呤鹼基被另一種嘌呤鹼基替換,或嘧啶鹼基被另一種嘧啶鹼基替換
顛換:嘌呤鹼基被嘧啶鹼基替換,或反之
點突變也可以根據功能進行分類:
無義突變:編碼終止密碼子,可能導致蛋白質截斷
錯義突變:編碼不同的氨基酸
沉默突變:編碼相同或不同的氨基酸,但蛋白質的功能沒有變化
鐮狀細胞貧血就是一個錯義突變的例子。β-珠蛋白基因發生錯義突變,將GAG密碼子轉換為GTG密碼子,編碼的是纈氨酸而不是穀氨酸。

插入是指在一個DNA序列中新增一個或多個核苷酸鹼基對。這通常發生在DNA聚合酶在微衛星區域滑動時。插入的大小可以變化,一些只包含單個核苷酸鹼基對,而另一些則可以是另一個染色體的片段被插入到DNA序列中。在染色體水平上,插入是指將較長的序列插入到染色體中。這通常是由於減數分裂期間不均等的交叉互換造成的。根據插入的方式和內容,可以分為幾種不同的插入型別。N區新增是指在末端脫氧核苷酸轉移酶的重組過程中新增非編碼核苷酸。P核苷酸插入是指插入由重組基因片段末端編碼的迴文序列。

缺失是指染色體或DNA序列的一部分缺失的突變。缺失是遺傳物質的丟失。可以缺失任何數量的核苷酸,從單個鹼基對到整個染色體片段。缺失通常是由減數分裂期間染色體交叉互換錯誤造成的。缺失的一些原因包括易位造成的丟失、染色體內倒位發生的染色體交叉互換、不均等的交叉互換以及斷裂未修復。缺失的型別包括端粒缺失和間隙缺失。端粒缺失是指發生在染色體末端的缺失。間隙缺失是指發生在染色體內部的缺失。
小的缺失不太可能致命,而大的缺失則可能更致命,因為丟失的基因總是存在差異。一些中等大小的缺失會導致可識別的遺傳疾病。缺失會導致多種遺傳疾病,例如男性不育和三分之二的杜氏肌營養不良病例。

擴增是指包含基因的DNA區域的複製,可以作為同源重組錯誤、逆轉錄轉座事件、整個染色體複製的結果發生。這種複製是由減數分裂期間不均等的交叉互換引起的,發生在排列不整齊的同源染色體之間。擴增通常不構成物種基因組的持久變化,不會持續超過最初的宿主生物體。擴增實際上是基因過表達的一種方式。它可以透過聚合酶鏈反應人工實現,也可以像剛才解釋的那樣自然發生。
基因擴增被認為在進化中起著重要作用,這一觀點在科學界已經存在了100多年。基因的複製導致了額外的複製,該複製不受選擇壓力的影響。新的基因複製可以不受有害影響地發生突變。由於不受這些後果的限制,新的基因可以發生突變,這可能潛在地提高生物體的適應性或編碼全新的功能。基因複製後存在的兩個基因是旁系同源基因,它們通常編碼具有相似功能和/或結構的蛋白質。

脫氨基作用是指從氨基酸中去除氨基並將其轉化為氨。由於胞嘧啶、腺嘌呤和鳥嘌呤的鹼基上都有可以被脫氨基的氨基,因此脫氨基作用會導致DNA突變。例如,如果胞嘧啶在DNA模板鏈中被脫氨基形成尿嘧啶(尿嘧啶是胸腺嘧啶的類似物),那麼聚合酶將在新生DNA鏈的對應位置插入腺嘌呤而不是鳥嘌呤。胞嘧啶水解反應(脫氨基作用)生成尿嘧啶是自發的。
為了應對這種突變,細胞有一個修復過程。在這個過程中,細胞利用尿嘧啶DNA糖基化酶識別這些尿嘧啶並將其去除。該酶水解脫氧核糖環和尿嘧啶鹼基之間的N-糖苷鍵。因此,尿嘧啶鹼基被去除。

由於DNA雙鏈上的這個位點既沒有嘌呤鹼基也沒有嘧啶鹼基,因此被稱為AP位點(無嘌呤或無嘧啶)。然後,酶AP內切核酸酶切割核苷酸磷酸二酯鍵3'端的鍵。在這個階段,DNA聚合酶I識別下一個核苷酸單元3'端的磷酸二酯鍵,並將其切割。在去除核糖磷酸單元后,DNA聚合酶I分析互補鏈,發現與AP位點相對應的鹼基是鳥嘌呤。然後,酶在斷裂的DNA鏈上的AP位點插入胞嘧啶單元。最後,DNA連線酶將插入的胞嘧啶連線到受損鏈中。胞嘧啶自發脫氨基形成尿嘧啶可以被細胞修復。 [1]
快速改變法是一種用於生成位點特異性突變的技術,操作簡單。突變位點被整合到兩個互補引物中,其餘的質粒DNA在熱迴圈儀中用高保真DNA聚合酶合成。因此,整個過程被認為是快速的。
雖然反應是在熱迴圈儀中進行的,但它不是PCR。由於模板是環形的,新合成的單鏈DNA將在同一鏈上的引物起始處終止。該產物不會與互補鏈上的引物重疊。因此,新合成的DNA不能用作進一步DNA合成的模板。只有原始模板DNA可以用作模板。在每個迴圈中,新合成的DNA量等於模板量。這被認為是線性擴增,而不是PCR中的指數擴增。
由於模板DNA是從細菌中分離出來的,它含有甲基化的核苷酸。這使其對依賴甲基化的核酸酶(如DpnI)敏感。例如,在20個迴圈的擴增後,10 ng質粒將被擴增20倍,產生200 ng新的DNA。此時,將使用限制性內切酶DpnI來消除原始質粒DNA。然後將DNA混合物放入細菌中,每種DNA物種將在不同的細菌細胞中分離。為了檢視一個細胞是否含有正確的突變,需要挑取單個細胞,將其培養,並分析其所含的DNA。引物的設計至關重要。必須滿足78°C的最低退火溫度。否則,引物將不會與模板結合,終止將不會精確停止。
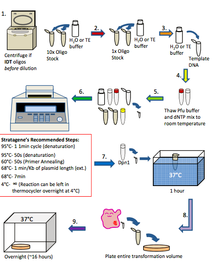
一般來說,快速突變技術按照以下步驟進行。該技術與 PCR 類似。1. 如果寡核苷酸來自 IDT:使用臺式離心機以高速旋轉寡核苷酸 1 分鐘,並用 H2O 或 TE 緩衝液將其重懸至 10 倍濃度(1250 ng/μl)。如果寡核苷酸來自 Allele:用 H2O 或 TE 緩衝液將寡核苷酸稀釋至 10 倍濃度(1250 ng/μl)。2. 將寡核苷酸進一步稀釋至 1 倍濃度(125 ng/μl),用 H2O 或 TE 緩衝液稀釋。3. 將模板 DNA 稀釋至 20-50 ng/μl,用 H2O 或 TE 緩衝液稀釋。4. 將 10 倍濃度的 pfu 超級緩衝液和 dNTP 混合物解凍至室溫。5. 在 100 μl 薄壁 PCR 管中設定快速突變反應:H2O:40 μl、10 倍濃度 PFU 超級緩衝液:5 μl、dNTP 混合物(10 mM):1 μl、模板 DNA(20-50 ng/μl):1 μl、正向引物(125 ng/μl):1 μl、反向引物(125 ng/μl):1 μl、PFU Ultra HF(2.5 u/μl):1 μl,總計:50 μl。6. 輕輕混合 PCR 管中的內容物,並將試管放入熱迴圈儀中。根據實驗需要對熱迴圈儀進行程式設計。7. 反應結束後,將 PCR 管從熱迴圈儀中取出,直接在 PCR 管中加入 1 μl Dpn1,並在 37°C 下孵育 1 小時。8. 使用 2-3 μl 經 Dpn1 處理的 PCR 反應液進行轉化(參見轉化方案),將整個體積接種到含有與模板 DNA 相對應的抗生素的 LB 瓊脂平板上。在 37°C 下培養過夜。9. 次日檢查平板上的菌落。如果有菌落,用它們接種 5 ml 過夜培養液,並在次日進行小型製備。將 5 μl 的小型製備 DNA 送去測序並分析結果。
1. Campbell, Neil A. (2005). 生物學. Pearson. ISBN 0-8053-7146-0. {{cite book}}: Check |isbn= value: checksum (幫助); Text "coauthors+ H.C. Van Ness, M.M. Abbott" ignored (幫助)
2. http://www.answers.com/topic/frameshift-mutation http://www.gmilburn.ca/2009/04/03/human-evolution-and-frameshift-mutations/ http://www-personal.ksu.edu/~bethmont/mutdes.html#types
