結構生物化學/吸熱反應
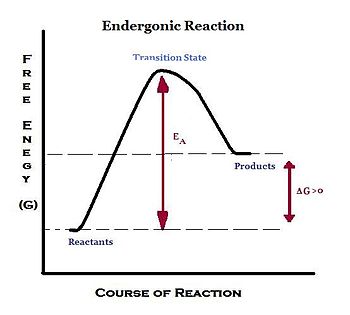
吸熱反應是指在整個反應過程中使用能量的化學反應,使反應非自發且熱力學上不利。能量隨著反應的進行而被吸收,並且周圍系統中存在淨能量損失。由於這種能量消耗,在恆定壓力和溫度下,吉布斯自由能的標準變化(ΔG)為正值:ΔG° > 0。
ΔG 的大小也代表驅動反應所需的能量數量。如果一個化學過程在一個方向上是放熱的,那麼反向過程必須是吸熱的。植物透過捕獲光線並將其轉化為可用於其他過程的化學能,從環境中獲得製造糖所需的能量。
吸熱反應的一些例子包括肌肉收縮和蛋白質合成。
吸熱反應的平衡常數,其中 ΔG° > 0 小於 1:K < 1。
吸熱反應需要來自外部來源的能量輸入,通常比非自發放熱反應的能量輸入更大,以擾亂化學平衡以引起變化,例如鍵形成。這種能量輸入被稱為活化能。在某些反應中,催化劑可用於加速吸熱反應。催化劑可以降低反應的活化能壘。因此,它加速了反應過程。吸熱反應的能量透過將反應與放熱反應偶聯獲得。
一個將放熱反應與吸熱反應偶聯以促進自發性的熟悉例子來自 ATP。ATP 透過將放熱反應與吸熱反應偶聯來為細胞工作提供動力。它負責介導細胞中的大多數能量偶聯,並且在大多數情況下,充當為細胞工作提供動力的直接能量來源。谷氨醯胺從穀氨酸和氨的合成自然上是吸熱的,非自發的,其 ΔG 值為 +3.4 kcal/mol,但將此反應與 ATP 水解的放熱過程偶聯,-7.3 kcal/mol,將推動反應向前,使其自發。同樣,放熱反應必須與 ATP 從 ADP 的形成偶聯,以使反應自發,並且在大多數情況下,細胞呼吸為製造 ATP 的吸熱過程提供能量,而植物則利用光能來產生 ATP。
透過研究以下情況,可以簡單地理解吸熱反應。在化學反應中,反應物生成產物,並達到平衡。吸熱反應是指透過某種形式的能量擾亂平衡,使產物比平衡量多。例如,熱量將被吸收進入系統,平衡將向右移動(朝著產物側)。因此,將形成更多產物。
吸熱反應
- 初始狀態的自由能 < 最終狀態的自由能
- 為了從初始狀態到最終狀態,需要將能量輸入系統。
- +ΔG
Zumdahl,化學第七版
Neil A. Campbell,Jan B Reece。生物學第七版,2005 年皮爾森教育公司。
http://academic.brooklyn.cuny.edu/biology/bio4fv/page/exergon.htm
