結構生物化學/酶/pH對酶活性的影響
pH的變化會影響酶。最有利的pH值被稱為最佳pH值。這是酶最活躍的點。這在圖中以圖形方式說明。
極高或極低的pH值通常會導致大多數酶完全失去活性。pH也是酶穩定性的一個因素。與活性一樣,每種酶也有pH最佳穩定性的區域。pH的變化會影響酶。這在圖中以圖形方式說明。File:Optimum pH.png
極高或極低的pH值通常會導致大多數酶完全失去活性。pH也是酶結構穩定性的一個因素。與活性一樣,每種酶也有pH最佳穩定性的區域。
pH的變化會影響酶。這在圖中以圖形方式說明。File:Optimum pH.png
除了溫度和pH外,還有其他因素,例如離子強度,也會影響酶促反應。為了使酶促反應準確且可重複,必須考慮和最佳化這些物理和化學引數。
酶通常在5-9的pH範圍內最活躍。這是因為蛋白質在反映此pH的環境中發揮作用。蛋白質具有狹窄的pH範圍的原因有很多。各種氨基酸殘基以及蛋白質的羧基和醯胺末端在細胞內pH範圍內具有pKa範圍。因此,pH的變化會使側基質子化或去質子化,從而改變其化學特徵。例如,在去質子化下,羧基末端可能失去與相鄰亞基的相互作用,從而改變酶構象。總之,這種構象會導致底物親和力降低。更劇烈的pH變化會改變蛋白質摺疊,從而完全失活酶或導致不可逆的蛋白水解。
然而,pH變化可以被酶用於調節或蛋白質功能。例如,當血漿呈酸性時,血紅蛋白會形成鹽橋。因此,血紅蛋白的T狀態穩定,對氧氣的結合親和力降低。這有利於將更多的氧氣輸送到缺氧的肌肉。
1. 底物與酶的結合。
2. 酶催化位點的氨基酸殘基的電離狀態。
3. 底物的電離狀態。
4. 蛋白質結構的變化(在極端的pH值下更明顯)。
當許多酶促反應速率是pH的函式時,它們會遵循鐘形曲線。
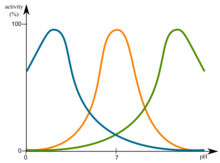
這些曲線反映了氨基酸殘基的電離狀態,這些殘基必須具有特定的電離狀態才能進行酶促活性。觀察到的pK值(最大值點)通常暗示了對酶活性至關重要的氨基酸殘基的特性。例如,觀察到的pK值為~4表明Asp或Glu對酶至關重要。pK值為~6可能暗示了His殘基,而pK值為~10則暗示了Lys殘基。
然而,重要的是要記住,酶所處的微環境也會影響其活性。例如,在非極性環境中或靠近另一個Asp殘基的Asp殘基比在任何其他環境中更強烈地吸引質子,並且具有更高的pK值。
此外,pH對酶的影響會導致酶變性,而不是特定催化殘基的質子化或去質子化。
可以透過進行定點誘變來替換特定殘基。這樣做為研究人員提供了一種可靠的方法來識別對底物結合或催化所必需的殘基。
波爾效應以克里斯蒂安·波爾命名,他研究並發現了氫離子和二氧化碳的影響。血紅蛋白協同性的發現幫助波爾研究了pH對酶的影響。在這個特定案例中,重點是氫離子對血紅蛋白蛋白和酶的影響。在瞭解波爾效應之前,需要解釋血紅蛋白的協同性。在血紅蛋白的協同性中,當氧氣濃度高時,氧氣的釋放得到促進。這是因為特殊的血紅蛋白特性促進了氧氣結合,當一個活性位點首先與氧氣結合時。血紅蛋白的這種能力將使它們能夠響應其他生理訊號,在這些訊號中需要更多的氧氣。
在這種情況下,收縮肌肉中代謝旺盛的組織通常會產生高濃度的氫離子和二氧化碳,它們是別構效應器,與血紅蛋白上非氧結合位點結合。波爾效應是指氫離子和二氧化碳調節血紅蛋白上的氧結合位點。
眾所周知,氫離子會降低溶液中的pH值,這種現象通常會降低血紅蛋白對氧氣的親和力,換句話說,它會增加氧氣的釋放。因此,在高pH值下,組氨酸(Beta-146)的側鏈沒有被質子化,鹽橋沒有形成,而在低pH值下,組氨酸的側鏈在被質子化時會形成鹽橋。這將導致血紅蛋白中T狀態的穩定,這也增加了氧氣的釋放。
當二氧化碳透過人體時,發生的第一個機制是它與水反應生成碳酸(H2CO3),由碳酸酐酶加速。碳酸很容易解離成HCO3- 和 H+,並降低pH值,如前述機制所述。
二氧化碳影響血紅蛋白中氧親和力的另一種方式是二氧化碳和血紅蛋白的直接機制。二氧化碳透過與末端氨基反應形成氨基甲酸鹽基團(負電荷)來穩定脫氧血紅蛋白(T狀態)。然後,這些氨基甲酸鹽基團可以自由形成鹽橋,從而穩定T狀態並釋放氧氣。氨基甲酸鹽基團的形成由碳酸酐酶催化。氨基甲酸鹽基團形成後,氨基甲酸鹽會解離成碳酸氫根離子和質子。鹽橋透過質子化組氨酸形成,然後與天冬醯胺形成橋。
由於所有酶都有一個最佳pH值,在該pH值下其催化活性達到峰值,因此酶也有一個最佳溫度。有兩種已知的酶熱性質會影響催化速率。這兩個是活化能和熱穩定性。然而,溫度與酶活性之間的實驗資料並沒有清楚地與人們所尋求的活性僅僅隨著溫度升高而增加的觀點相符。一種稱為平衡模型的新模型透過引入酶的非活性形式,為反應條件下酶熱行為提供定量解釋,形成一個遵循基本化學中勒沙特列原理的類似規則的平衡系統。平衡模型在消除人們認為在酶活性與溫度之間的經典觀點中重要的時間依賴性方面提供了一些見解。平衡模型背後的理念是,在不同的溫度梯度下,與活性形式一起新增的酶的非活性形式透過平衡力學阻止活性酶的完全失活。但是應該注意的是,必須瞭解酶的非活性形式和活性形式之間的差異。平衡模型透過純粹地根據其活性位點集中其活性來描述酶的非活性形式。酶的活性位點是底物能夠結合的位點,然後繼續進行酶的構象變化,然後進一步進行預期的生化反應。該模型中的非活性酶被描述為與酶的活性形式相比僅僅是摺疊變化。這不能與變性的酶混淆。變性的酶是完全改變的酶,包括活性位點,其程度已達到酶完全無法發揮作用的地步,換句話說,它是不可逆的酶構象變化。在平衡模型的情況下,該模型的機制之所以有效,僅僅是因為酶的非活性形式的可逆性。酶的非活性形式可以逆轉回其活性形式,這與提出的模型的平衡力學背後的整個理念完全一致。
Berg, Jeremy "生物化學", 第7章 血紅蛋白:蛋白質作用的肖像. 193-194. 第六版. Freeman and Company, 2007. http://hrsbstaff.ednet.ns.ca/sdosman/Higher%20level%20BIO/enzymenotes3.6.htm
Roy M. Daniel, Michael J. Danson, 溫度如何影響酶催化活性的新認識, 生物化學趨勢, 第35卷, 第10期, 2010年10月, 第584-591頁, ISSN 0968-0004, 10.1016/j.tibs.2010.05.001.
