結構生物化學/酶
酶是生物系統中幫助加速(催化)化學反應的大分子。這通常是透過降低過渡態或降低活化能來加速反應。

在沒有酶的情況下,一些生物反應的速度可能慢一百萬倍。幾乎所有的酶都是蛋白質,但反之則不然,其他分子如 RNA 也可以催化反應。酶最顯著的特徵是它們加速化學反應的能力和它們對特定底物的特異性。酶利用各種分子間作用力(範德華相互作用、極性相互作用、疏水相互作用和氫鍵)使底物以最優的取向結合在一起,從而發生反應。此外,酶可以透過稱為競爭性、非競爭性和反競爭性抑制劑的特定分子抑制。
催化發生在酶的活性位點。它包含直接參與鍵形成和斷裂的殘基。這些殘基被稱為催化基團。雖然酶在結構、特異性和催化方式上差異很大,但關於它們的活性位點可以做出一些概括性描述。
1. 活性位點是由來自酶不同部分的基團形成的三維裂縫或凹陷 - 在氨基酸序列中相隔很遠的殘基可能比序列中相鄰的殘基相互作用更強烈。
2. 活性位點只佔酶總體積的相對較小的一部分。酶中的大多數氨基酸殘基不與底物接觸,這就引出了一個問題:為什麼酶如此之大?幾乎所有的酶都由 100 多個氨基酸殘基組成。這些“額外的”氨基酸充當支架,從在初級結構中相隔很遠的氨基酸中建立三維活性位點。在許多蛋白質中,剩餘的氨基酸也構成調節位點、與其他蛋白質相互作用的位點或將底物帶到活性位點的通道。
3. 活性位點是獨特的微環境。在所有已知結構的酶中,底物分子都結合到裂縫或凹陷中。水通常被排除在外,除非它是反應物。裂縫的非極性微環境增強了底物的結合以及催化作用。然而,裂縫中也可能包含極性殘基。其中一些極性殘基獲得對底物結合或催化至關重要的特殊性質。
4. 底物透過多個弱相互作用結合到酶上。如上所述
5. 結合的特異性取決於活性位點中原子精確定義的排列。由於酶和底物透過需要緊密接觸的短程力相互作用,底物必須具有匹配的形狀才能進入該位點。然而,一些酶的活性位點只在底物結合後才呈現出與底物互補的形狀。這種動態識別過程稱為誘導契合。
酶具有高度特異性,並且可能需要輔助因子才能進行催化。輔助因子是一種與蛋白質結合的非蛋白質化學化合物;輔助因子有兩種型別:金屬和有機/金屬有機(來源於維生素)。金屬輔因子的例子是鋅和酶碳酸酐酶,它們在活性位點緊密結合鋅。該過程涉及將水結合到二氧化碳並將其去質子化為碳酸。然後,碳酸由於水的置換而成為碳酸氫根離子。
催化劑可以透過降低過程的活化能(不是過渡態)來加快反應速度。活性位點是酶上的一個位置,其形狀與底物互補。它也是氨基酸與配體具有互補電荷、極性和形狀的位置。
酶的功能和催化作用源於穩定化學反應中過渡態的能力。過渡態是反應中能量最高的物質。它是一種瞬態分子結構,不再是底物,但還沒有成為產物。它是反應路徑中最少被佔據的物質。過渡態與底物之間的自由能差稱為吉布斯自由能活化能,或簡稱為活化能。
因此,我們可以看到酶如何運作的關鍵:酶透過降低活化能來加速反應。底物和酶的結合創造了一條反應路徑,其過渡態低於在沒有酶的情況下反應的過渡態。由於活化能較低,更多的底物分子具有達到過渡態所需的能量。
重要的是要注意,酶已經進化到專門識別化學反應的過渡態。因此,酶不會在物質真正開始反應之前與任何反應性物質結合;酶只識別並結合此類物質的過渡態。事實上,如果酶能夠“當場”或立即結合反應物,這將導致比以前更高的活化能!出於這個原因,酶只識別過渡態,並且只在達到這種高能態時才與反應性物質結合。酶能夠識別像過渡態這樣特定且短暫的結構,證明了它們令人難以置信的特異性和效率。
每種酶都針對特定的反應過渡態進行了最佳化。這確保了酶不會相互競爭,從而阻礙細胞反應,而不是幫助它們。酶抑制是指以某種方式破壞或中斷給定酶的活性的過程。抑制劑可以是形狀、結構或電荷與底物相似的分子,因此酶的活性位點會將抑制劑“誤認為”底物。這會影響酶對底物的親和力,以及整個反應的速度。細胞中可能發生幾種型別的抑制;關於這些抑制的更詳細解釋可以在相應的章節中找到。
由於活性位點,酶是高度特異性的催化劑。這些催化劑受降低自由能克服過渡態的能力支配。米氏常數模型描述了許多酶的動力學性質。
底物與酶之間的相互作用有助於加速反應,酶的特異性導致副反應最小。
需要注意的是,酶無法改變熱力學定律,因此也無法改變反應的平衡。使用酶進行反應生成的產物量始終等於在相同反應混合物中沒有酶的情況下發生的相同反應生成的產物量。酶只是使反應更快地達到平衡。平衡位置僅取決於反應物和產物之間的自由能差。
6. 酶只改變反應速率,不改變反應平衡。酶不能改變熱力學定律;因此,它不能改變化學反應的平衡。有酶存在時,與沒有酶存在時相比,產物形成更快。酶只加速反應速率,不改變平衡位置(自由能,delta G)。
"鎖鑰" 模型最早由有機化學家埃米爾·費歇爾於 1894 年提出。在這個模型中,"鎖" 指的是酶,"鑰匙" 指的是其互補的底物。每種酶都具有與底物互補的高度特異的幾何形狀。為了啟用酶,其底物必須首先與酶上的活性位點結合。只有這樣,催化反應才會發生。但是,就像鎖和鑰匙一樣,酶和底物的形狀必須互補並且完美匹配。由進化設計,酶的活性位點通常在其底物識別方面具有高度特異性,並且能夠區分立體異構體。
根據鎖鑰模型,酶和底物的幾何形狀都無法改變,因為它們都是預先確定的。因此,底物與酶活性位點的結合不會改變酶的形狀。雖然這個理論有助於解釋酶的特異性,但它不能解釋過渡態的穩定性,因為它需要更多的能量才能達到過渡態複合物。因此提出了誘導契合模型,在這個模型中,像蛋白質一樣的酶是靈活的。誘導契合的概念是,當底物與酶的活性位點結合時,會發生構象改變和結構適應,使該結合位點更具互補性和更緊密。本質上,底物並非簡單地與剛性活性位點結合,而是酶表面的大分子、弱相互作用力和疏水特性會塑造成一個精確的結構,從而實現誘導契合,使酶能夠發揮最大的催化功能。 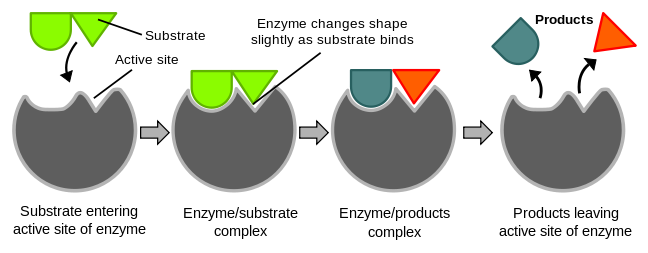

過渡態理論指出,在酶催化中,酶與其"過渡態複合物"的結合比與其基態反應物的結合更強。本質上,過渡態更穩定。過渡態的穩定降低了反應物和產物之間的活化能壘,從而提高了反應速率或酶活性,因為這將有利於過渡態複合物形成的增加。
在過渡態理論中,反應物的相互作用機制無關緊要。但是,參與反應的碰撞分子必須具有足夠的動能才能克服活化能壘才能發生反應。在許多情況下,溫度、pH 或酶可以改變以促進過渡態的穩定,以及在統計上增加分子碰撞並形成過渡態複合物的可能性。對於像 Sn2 這樣的雙分子反應,當兩個分子的舊鍵減弱而新鍵開始形成或舊鍵先斷裂形成過渡態,然後新鍵形成之後,就會形成過渡態。該理論表明,當反應分子相互靠近時,它們會暫時處於比反應物或產物都不穩定的狀態。
- 一些催化劑為分子提供電荷,使其對其他反應物更具吸引力。酸就是這種催化劑的例子。它們賦予反應物種正電荷以吸引負電荷或部分負電荷的反應物,從而增加兩種物種碰撞和反應的機會。
- 一些催化劑會增加反應物的區域性濃度,使它們更有可能發生碰撞。
- 一些催化劑可能會改變一個反應物的形狀,使其更容易受到其他分子的影響。
1. 共價催化 - 在催化過程中,一個強大的親核試劑暫時附著在底物的一部分上。親核試劑包含在活性位點中。蛋白水解酶胰凝乳蛋白酶是這種策略的一個很好的例子。它是一種底物,與活性位點中的殘基或與輔助因子形成短暫的共價鍵,這增加了額外的中間體並降低了後續過渡的能量。
2. 通用酸鹼催化 - 水通常充當供體或受體,但在酸鹼催化中,提供或接受質子的分子不是水。這種策略結合了鹼催化和酸催化,以縮短反應時間。在胰凝乳蛋白酶的情況下,該酶使用組氨酸殘基作為鹼催化劑來增強絲氨酸的親核性,類似於碳酸酐酶中組氨酸殘基如何促進從鋅結合水分子中去除質子以產生氫氧根的方式。
3. 近似催化 - 在這種方法中,反應有利於將兩種底物帶到酶上的單個結合表面。兩種底物被帶到一個區域,這增加了反應速率。例如,NMP 激酶將兩個核苷酸結合在一起,以改善磷醯基的轉移。
4. 金屬離子催化 - 金屬離子可以以多種方式參與催化。鋅可以幫助形成親核試劑。它使水的 pka 從大約 14 改變到 7,這使得它可以在中性 pH 下被質子化。它還可以透過在複合物中充當親電子試劑來穩定負電荷。金屬離子還用於增加底物的結合能,將它們保持在一起。金屬離子還可以充當酶和底物之間的橋樑,在 NMP 激酶的情況下充當輔因子。
1. 蛋白酶(胰凝乳蛋白酶和胰蛋白酶):任何透過水解連線多肽鏈中氨基酸的肽鍵進行蛋白水解(蛋白質分解代謝)的酶。
示例實驗:定點誘變應用聚合酶鏈反應 (PCR) 及含有所需突變的寡核苷酸引物,在新建鏈中進行工程化錯配,在第一個迴圈 DNA 中開發突變。
2. 碳酸酐酶(金屬酶)這些酶催化二氧化碳和水快速相互轉化為碳酸氫根和質子,這是一個在沒有催化劑的情況下發生得相當緩慢的可逆反應。
3. 限制性內切酶 (BamHI) 它是一種限制性酶,它在特定的識別核苷酸序列(限制性位點)處切割雙鏈 DNA。
4. 核苷單磷酸激酶 (NMP 激酶) 這些酶將磷酸基團從高能供體分子 (ATP) 轉移到特定的底物(磷酸化)。

酶的催化活性取決於稱為輔因子的少量分子的存在。催化活性的作用隨酶及其輔因子而異。一般來說,這些輔因子可以執行標準 20 種氨基酸無法執行的化學反應。沒有輔因子的酶稱為脫輔酶,而具有完全催化活性的酶稱為全酶。
輔因子可分為兩類:金屬和輔酶。金屬對於酶很重要,因為它們是分子輔助物質,在維持機體代謝的一些酶促反應中起著至關重要的作用。它們還有助於穩定酶的形狀。例如,鐵有助於蛋白質血紅蛋白將氧氣輸送到體內的器官,而銅有助於超氧化物歧化酶清除細胞內積累的有害自由基。輔酶是小的有機分子,通常來自維生素。輔酶可以與酶緊密或鬆散結合。緊密結合的稱為輔基,而鬆散結合的輔酶就像底物和產物一樣,與酶結合並從酶中釋放出來。使用相同輔酶的酶通常透過類似的機制進行催化。
| 類別 | 還原型別 | 示例 |
|---|---|---|
| 水解酶 | 催化水解反應 | 酯酶消化酶 |
| 異構酶 | 催化異構化(將分子改變為其異構體) | 磷酸己糖異構酶,延胡索酸酶 |
| 連線酶 | 催化與 ATP 水解偶聯的鍵形成。 | 檸檬酸合成酶 |
| 裂解酶 | 催化基團消除以形成雙鍵(或環狀結構)。 | 脫羧酶 醛縮酶 |
| 氧化還原酶 | 催化氧化還原反應 | 脫氫酶 氧化酶 |
| 轉移酶 | 催化官能團在分子間的轉移。 | 轉氨酶 激酶 |
酶的分類在表格中顯示為其類別和酶所經歷的還原型別。例如,葡萄糖磷酸轉移酶。在這個反應中,ATP 將其一個磷酸基團轉移到葡萄糖:ATP + D-葡萄糖 -> ADP + D-葡萄糖 6-磷酸。由於此過程將磷酸基團“轉移”到葡萄糖,因此它屬於轉移酶分類,因此得名“葡萄糖磷酸轉移酶”。由於許多酶具有不與其功能或催化的反應型別相關的通用名稱,因此建立了酶分類系統。為了便於命名酶,建立了六類酶,並根據其催化的物質細分為子類。根據催化的反應型別,酶可以有不同的名稱。這些類別是氧化還原酶、轉移酶、水解酶、裂合酶、異構酶和連線酶。這是用於酶的國際分類。例如,常見的氧化還原酶是脫氫酶。脫氫酶被稱為一種氧化底物並轉移質子的酶。酶通常用於催化官能團、電子或原子的轉移。由於這種情況,它們根據催化的反應型別進行命名。這允許新增一個四位數,它將位於 EC(酶委員會)之前,並且每種酶都可以被識別。必須知道酶催化的反應才能對其進行分類。
氧化還原酶催化氧化還原反應,其中電子被轉移。這些電子通常以氫化物離子或氫原子的形式存在。當底物被氧化時,它是氫供體。最常用的名稱是脫氫酶,有時也會使用還原酶。當氧原子是受體時,稱為氧化酶。
轉移酶催化基團轉移反應。轉移發生在一個將成為供體的分子到另一個將成為受體的分子之間。大多數情況下,供體是一個輔因子,它帶有一個即將被轉移的基團。
水解酶催化涉及水解的反應。這種情況通常涉及將官能團轉移到水。當水解酶作用於醯胺、糖苷、肽、酯或其他鍵時,它們不僅催化從底物上水解去除基團,而且還催化將基團轉移到受體化合物。這些酶也可以歸類為轉移酶,因為水解可以被視為將官能團轉移到水作為受體。然而,由於受體與水的反應很早就被發現,因此它被認為是酶的主要功能,這使得它能夠歸入此分類。
裂合酶催化反應,其中官能團被新增到分子中的雙鍵以斷裂雙鍵,或者相反地,透過去除官能團形成雙鍵。
異構酶催化將官能團在分子內轉移的反應,從而產生異構體形式。這些酶允許化合物內的結構或幾何變化。有時,相互轉化是透過分子內氧化還原反應進行的。在這種情況下,一個分子既是氫受體又是氫供體,因此沒有氧化產物。缺少氧化產物是這種酶屬於此分類的原因。子類別是在此類別下根據異構體的型別建立的。
連線酶用於催化兩個底物連線,以及由於縮合反應而形成碳-碳、碳-硫、碳-氮和碳-氧鍵。這些反應與 ATP 的裂解相偶聯。
動力學
[edit | edit source]化學反應速率的研究稱為動力學,酶催化反應速率的研究稱為酶動力學。酶活性的動力學描述將有助於我們瞭解酶的功能。例如,速率 V 是在指定時間內消失的 A 的數量。它等於 P 出現的速率,或是在指定時間內出現的 P 的數量。
A -----> P
速率 V 是在指定時間內消失的 A 的數量。它等於 P 出現的速率,或是在指定時間內出現的 P 的數量。
V = ∆A/∆T = ∆P/∆T
如果 A 是黃色的,而 P 是無色的,我們可以透過測量黃色強度隨時間的降低來跟蹤 A 濃度的降低。現在只考慮 A 濃度的變化。反應速率與 A 的濃度成正比,比例常數為 k,稱為速率常數。
V = k[A]
米氏模型
[edit | edit source]米氏模型用於描述許多酶的動力學特性。在這個模型中,酶 (E) 與底物 (S) 結合形成酶-底物 (ES) 複合物,然後繼續形成產物 (P) 或解離成 E 和 S。
產物形成速率 V0 可以透過米氏方程計算
Vmax 是當酶完全被底物飽和時的反應速率。KM 是米氏常數,它是最大反應速率一半時的底物濃度。動力學常數 kcat 稱為週轉數,它是當酶被底物飽和時,單個催化位點每單位時間轉化為產物的底物分子數量。它通常佔大多數酶的 1 到 104 秒-1 之間。
別構酶是一類重要的酶。它的催化活性可以被調節。它具有多個活性位點,這些活性位點表現出協同性,正如反應速度對底物濃度的 S 形依賴性所證明的那樣。我們還發現,K max 是底物濃度,在該濃度下,特定時間內的總體反應速率是 V max 的一半。另一方面,V max 是最大反應速率,在該速率下,活性位點完全被底物飽和。由於這種物理特性,我們看到,無論隨後新增多少底物,反應的相對速率都不會改變,因為額外的底物不會對與結合活性位點的任何動力學相互作用做出貢獻。隨著底物的增加和反應達到平衡,親和力也不會發生變化。
複製型 DNA 聚合酶
[edit | edit source]已經對細胞核中的三種多亞基 DNA 聚合酶進行了研究。這為深入瞭解真核細胞中複製機制提供了見解。第一個透過晶體學解決的 DNA 聚合酶結構是大腸桿菌 DNA 聚合酶 I 的克萊諾片段。這種結晶揭示了一種類似於右手的手掌、手指和拇指的結構。對克萊諾片段的研究表明,DNA 結合在裂隙內,並且手指和拇指結構在許多聚合酶家族中是保守的。聚合酶活性位點殘基位於手掌域。手指對於核苷酸結合很重要,而拇指域結合 DNA。

結論 酶能夠加速反應。它們可以將反應速率提高 10^6 倍或更多。一些酶需要輔因子才能發揮作用。輔因子包括維生素衍生的有機分子(輔酶)和金屬離子。酶的其他作用包括降低化學反應的活化能。催化的第一步是形成酶底物複合物。此外,酶識別底物伴隨著活性位點的構象變化。
一般來說,隨著溫度的升高,酶的催化活性會增加,這是關於溫度對催化活性影響的經典模型和理解。然而,經典模型被發現可能不能準確地描述溫度對酶催化活性的真實影響。Roy M. Daniel 和 Michael J. Danson 研究了新的模型——平衡模型,它為我們提供了關於溫度如何影響酶催化活性的新理解。
經典模型
經典模型描述了溫度對酶的影響。主要描述的是,隨著溫度的升高,催化速率呈指數增長,而由於變性,活性酶的量會下降。經典模型沒有顯示出是否存在一個最佳溫度,在這個溫度下,催化活性達到最大值。
表示經典模型的方程:Vmax= kcat[E0]e-kinactt
平衡模型
在平衡模型中,它引入了酶的非活性形式,這種形式可逆地變為活性形式。酶的活性形式和非活性形式之間的可逆性是一個溫度依賴的因素,其中酶的量是決定因素。描述任何時間點活性酶量的方程為:[Eact] = ([E0]-[X])/( 1+ Keq) 在這種情況下,非活性酶並不意味著酶變性了,它只是意味著活性位點發生了足夠的改變,使得酶無法與底物結合,因此它是可逆的。
該模型顯示出一個最佳溫度,在該溫度下酶活性最大,這與經典模型不同。它考慮了 Vmax 隨時間和溫度的變化,還包括四個引數:G*cat、G*inact、Heq 和 Teq。該模型目前被用來最好地描述由於溫度而發生的酶活性位點的進化,並且也最好地解釋了溫度對酶的影響。
兩種模型之間的主要區別
經典模型是溫度依賴的,並且沒有描述出催化活性的最佳溫度。
Jeremy M. Berg、John L. Tymoczko 和 Lubert Stryer 著,《生物化學》第 7 版。2007 年。
Berg, Jeremy M., Tymoczko, John L., Stryer, Lubert. 生物化學。第七版。
http://www.ncbi.nlm.nih.gov/pubmed/20554446
http://ars.els-cdn.com/content/image/1-s2.0-S0968000410000897-gr1.jpg



![{\displaystyle {\frac {1}{v_{0}}}={\frac {K_{M}+[S]}{V_{\max[}S]}}={\frac {K_{M}}{V_{\max }}}\cdot {\frac {1}{[S]}}+{\frac {1}{V_{\max }}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f2e414bdbcccae96840f4a5c32e303e33b5be72)