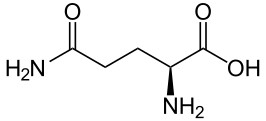
結構生物化學/蛋白質/氨基酸
蛋白質是由多個被稱為氨基酸的單體亞基組成的聚合物,這些單體具有許多不同的官能團。自然界中存在 500 多種氨基酸,但從細菌到人類所有物種的蛋白質主要由 20 種被稱為必需氨基酸的氨基酸組成。這 20 種主要氨基酸,以及數百種其他次要氨基酸,維持著我們的生命。蛋白質可以與其他蛋白質和生物分子相互作用形成更復雜的結構,並具有剛性或柔性結構以執行不同的功能。碘化酪氨酸和溴化酪氨酸也是在物種中發現的氨基酸,但由於其稀有性而未被列入 20 種主要氨基酸:碘化酪氨酸僅存在於甲狀腺激素中,而溴化酪氨酸僅存在於珊瑚中。下面列出了在大多數(但不是全部)蛋白質中發現的 20 種主要氨基酸。
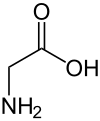
氨基酸是同時含有羧酸基和胺基的分子。在氨基酸中,羧基比羧酸更酸性。2-氨基酸,也稱為α-氨基酸,是一種特殊的氨基酸,構成了蛋白質。這些氨基酸具有許多有趣的特性,將在接下來的部分中討論。
氨基酸在作為蛋白質的構建塊和作為代謝中間體方面發揮著核心作用。蛋白質是由將一個氨基酸的 α-羧基與另一個氨基酸的 α-氨基連線而成的線性聚合物。這種連線稱為肽鍵或醯胺鍵。兩個氨基酸形成二肽伴隨著一個水分子的丟失。在這種情況下,反應的平衡偏向於水解而不是合成。因此,肽鍵的生物合成需要自由能的輸入。儘管如此,肽鍵在動力學上相當穩定,因為水解速率極其緩慢;在沒有催化劑的情況下,肽鍵在水溶液中的壽命接近 1000 年。因此,蛋白質中發現的 20 種氨基酸傳達了廣泛的化學多功能性。特定蛋白質的精確氨基酸含量及其氨基酸順序由編碼該蛋白質的基因中的鹼基順序決定。蛋白質中氨基酸的化學性質決定了蛋白質的生物活性。蛋白質不僅催化活細胞中的所有(或大多數)反應,而且還控制著幾乎所有細胞過程。此外,蛋白質在其氨基酸序列中包含確定該蛋白質將如何摺疊成三維結構以及所得結構穩定性的必要資訊。蛋白質摺疊和穩定性領域多年來一直是至關重要的研究領域,並且至今仍是未解之謎。然而,它正在積極研究中,並且每天都在取得進展。
構成蛋白質的 20 種主要氨基酸。它們中的每一種都含有一個獨特的官能團,從而產生不同的特性。這些性質包括大小、形狀、電荷、氫鍵能力、親水性/疏水性(疏水相互作用)和化學反應性。根據 R 基側鏈的化學性質,氨基酸可以大體上分為疏水性和親水性。在水性環境中,疏水氨基酸無法參與氫鍵。它們相互締合,主要位於蛋白質內部。另一方面,親水氨基酸由於極性而傾向於在水性環境中相互作用。這些氨基酸通常位於外表面。
當羧酸基去質子化而氨基同時質子化時,氨基酸處於兩性離子狀態。兩性離子是偶極離子——意味著這些分子具有兩種電荷,即正電荷和負電荷。水溶液的 pH 值是決定質子化狀態的一個因素。這種狀態使羧基端帶負電荷 (-COO-),而相鄰的氨基端帶正電荷 (-NH3+)。羧基 (-COO-) 首先去質子化,因為其 pKa 約為 2,而胺基 (-NH3+) 的 pKa 約為 9。兩性離子形式的蛋白質的淨電荷為零。 [1] 以這種方式表現的分子稱為兩性離子。在固態中,胺官能團會使羧酸基去質子化,從而產生兩性離子、偶極實體。氨基酸在水溶液中的帶電狀態很大程度上取決於 pH 值。在 pH 值為 2 到 9 的情況下,所有氨基酸的主要形式是兩性離子形式。在強酸性 (pH < 2) 中,主要的形態是完全質子化的銨陽離子,以及相應的羧酸的質子化形式。該物種的淨電荷為 +1。在強鹼性溶液 (pH > 9) 中,主要的形態是完全去質子化的氨基羧酸陰離子。該物種的淨電荷將為 -1。這些形式透過酸鹼平衡相互轉化。這留下了很大的 pH 範圍,在該範圍內兩性離子將作為主要物種發揮很大作用。質子化程度等於去質子化程度的 pH 值稱為等電 pH 或等電點 (pI)。在這個 pH 值下,正電荷的量等於負電荷的量,並且電荷中和的兩性離子形式的濃度達到最高。當酸的側鏈帶有額外的酸性或鹼性官能團時,pH 值分別降低或升高。請注意,在大多數相關的生理 pH 範圍內,兩性離子將是迄今為止最豐富的物種。
組氨酸含有一個咪唑環,其中有 2 個氮原子:一個呈鹼性,另一個不呈鹼性。鹼性氮參與了在酶催化過程中很重要的離域化。
以下是在中性 pH 下 L-氨基酸形成兩性離子的示例

所有蛋白質或多肽都是一系列連線的氨基酸。一個典型的α-氨基酸由一箇中心碳(在本例中是 α-碳)組成,該中心碳連線到一個氨基 (-NH2)、一個羧酸 (-COOH)、一個氫原子和一個獨特的 R 基。R 基通常被稱為側鏈,決定著每種氨基酸的性質。科學家根據側鏈的性質將氨基酸分為不同的類別。具有四個不同基團的四面體碳原子稱為手性。分子能夠將平面偏振光旋轉到左側,L(左旋)或右側,D(右旋)賦予它旋光和立體化學指紋。多肽中的所有氨基酸均以 L 形式配置。L 形式對應於 S 的絕對構型,這是一種用於指定有機化學領域立體化學的系統。雖然 D-氨基酸(在有機化學領域被指定為 R 立體異構體)天然存在,但它們不會出現在蛋白質中。到目前為止,科學家還沒有提出關於生物體對 L 氨基酸的偏好的假設。然而,很明顯,所有氨基酸的下游生理機制都針對識別和與特定的 L 構象相互作用。注意:由於中心碳連線著四個不同的基團,因此所有氨基酸都是手性的,除了甘氨酸,它是非手性的。這是因為甘氨酸的中心碳原子僅包含 3 個獨特取代基,而不是 4 個(R 側鏈 = H)。
在蛋白質中,可以找到不屬於 20 種標準型別的氨基酸。大多數這些氨基酸是透過對已經整合的氨基酸進行化學修飾而產生的。例如,膠原蛋白中存在脯氨酸的羥基化形式。此外,已知谷胱甘肽過氧化物酶中存在半胱氨酸的硒類似物。吡咯賴氨酸也被分離和鑑定。這些規則的例外是由 DNA 和 RNA 編碼並由它們決定的,還有更多例子。
任何關於氨基酸的討論都不完整,沒有提到每個氨基酸是如何連線到另一個氨基酸的。所有氨基酸透過一個涉及一個氨基酸的胺基和另一個氨基酸的羧酸基的縮合反應相互連線。這種酶促催化的反應形成醯胺實體:[R1-NH2 + R2-COOH ==> R1-NH-C(=O)-R2 + H2O]。醯胺鍵具有特殊的性質,因為它具有共振形式,這使得該鍵具有平面、剛性、雙鍵的特徵:[R1-N-C(=O)-R2 <==> R1-N+=C(-O-)-R2]。氨基酸可以以只有 2 或 3 個氨基酸的小單位連線在一起,稱為二肽和三肽,但也可以連線成由數百甚至數千個氨基酸組成的非常長的鏈。每個完整的肽鏈都有一個 N 末端(氨基)和一個 C 末端(羧酸鹽)。肽鍵系統中涉及的整體 4 個原子角對於研究蛋白質的人來說很重要。特別是,R-[N-C-C(=O)-N]-R 基團被稱為 phi 扭轉角,而相鄰的角,即 psi 角,φ 扭轉角,涉及 R-[C-N-C-C(=O)]-R 基團。這些角度很重要,已知肽角的自然分佈在拉氏圖中進行了總結。肽鍵由縮合反應形成,並由水解(加水)斷裂。

四肽是一種透過肽鍵連線了四個氨基酸的肽。

氨基酸分類
- 非極性氨基酸
- 脂肪族 : 甘氨酸、丙氨酸、纈氨酸、異亮氨酸、亮氨酸
- 芳香族 : 苯丙氨酸、色氨酸。
- 環狀 : 脯氨酸
- 極性氨基酸
- 含硫 : 半胱氨酸、蛋氨酸
- 含羥基 : 絲氨酸、蘇氨酸
- 芳香族 : 酪氨酸
- 酸性醯胺 : 天冬醯胺、谷氨醯胺
- 帶電氨基酸(在生理 pH 下)
- 酸性 : 天冬氨酸、穀氨酸
- 鹼性 : 組氨酸、賴氨酸、精氨酸
- 網路方法有助於確定蛋白質結構中已知位置的特定氨基酸的作用。網路透過將系統分解為一系列連結來簡化複雜系統的行為。連結代表蛋白質分子中氨基酸的相鄰位置。由於蛋白質以這種方式連線,並且蛋白質結構網路僅透過其他幾個氨基酸元素相互連線,因此我們可以確定摺疊機率。蛋白質結構網路越密集,摺疊越容易,並且隨著蛋白質結構變得更加緊湊,摺疊機率會增加。
- 網路方法也可以應用於預測蛋白質中的活性中心。活性中心是蛋白質片段,它們在各自蛋白質顯示的酶功能的催化反應中發揮關鍵作用。科學家已經使用遠端網路拓撲結構從網路骨架中建立網路,他們可以從中僅研究對整個蛋白質資訊流至關重要的側鏈。網路分析表明,活性中心在蛋白質結構網路中佔據中心位置,通常具有許多鄰居,在其附近給出獨特的連線,整合整個網路的通訊,不參與普通殘基的浪費行為,並收集和協調網路中的大部分能量。

結構丙氨酸,也稱為 2-氨基丙酸,(縮寫為 Ala 或 A)是一種 α-氨基酸,化學式為 HOOCCH(NH2)CH3。它的摩爾質量為 89.09 g/mol,密度為 1.424 g/cm3。丙氨酸的 α-碳原子與一個甲基(-CH3)相連,使其成為最簡單的 α-氨基酸之一,因為它在分子結構方面最簡單,這也導致丙氨酸被歸類為脂肪族氨基酸。丙氨酸的甲基不反應,因此幾乎從不直接參與蛋白質功能。丙氨酸是非極性疏水分子。它具有兩面性,這意味著它可以位於蛋白質分子的內部或外部。丙氨酸的 α-碳具有光學活性;在蛋白質中,只發現了 L-異構體。
特徵丙氨酸是一種非必需氨基酸,這意味著它可以由人體制造,不需要直接從飲食中獲得。丙氨酸存在於各種食物中,但特別集中在肉類中。它是一種非必需氨基酸,在血漿中以遊離狀態高濃度存在。
功能丙氨酸是糖和酸代謝的主要氨基酸。它透過產生抗體來增強免疫系統,併為肌肉組織、大腦和中樞神經系統提供能量。它用於注射或輸注的藥物製劑中。它也用作膳食補充劑和美拉德反應產物中的風味化合物。此外,它是一種刺激胰高血糖素分泌的物質。
化學合成 丙氨酸可以在體內由丙酮酸和支鏈氨基酸(如纈氨酸、亮氨酸和異亮氨酸)合成。丙氨酸最常見的是由丙酮酸的還原胺化產生的。由於轉氨基反應是可逆的,丙酮酸的分佈很廣,所以丙氨酸很容易形成,因此與糖酵解、糖異生和檸檬酸迴圈等代謝途徑密切相關。它也與乳酸一起產生,並透過丙氨酸迴圈從蛋白質中產生葡萄糖。可以透過施特雷克反應,在氰化鉀存在下,乙醛與氯化銨縮合,製備外消旋丙氨酸。
分析 丙氨酸可以透過紫外光譜、紅外光譜 (IR)、核磁共振波譜 (NMR) 和質譜法來鑑定。
精氨酸 - Arg/ R
[edit | edit source]結構 精氨酸,2-氨基-3-氨基甲醯丙酸,包含一個三碳脂肪族直鏈,其末端被一個胍基封端。其摩爾質量為 132.12g/mol。胍基的 pKa 為 12.48,在中性、酸性和甚至大多數鹼性環境中都帶正電荷。因此,精氨酸具有鹼性化學性質。由於雙鍵與氮孤對之間的共軛,正電荷被離域化,並能夠形成多個氫鍵。
特點 精氨酸是一種必需氨基酸,在氮代謝中起著重要作用。它是血管擴張劑一氧化氮(一種血管擴張劑)的化學前體。一氧化氮是一種強大的神經遞質,有助於血管舒張,改善血液迴圈。富含精氨酸的食物包括紅肉、魚、家禽、小麥胚芽、穀物、堅果和種子,以及乳製品。
功能 精氨酸有助於傷口癒合,並有助於燒傷治療。它透過增強 T 細胞的產生,對正常的免疫系統活動是必需的。研究表明,精氨酸可能有助於治療透過增加血管舒張而得到改善的疾病。一些用精氨酸治療的疾病包括胸痛、動脈粥樣硬化(動脈堵塞)、心臟病或衰竭、勃起功能障礙、間歇性跛行/周圍血管疾病以及血管性頭痛(引起頭痛的血管腫脹)。精氨酸還有助於健美、增強精子產生以及預防患有危重疾病的人的組織消耗。精氨酸鹽酸鹽具有高氯含量,已被用於治療代謝性鹼中毒。
生物合成 精氨酸在細胞質酶精氨酸琥珀酸合成酶和精氨酸琥珀酸裂解酶存在下,由瓜氨酸合成。這是一個能量消耗很大的反應。因此,每個精氨酸琥珀酸分子的合成將與三磷酸腺苷 (ATP) 水解為單磷酸腺苷 (AMP) 偶聯。
人體內精氨酸的合成主要透過腸道-腎軸進行,其中小腸的上皮細胞(主要從谷氨醯胺和穀氨酸產生瓜氨酸)與腎臟的近端小管細胞結合,近端小管細胞從迴圈中提取瓜氨酸並將其轉化為精氨酸,精氨酸返回迴圈。
精氨酸和氮儲存 為了讓細胞生長,它需要氮,氮可以來自氨、硝酸鹽、二氮或氨基酸。PII 蛋白是一種古老的訊號蛋白,透過結合 2 OG 和 ATP/ADP 來感知和整合氮和碳的丰度。N-乙醯-L-穀氨酸激酶 (NAGK) 將氮儲存為精氨酸,並將其摻入富含精氨酸的共聚物中。由於精氨酸富含氮,因此是氮儲存的理想選擇。當精氨酸摻入蛋白質時,精氨酸的滲透壓影響最小。PII 蛋白僅在含氧光合生物中氮充足時與 NAGK 結合。但當氮缺乏時,2-酮戊二酸與 ATP 結合到 PII 蛋白上,導致 PII-NAGK 複合物解離。
精氨酸不敏感的 NAGK 是一種同二聚體,包含兩個亞基中 16 鏈 β 片的骨架。然而,精氨酸敏感的 NAGK 是六聚體,最近的研究表明,這些酶是二聚體的環狀六聚三聚體。該環是由三個 E. Coli NAGK 樣二聚體之間的連線和 N 末端 α 螺旋形成的。在精氨酸敏感的 NAGK 中,精氨酸透過交錯的 N 螺旋連線。這些螺旋是使 NAGK 成為精氨酸操作開關所必需的,表現出精氨酸抑制動力學的 S 形曲線。PII 蛋白是同三聚體,具有 βαββαβ 亞基拓撲結構,α 螺旋朝外,β 片朝內。T 環是一個大的、靈活的環,在藍細菌和變形菌中包含磷酸化和尿苷酸化位點。當 PII 蛋白不存在時,S. elongates NAGK 不活躍,Vmax 低,NAG 的 Km 高,需要低濃度的精氨酸才能抑制。然而,酶 A. thaliana NAGK 非常活躍,NAG 的 Km 低四倍,Vmax 高三倍,比 S. elongates NAGK 高。當 PII 結合 S. Elongates NAGK 時,NAG 的 Vmax 增加到原始值的四倍,而 NAG 的 Km 降低到原始值的十倍。當它結合 A. thaliana NAGK 時,Km 不受影響,但 NAG 的 Vmax 增加到原始值的五倍。原始值是蛋白質 PII 不存在時的值。S. elongates PII-NAGK 複合物有一個被兩個 PII 三聚體夾住的 NAGK 六聚體。由於 PII 蛋白沒有緊緊地堆積在 NAGK 上,PII 僅與 T 環和 B 環上的 NAGK 相互作用。A. thaliana PII-NAGK 複合物在 PII 蛋白上結合了 MgATP,所有 NAGK 活性中心都包含結合的 NAG 和 ADP。
天冬醯胺 - Asn/ N
[edit | edit source]
結構 天冬醯胺是酸性氨基酸天冬氨酸或天冬氨酸鹽的極性和不帶電的衍生物;作為側鏈,它具有一個羧醯胺基,在生理 pH 下呈中性,可以透過水解轉化為羧酸,形成天冬氨酸。氨基酸的羧醯胺基可以形成氫鍵。
特點 天冬醯胺在蘆筍中含量豐富,因此得名。天冬醯胺不是必需氨基酸,這意味著人類不需要攝入它來獲得必要的量。天冬醯胺具有很高的氫鍵傾向,因為醯胺基可以接受兩個氫鍵並捐贈兩個氫鍵。它存在於蛋白質表面以及蛋白質內部。它是糖蛋白中碳水化合物附著的一個常見位點。含有天冬醯胺的食物來源包括乳製品、牛肉、家禽和雞蛋。
功能 天冬醯胺與穀氨酸一起,是一種重要的神經遞質。由於天冬氨酸和天冬醯胺在腦部的海馬體和下丘腦中濃度很高,而海馬體和下丘腦對短期記憶和情緒很重要,這兩種氨基酸在大腦和身體其他部位之間起著重要的作用。神經系統需要天冬醯胺來維持平衡,並且還需要天冬醯胺進行氨基酸從一種形式到另一種形式的轉化,這在肝臟中實現。
合成 天冬醯胺的合成需要草醯乙酸,C4H4O5。透過一個叫做轉氨酶的過程,與碳-2 相連的雙鍵氧被來自穀氨酸的銨基取代。新形成的化合物,或天冬氨酸,透過用銨基取代帶負電的氧端,轉化為天冬醯胺。天冬醯胺合成將谷氨醯胺轉化為穀氨酸,將 ATP 轉化為 AMP 和焦磷酸。
分析 可以透過以下方法鑑定天冬醯胺:紫外光譜、紅外光譜 (IR)、核磁共振波譜 (NMR) 和質譜法。
天冬氨酸 - Asp/ D
[edit | edit source]
結構 天冬氨酸 (C4H7NO4) 也稱為 2-氨基丁二酸。其分子量為 133.1 g/mol。
天冬氨酸,也稱為天冬氨酸鹽,是一種酸性和極性氨基酸,具有羧酸基,在生理 pH 下失去一個質子成為羧酸鹽基團,並帶負電荷;氨基酸的羧酸基的 pKa 值為 4.1,比末端 α-羧基基團略微鹼性。它的 pI 為 5.41。蛋白質對於維持體內 pH 平衡至關重要。參與蛋白質緩衝特性的正是帶電荷的氨基酸。天冬氨酸類似於丙氨酸,但其中一個 β 氫被羧酸基團取代。這個羧酸基團是使天冬氨酸成為酸性氨基酸的原因。天冬氨酸有一個 α-酮同系物,稱為草醯乙酸。天冬氨酸和草醯乙酸可以透過簡單的轉氨基反應相互轉化。草醯乙酸是克雷布斯迴圈的中間體之一。克雷布斯迴圈是大多數活細胞在有氧呼吸過程中產生能量的反應序列。
特點 天冬氨酸是一種非必需氨基酸,可以從中心代謝系統中獲得。
功能 天冬氨酸參與轉氨基反應,其中草醯乙酸和天冬氨酸相互轉化。它還透過促進免疫球蛋白的產生和抗體的產生,參與免疫系統活動。此外,天冬氨酸保護肝臟,並有助於解毒氨。
天冬氨酸鹽是天冬氨酸的共軛鹼,也作為神經遞質發揮作用。與其他一些氨基酸一起,它的主要作用是啟用腦中的 NMDA 受體;然而,它的作用不如穀氨酸顯著。
除了作為一種興奮性神經遞質的作用外,天冬氨酸是一種蛋白質氨基酸,用於 DNA 的編碼。
天冬氨酸在酶活性中心中作為酸發揮重要作用,以及在維持蛋白質的溶解性和離子特性方面也起著重要作用。
合成 天冬氨酸透過轉氨基作用從草醯乙酸合成。天冬氨酸也可以用作合成其他必需氨基酸的初始反應物,如:蛋氨酸、蘇氨酸、異亮氨酸和賴氨酸。天冬氨酸需要被還原成其半醛形式 HOOCCH(NH2)CH2CHO。天冬醯胺也可以透過轉醯胺作用從天冬氨酸獲得:天冬氨酸 + 谷氨醯胺 -> 天冬醯胺 + 穀氨酸

結構 半胱氨酸,C3H7NO2S,分子量為 121.16 g/mol,是一種由巰基或硫醇基 (-SH) 組成的氨基酸,其親核性比羥基強。它的另一個名稱是 2-氨基-3-巰基丙酸。兩個半胱氨酸殘基可以被氧化形成穩定的二硫鍵。二硫鍵有助於賦予蛋白質二級和三級結構,例如蛋白質摺疊。兩個鍵合的半胱氨酸的單元被稱為胱氨酸。半胱氨酸被認為是一種親水性氨基酸,因為硫醇基與水相互作用良好。它也是一種非必需氨基酸,可以在人體內生物合成。
功能 半胱氨酸中親核硫醇基易於被氧化;因此,半胱氨酸具有很強的反應性,其 pKa 為中性,在生物學中具有多種功能。
半胱氨酸能夠使血液中的胰島素失活。過量的半胱氨酸會減少胰島素結構中三個二硫鍵中的一個。結果,胰島素失去其功能。當患者因胰島素水平高而出現低血糖症時,半胱氨酸使胰島素失活的能力可以在醫學和製藥中使用。
半胱氨酸促進缺鐵性貧血中的鐵生成。它還透過增加紅細胞的生成來幫助治療肺病。半胱氨酸是許多重要蛋白質中的關鍵活性位點殘基。半胱氨酸是谷胱甘肽還原酶中的關鍵殘基,谷胱甘肽還原酶對紫外線、輻射和自由基具有保護作用。此外,甘油醛-3-磷酸脫氫酶是糖酵解中的關鍵酶,它使用半胱氨酸來實現其最關鍵的功能。
當半胱氨酸作為補充劑服用時,它以 N-乙醯-L-半胱氨酸 (NAC) 的形式存在。身體將其轉化為半胱氨酸,然後轉化為谷胱甘肽,一種強大的抗氧化劑。抗氧化劑可以對抗自由基,自由基是體內有害的化合物,會導致細胞膜和 DNA 損傷。研究人員認為自由基在衰老以及心臟病和癌症等多種健康問題的發生發展中發揮作用。NAC 還可以幫助預防藥物反應和有毒化學物質引起的副作用。它還有助於分解體內的粘液。NAC 也能幫助治療一些呼吸系統疾病,如支氣管炎和慢性阻塞性肺病 (COPD)。COPD 是慢性阻塞性肺疾病的首字母縮略詞。醫生通常會給服用過量對乙醯氨基酚 (泰諾) 的人服用 NAC。NAC 有助於預防或減少肝臟和腎臟損傷。NAC 也能幫助減少心絞痛。心絞痛是指心肌供血不足引起的胸痛或不適。服用 NAC 會開啟血管,改善血液流向心臟。研究還表明,NAC 可能有助於緩解慢性支氣管炎的症狀,從而減少發作。並非所有研究都得出這些結果。一些研究沒有發現發作次數減少。其他研究表明,與其他療法一起使用時,服用 NAC 的 COPD 患者的發作次數減少了約 40%。另一項研究表明,每天服用兩次 NAC 的人比服用安慰劑的人的流感症狀更少。一些研究表明,靜脈注射 NAC 可能會提高谷胱甘肽水平,並有助於預防和/或治療由急性呼吸窘迫綜合徵 (ARDS) 引起的肺損傷。其他結果與這些結果不一致。例如,給 ARDS 患者服用 NAC 有助於減輕其病情嚴重程度,但與安慰劑相比,並沒有減少總死亡人數。半胱氨酸在角蛋白結構中很重要,而角蛋白在皮膚上頭髮和指甲的形成中很重要。從羊和其他動物身上獲得的羊毛含有半胱氨酸。
生物合成 半胱氨酸合成的前體是絲氨酸和蛋氨酸。絲氨酸有一個羥基,蛋氨酸有一個硫作為它們的取代基。蛋氨酸最初被轉化為高半胱氨酸。與絲氨酸一起,高半胱氨酸變成胱硫醚 (C7H14N2O4S),同時釋放出一個水分子。最後,從胱硫醚中新增水和氨的離去導致半胱氨酸和 α-酮丁酸作為副產物。

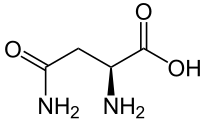
結構
谷氨醯胺或 2-氨基-4-氨甲醯基丁酸,其分子式為 C5H10N2O3,分子量為 146.16 g/mol。它是酸性氨基酸穀氨酸或穀氨酸的極性和不帶電荷的衍生物;它具有一個醯胺基,該醯胺基在生理 pH 值下呈中性,可以透過水解轉變為羧酸以形成穀氨酸。該氨基酸的醯胺基可以形成氫鍵。

合成 如前所述,谷氨醯胺是一種非必需氨基酸。在體內,谷氨醯胺透過谷氨醯胺合成酶 (GS) 和新增 ATP 和氨來合成。(見圖)。
穀氨酸 + ATP + NH3 → 谷氨醯胺 + ADP + 磷酸 + H20
將氨摻入穀氨酸是一種醯胺化反應,ATP 水解為 ADP 推動反應前進。ATP 直接參與反應,因為它磷酸化穀氨酸側鏈上的羧基並形成一個醯基磷酸中間體 (見圖:谷氨醯胺最終)。醯基磷酸中間體與遊離氨反應並形成谷氨醯胺。谷氨醯胺合成酶 (GS) 起著重要作用,因為在中間體形成後,GS 中形成了一個對氨具有高親和力的結合位點,以防止中間體水解。中間體的水解不會產生谷氨醯胺,從而浪費了寶貴的 ATP 分子。
功能 谷氨醯胺是一種非必需氨基酸,這意味著它會在人體中自然產生,不需要從外源來源獲取。它是體內最豐富的氨基酸之一。谷氨醯胺在血液中迴圈,能夠直接穿過血腦屏障。
谷氨醯胺在生物化學中具有多種功能。它的主要作用是蛋白質合成,但它也有助於透過平衡酸鹼水平來維持肝臟的 pH 值中性。
與葡萄糖一樣,谷氨醯胺能夠為細胞體提供能量。它透過合成代謝反應將氮捐獻給細胞,並在檸檬酸迴圈中提供碳。它對胃腸系統至關重要,因為它為小腸提供能量。值得注意的是,腸道是人體中唯一使用谷氨醯胺作為主要能量來源的器官。腎臟、活化的免疫細胞和癌細胞也需要谷氨醯胺,但不是作為主要能量來源。
在細胞內,谷氨醯胺對於細胞生長和蛋白質翻譯至關重要。此外,它還充當氮供體,並幫助維持線粒體膜上的梯度。
正常細胞需要谷氨醯胺。另一方面,癌細胞使用的谷氨醯胺量遠高於正常細胞。正如 David R. Wise 和 Craig B. Thompson 在論文“谷氨醯胺成癮:癌症治療的新靶點”中所討論的那樣,癌細胞有時會表現出所謂的“谷氨醯胺成癮”。在這種成癮中,癌細胞會從體內吸收比細胞功能所需的更多的谷氨醯胺。事實上,癌細胞會攝入比細胞所能代謝的更多的谷氨醯胺。剝奪癌細胞這種過量的谷氨醯胺會導致它們死亡。這種剝奪是潛在的谷氨醯胺為基礎的癌症治療的關鍵。谷氨醯胺的消耗量可以超過細胞中任何其他氨基酸的消耗量的十倍。在癌細胞中,代謝發生了轉變,因此谷氨醯胺取代葡萄糖成為細胞的主要碳來源。
身體可以為其正常需求製造足夠的谷氨醯胺,但極度壓力(如劇烈運動或受傷)會導致身體需要更多的谷氨醯胺。大多數谷氨醯胺儲存在肌肉中,其次是肺,在那裡製造了大量的谷氨醯胺。通常,身體可以製造足夠的谷氨醯胺,因此沒有必要服用谷氨醯胺補充劑。然而,某些疾病(包括受傷、手術、感染和長期住院)會降低谷氨醯胺水平。在這些情況下,服用谷氨醯胺補充劑可能會有所幫助。
谷氨醯胺對於去除體內常見的廢物氨至關重要。谷氨醯胺還有助於免疫系統的功能,是正常大腦功能和消化所必需的。谷氨醯胺對傷口癒合和疾病恢復很重要。當身體處於壓力狀態時,它會釋放皮質醇激素進入血液。高濃度的皮質醇會降低體內谷氨醯胺的儲存量。其他研究表明,在腸內營養中新增谷氨醯胺有助於降低創傷和重症病人的死亡率。臨床研究發現,谷氨醯胺補充劑可以增強免疫系統並減少感染。谷氨醯胺補充劑還有助於嚴重燒傷的恢復。谷氨醯胺的另一個重要作用是保護稱為粘膜的胃腸道內壁。患有炎症性腸病 (IBD) 的人可能體內沒有足夠的谷氨醯胺。兩項臨床試驗發現,服用谷氨醯胺補充劑並沒有改善克羅恩病的症狀。艾滋病毒或艾滋病患者經常出現嚴重體重減輕,因此這些患者會服用谷氨醯胺補充劑以及其他營養素,包括維生素 C 和 E、β-胡蘿蔔素、硒和 N-乙醯半胱氨酸,以增加體重並幫助腸道更好地吸收營養。參加耐力賽的運動員可能會減少體內的谷氨醯胺含量,從而更容易在運動後感冒。研究表明,服用谷氨醯胺補充劑會導致感染減少。
谷氨醯胺與癌症 研究表明,一些癌細胞對谷氨醯胺具有成癮性,因為谷氨醯胺攝取率增加。谷氨醯胺攝取率的增加是由於谷氨醯胺除了為蛋白質(氨基酸)和核苷酸生物合成提供氮之外,還發揮著其他作用。
癌細胞依靠過量的特定化合物來產生能量的第一個跡象是由奧托·海因裡希·瓦爾堡發現的。瓦爾堡注意到,大多數癌細胞產生的能量是透過過量葡萄糖的糖酵解產生的,而過量葡萄糖在乳酸發酵過程中又轉化為乳酸。這種過程與正常細胞中的能量產生形成對比,正常細胞中也會發生糖酵解,但隨後線上粒體中進行丙酮酸氧化。因此,瓦爾堡得出結論,這些癌細胞一定已經退化為單細胞真核生物中所見到的更原始的代謝形式。因此,這種癌細胞為其能量需求而攝取過量葡萄糖的效果被稱為“瓦爾堡效應”。後來發現谷氨醯胺在一些腫瘤細胞中也反映了這種效應。
谷氨醯胺已被證明參與必需氨基酸的訊號傳導和攝取。例如,它能夠充當線粒體的底物,以維持線粒體膜電位的完整性。它還在各種補體反應中發揮著不可或缺的作用。
谷氨醯胺向癌細胞捐贈氮。像所有細胞一樣,癌細胞必須合成氮化合物來產生核苷酸和其他氨基酸。谷氨醯胺捐贈了合成這些化合物所需的氮。谷氨醯胺捐贈其醯胺基並轉化為穀氨酸。穀氨酸透過轉氨酶將其胺基轉移到α-酮酸,用於生成非必需氨基酸。這種分解為包括丙氨酸、絲氨酸、天冬氨酸和脯氨酸在內的幾種氨基酸提供了氮。酪氨酸是唯一不能從葡萄糖或谷氨醯胺中產生的非必需氨基酸。
- 谷氨醯胺是某些癌細胞攝取必需氨基酸和作為分子訊號所必需的
- 谷氨醯胺透過谷氨醯胺溶質載體 SLC1A5 匯入,並迅速透過 SLC7A5 氨基酸轉運蛋白輸出,以交換細胞外必需氨基酸。然而,當谷氨醯胺進口商受損時,必需氨基酸的攝取也會受損。這種損傷表明谷氨醯胺是必需氨基酸攝取所必需的。沒有必需氨基酸,雷帕黴素敏感 (mTORC1) 不會被啟用。mTORC1 在調節細胞生長和蛋白質翻譯以及抑制巨自噬中起著至關重要的作用。因此,mTORC1 的失活會抑制細胞生長和蛋白質翻譯。因此,谷氨醯胺在一些癌細胞中充當 mTORC1 的訊號和必需氨基酸的來源。
- 谷氨醯胺為癌細胞提供補體
- 補體是指補充線粒體中碳庫的過程。草醯乙酸 (OAA) 是線粒體中的一種底物,最終導致許多重要的生物大分子(如膽固醇)的合成。在膠質母細胞瘤細胞中,谷氨醯胺代謝提供了大部分的 OAA 細胞庫。因此,谷氨醯胺代謝為 OAA 的速率增加證實了谷氨醯胺是癌細胞中的一種主要底物,它為線粒體提供了前體大分子以執行其代謝功能。
- c-Myc 調節癌細胞中的谷氨醯胺代謝
- 嘌呤和嘧啶的合成以谷氨醯胺作為氮源,透過五個酶促步驟完成。五個步驟中的三個受 c-MYC(Myc)的調節,c-MYC 是一種 DNA 轉錄因子。Myc 的致癌水平在轉錄水平上促進谷氨醯胺分解的增加以及谷氨醯胺代謝為乳酸。谷氨醯胺的分解代謝為細胞提供了用於補體的碳和 NADPH 的產生。
- Myc 是一種轉錄因子,編碼一種與 DNA 結合的蛋白質。在癌細胞中,Myc 被放大。Myc 攝取谷氨醯胺並將其轉化為穀氨酸和乳酸。Myc 的過表達會導致谷氨醯胺分解代謝的增加,從而導致細胞中碳含量增加,從而使細胞能夠產生更多的 NADPH。Myc 的這種過表達觸發了從葡萄糖到谷氨醯胺作為細胞碳源的代謝轉換。
- 基於谷氨醯胺的癌症治療
- 一些癌細胞對谷氨醯胺的依賴是新型癌症治療的目標。需要進一步研究以確定非毒性劑量;也就是說,這種劑量不會無差別地抑制谷氨醯胺的產生,並且只在癌細胞中起作用。
- 由於癌細胞依賴於谷氨醯胺,因此剝奪這些細胞的谷氨醯胺會導致它們死亡。因此,谷氨醯胺已成為新型癌症治療的目標。新的治療方法試圖透過減少體內谷氨醯胺的含量來剝奪癌細胞的谷氨醯胺來源。然而,由於谷氨醯胺對身體的許多其他過程至關重要,例如大腦中的突觸通訊,因此從身體中去除谷氨醯胺不是一種可行的治療方法,並且非常危險。其他治療方法試圖透過靶向 Myc 和其他負責將谷氨醯胺轉運到細胞中的蛋白質來降低細胞攝取谷氨醯胺的能力。其他治療方法試圖重新程式設計線粒體,使其不再依賴谷氨醯胺。另一種治療方法涉及靶向 mTOR 的谷氨醯胺反應。與從體內去除所有谷氨醯胺相比,這些治療方法顯示出更大的希望,危害更小。
- 這些治療方法靶向癌細胞中的主要谷氨醯胺活性
- 谷氨醯胺攝取和 mTOR 啟用:L-γ-谷氨醯-對硝基苯胺 (GPNA) 抑制 SLC1A5,它是 Myc 的靶點。這種抑制會抑制細胞中谷氨醯胺的攝取。2-氨基雙環-(2,2,1)庚烷羧酸 (BCH) 也抑制 SLC7A5 並阻斷 mTOC 啟用,從而誘導自噬。
- 谷氨醯胺依賴性補體和線粒體中的活性:研究表明,來自谷氨醯胺的碳透過轉氨酶進入檸檬酸迴圈。因此,氨基氧乙酸 (AOA) 作為一種轉氨酶抑制劑,顯示出作為有希望的癌症治療劑的潛力。此外,線粒體 NAD+ 的再生可能會阻止谷氨醯胺透過檸檬酸迴圈進入。二甲雙胍,一種雙胍類藥物,抑制了這種機制。
- 這些治療方法靶向癌細胞中的主要谷氨醯胺活性
用法
- 傷口癒合
- 炎症性腸病
- 艾滋病/艾滋病
- 肥胖症
- 腹膜炎
- 運動員
- 癌症
- 等等。
穀氨酸 - Glu/ E
[edit | edit source]
結構 穀氨酸的分子式為 C5H9NO4。它的分子量為 147.13 g/mol。穀氨酸也稱為穀氨酸,是一種極性氨基酸,具有羧酸基團,該基團會失去一個質子以在生理 pH 值下變成羧酸鹽基團,並帶負電荷;氨基酸的羧酸基團的 pKa 值為 4.3,比末端 α-羧基基團和天冬氨酸的羧酸基團略微鹼性。由於額外亞甲基基團的感應效應,穀氨酸的 pKa 值明顯高於天冬氨酸。在某些蛋白質中,由於維生素 K 依賴性羧化酶,一些穀氨酸將是二羧酸,稱為 γ 羧基穀氨酸,它們形成鈣離子的緊密結合位點。穀氨酸和 α-酮戊二酸是克雷布斯迴圈中的中間體,可以透過轉氨基作用相互轉化。因此,穀氨酸可以進入克雷布斯迴圈進行能量代謝,並被谷氨醯胺合成酶轉化為谷氨醯胺,谷氨醯胺是氮代謝中的關鍵參與者之一。
功能 穀氨酸在代謝中起著至關重要的作用。在檸檬酸迴圈中,α-酮戊二酸與丙氨酸或天冬氨酸的轉氨基作用分別產生穀氨酸和丙酮酸或草酸鹽。由轉氨基作用形成的丙酮酸和草酸鹽在細胞代謝中起著至關重要的作用。
穀氨酸是一種非必需氨基酸。它在 DNA 合成中起著重要作用。它還有助於傷口和潰瘍癒合。穀氨酸參與興奮性神經遞質和糖類以及脂肪的代謝。它有助於鉀透過血腦屏障移動。穀氨酸是大腦的燃料來源。它能夠附著到胺基以形成谷氨醯胺。形成谷氨醯胺的過程會解毒體內含有的氨。
穀氨酸可用於糾正人格障礙和治療兒童行為障礙。它還用於治療癲癇、智力遲鈍、肌營養不良、潰瘍和低血糖昏迷。
其他次要用途包括增味劑、GABA 前體、營養素和植物肥料。
合成 穀氨酸的生物合成涉及各種方案。最常見的方案是透過用谷氨醯胺酶作為輔助酶,在谷氨醯胺中新增水分子來將谷氨醯胺轉化為穀氨酸。副產物是氨基。在 N-乙醯穀氨酸中新增水也會產生穀氨酸和乙酸。酮戊二酸是穀氨酸合成的另一種常見前體。新增 NADPH 和氨或 α-氨基酸會產生穀氨酸。參與的酶包括穀氨酸脫氫酶和轉氨酶。其他方法包括 1-吡咯啉-5-羧酸 + NAD+ + HOH 和 N-甲醯亞氨基-L-穀氨酸 + FH4。
穀氨酸很容易轉化為脯氨酸。首先,γ 羧基基團被還原為醛,生成穀氨酸半醛。然後醛與 α-氨基基團反應,在形成席夫鹼時消除水。在第二步還原步驟中,席夫鹼被還原,生成脯氨酸。
甘氨酸 - Gly/ G
[edit | edit source]
結構 甘氨酸的分子式和質量分別為 C2H5NO2 和 75.07 g/mol。甘氨酸是所有 20 種氨基酸中最小的氨基酸,其取代基只有一個氫原子。因此,它能夠適合分子中其他任何氨基酸都無法適應的緊密空間,因此甘氨酸在進化上是保守的。大多數蛋白質含有少量甘氨酸,但膠原蛋白是其中一個例外,它含有 35% 的甘氨酸。因此,如果從組成整個蛋白質的氨基酸鏈中裂解甘氨酸,它要麼會改變該蛋白質的功能,要麼完全使其變性。它也是唯一的手性氨基酸,因為它的 R 基團只是一個 H 原子。特別地,它不利於螺旋的形成。
功能 甘氨酸是非必需氨基酸,這意味著人體可以自行合成。它在維持中樞神經系統和消化系統中起著重要作用。甘氨酸透過增加肌酸來防止肌肉分解,肌酸是一種有助於構建肌肉質量的化合物。甘氨酸還能使皮膚保持緊緻和柔韌。如果沒有甘氨酸,皮膚可能會受到紫外線、氧化和自由基的損害。
甘氨酸調節血糖水平,並幫助為身體提供葡萄糖。
甘氨酸在中樞神經系統中,特別是脊髓中,充當抑制性神經遞質。當甘氨酸與受體結合時,它會啟用氯離子通道開啟。當氯離子進入通道時,膜會發生超極化,從而導致抑制性突觸後電位 (IPSP)。
一些可以使用甘氨酸治療的疾病包括精神分裂症、中風、良性前列腺增生症 (BPH) 和一些罕見的遺傳性代謝疾病。它還用於保護腎臟免受器官移植後使用的一些藥物的有害副作用的影響,以及保護肝臟免受酒精的有害影響。其他用途包括預防癌症和增強記憶力。
有些人將甘氨酸直接塗抹在皮膚上以治療腿部潰瘍並治癒其他傷口。人體利用甘氨酸來製造蛋白質。甘氨酸也參與大腦中化學訊號的傳遞,因此人們對嘗試用它來治療精神分裂症和改善記憶力感興趣。一些研究人員認為甘氨酸可能在預防癌症中發揮作用,因為它似乎會干擾某些腫瘤所需的血液供應。
生物合成 甘氨酸是絲氨酸和 3-磷酸甘油酸的衍生物。絲氨酸的轉化需要一種特定的酶,稱為絲氨酸羥甲基轉移酶和輔因子磷酸吡哆醛。該過程可以簡化為以下反應:絲氨酸 + 四氫葉酸 -> 甘氨酸 + N5 或 N10-亞甲基四氫葉酸 + 水。
該反應在肝臟中繼續進行。甘氨酸合酶被用作 N5 或 N10-亞甲基四氫葉酸轉化中的酶。在這個反應中,二氧化碳、銨、NADH 和質子將四氫葉酸分子轉化為甘氨酸。
甘氨酸的降解有三種途徑。最常見的途徑是前一個反應的相反:將甘氨酸轉化為四氫葉酸分子。另一種途徑是將絲氨酸轉化為丙酮酸和絲氨酸脫水酶。最後一個途徑涉及將甘氨酸透過 D-氨基酸氧化酶轉化為乙醛酸。該途徑使乙醛酸氧化為草酸。

結構 組氨酸,C6H9N3O2,也稱為 2-氨基-3-(1H-咪唑-4-基)丙酸。其分子量為 155.15 g/mol。它是一種鹼性、極性氨基酸,具有咪唑基團,咪唑基團是一個芳香環,可以帶正電荷,並且親水。氨基酸的咪唑基團的 pKa 值為 6,在中性 pH 值下可以是無電荷或帶正電荷。這種氨基酸通常存在於酶的活性位點中,其中咪唑基團充當化學反應的緩衝劑(質子受體或供體)。組氨酸是組胺的前體,組胺是免疫系統細胞在過敏反應期間釋放的化合物。
特徵 在大約 7 的生理 pH 值下,可以使用亨德森-哈塞爾巴爾赫方程來給出咪唑側鏈的去質子化/質子化比率 (pKa = 6)。事實證明,組氨酸側鏈在中性 pH 值下大約 10% 處於質子化狀態。這不是可以忽略不計的量,它賦予組氨酸殘基一定量的緩衝能力。鹼性氮作為親核試劑啟用咪唑位點。
功能 組氨酸在血紅蛋白中含量很高。因此,它有助於治療貧血並維持最佳的血液 pH 值。此外,組氨酸是組胺的前體,組胺參與區域性免疫反應。
組氨酸是一種必需氨基酸,這意味著人體無法合成它。組氨酸在刺激皮膚和粘膜的炎症反應中起著重要作用。它還刺激消化酶胃泌素的分泌,並作為組胺水平的來源和控制。組氨酸是生長和修復組織所必需的,以及維持作為神經細胞保護器的髓鞘。組氨酸也是製造紅細胞和白細胞所必需的。體記憶體在組氨酸有助於保護人體免受輻射造成的損害,並從體內去除重金屬。組氨酸也存在於胃中。它有助於產生胃液,患有胃液不足或消化不良的人也可能從這種營養素中受益。人們認為組氨酸可能對患有關節炎和神經性耳聾的人有益。這尚未得到確鑿的證實。組氨酸也被用於性喚起、功能和享受。組氨酸血癥是組氨酸代謝的先天性錯誤,由於缺乏組氨酸酶,血液和尿液中組氨酸含量很高,可能表現為言語障礙和智力障礙。據報道組氨酸沒有副作用,但組氨酸含量過高會導致壓力和精神疾病,如焦慮,而患有精神分裂症的人發現組氨酸含量較高。患有精神分裂症或雙相(躁狂)抑鬱症的人在未經醫療專業人員批准的情況下不應服用組氨酸補充劑。
代謝 組氨酸可以透過組氨酸脫羧酶轉化為組胺。羧基離開組氨酸。
食物來源 含有組氨酸的食物包括乳製品、肉類、家禽、魚類、大米、小麥和黑麥。

結構 異亮氨酸,HOOCCH(NH2)CH(CH3)CH2CH3,也稱為 2-氨基-3-甲基戊酸,摩爾質量為 131.17 g/mol。異亮氨酸是一種非極性、脂肪族或疏水性氨基酸,具有兩個用於 α-碳原子和 R 基團的手性中心。異亮氨酸,因為它包含兩個立體中心,是兩種非對映異構體之一。如果不是生物體對一種特定立體異構體的選擇性,由於存在 2 個手性中心,將會有 4 種可能的立體異構體。然而,在生物體中只有一種形式存在:2S,3S 形式。該結構透過疏水效應穩定水溶性蛋白質。
特徵 異亮氨酸無法透過 MS 與亮氨酸區分,因為它們具有相同的分子量。相反,這兩種殘基通常需要透過 HPLC 或 TLC 與已知標準品分離和表徵。
異亮氨酸也被降解為琥珀醯輔酶 A 和乙醯輔酶 A,並被 TCA 迴圈消耗。
功能 異亮氨酸是一種必需氨基酸,這意味著人體無法合成它。它對於血紅蛋白的形成和調節血糖和能量水平至關重要。異亮氨酸在肌肉力量和耐力中起著重要作用,是肌肉組織能量的來源。
異亮氨酸促進劇烈運動後肌肉恢復。異亮氨酸是血紅蛋白形成所必需的,以及幫助調節血糖水平和能量水平。它還參與血凝塊的形成。
異亮氨酸缺乏的人可能會出現頭痛、頭暈、疲勞、抑鬱、困惑以及易怒等症狀。缺乏症狀可能類似於低血糖的症狀。這種營養素也被發現存在於患有精神和身體疾病的人中,但需要對此進行更多研究。對於大多數人來說,攝入較高量的異亮氨酸與任何健康風險無關,但患有腎臟或肝臟疾病的人在沒有醫療建議的情況下不應攝入高劑量的氨基酸。攝入較高量異亮氨酸的人報告排尿量增加。參與高強度體育活動、極度壓力和高海拔環境的人可能從補充這種營養素中獲益。
異亮氨酸的食物來源 含有異亮氨酸的食物包括杏仁、腰果、雞肉、雞蛋、魚類、扁豆、肝臟、肉類等。
生物合成 異亮氨酸的合成涉及多個步驟。異亮氨酸可以從丙酮酸和α-酮戊酸衍生而來。所需的催化酶如下
1. 乙醯乳酸合酶 2. 乙醯羥酸異構還原酶 3. 二羥酸脫水酶 4. 纈氨酸轉氨酶
在工業上,異亮氨酸可以從 2-溴丁烷和丙二酸二乙酯合成。

結構 亮氨酸的分子式和質量分別為 C6H13NO2 和 131.17 g/mol。亮氨酸,也稱為 2-氨基-4-甲基戊酸,具有脂肪族 R 基團。它是三種具有支鏈烴側鏈(通常埋在摺疊的蛋白質中)的氨基酸之一,並導致非極性或疏水性氨基酸。疏水效應有助於穩定水溶性蛋白質。
特徵 亮氨酸無法透過 MS 與異亮氨酸區分,因為它們具有相同的分子量。相反,這兩種殘基通常需要透過 HPLC 或 TLC 分離和表徵。
功能 亮氨酸具有氨基酸異亮氨酸的所有功能,因為它們在支鏈烴側鏈方面具有相似性。亮氨酸透過調節天然止痛劑腦啡肽的釋放促進皮膚癒合和骨骼癒合。它也是膽固醇的前體,透過減緩肌肉的降解過程來增加肌肉組織的合成。亮氨酸是一種必需氨基酸。它對促進嬰兒生長和調節成人氮濃度至關重要。亮氨酸通常用作增味劑。
缺乏和過量 這種特定氨基酸的缺乏會導致低胰島素血癥、抑鬱症、慢性疲勞綜合徵、克瓦希奧科病(或飢餓)等。亮氨酸過量會導致酮症。
生物合成 作為一種必需氨基酸,亮氨酸無法在人體內合成,必須從外部來源獲取。從丙酮酸開始,轉化包括纈氨酸、酮戊酸鹽、異丙基蘋果酸鹽和酮異己酸鹽,透過還原。所需的酶包括:1. 乙醯乳酸合酶、乙醯羥酸異構還原酶、二羥酸脫水酶、異丙基蘋果酸鹽合酶和異構酶,以及亮氨酸轉氨酶。
賴氨酸 - Lys/ K
[edit | edit source]
結構賴氨酸是一種必需氨基酸。這意味著它對人體健康至關重要,但人體無法自身產生,因此必須從食物或補充劑中獲取。賴氨酸是蛋白質的組成部分。賴氨酸具有帶正電荷的胺基鏈。ε-胺基具有約 10.8 的高 pKa 值,比末端的 α-胺基更鹼性。這種鹼性胺基具有很高的反應活性,並參與酶活性中心的反應。儘管末端 ε-胺基在生理條件下帶電,但具有三個亞甲基的烴側鏈仍然是疏水的。
特徵賴氨酸是人體中天然存在的一種必需氨基酸。它促進嬰兒的最佳生長和成人的氮平衡。
功能賴氨酸可以治療單純皰疹病毒和病毒相關的慢性疲勞綜合徵,因為它可以抑制病毒生長。它促進膠原蛋白的形成,膠原蛋白是筋膜、骨骼、韌帶、肌腱、軟骨和皮膚的主要成分。它還有助於鈣的吸收,這對嬰兒的骨骼生長至關重要。
賴氨酸對正常生長很重要,它在肉鹼的產生中起著至關重要的作用,肉鹼是一種將脂肪酸轉化為能量並有助於降低膽固醇的營養物質。賴氨酸幫助人體吸收鈣,它在膠原蛋白的形成中起著重要作用,膠原蛋白是骨骼和結締組織(包括皮膚、肌腱和軟骨)的重要物質。
單純皰疹病毒 (HSV) 定期食用賴氨酸可能有助於預防唇皰疹和生殖器皰疹的爆發。賴氨酸透過阻斷精氨酸的活性或促進 HSV 複製來發揮抗病毒作用。研究表明,在皰疹爆發初期服用賴氨酸並沒有減輕症狀。研究表明,賴氨酸與 L-精氨酸一起使用可以使骨骼生成細胞更活躍並增強膠原蛋白的生成。還沒有研究調查賴氨酸是否可以幫助預防人類骨質疏鬆症。
骨質疏鬆症賴氨酸幫助人體吸收鈣,從而減少尿液中鈣的流失。鈣對強健骨骼至關重要,因此一些研究人員假設賴氨酸可能有助於預防與骨質疏鬆症相關的骨骼流失。
缺乏和過量賴氨酸缺乏可見於皰疹、慢性疲勞綜合徵、艾滋病、貧血、脫髮和體重減輕等。過量攝入賴氨酸會導致血液中氨濃度升高。大多數人從飲食中獲得足夠的賴氨酸,但運動員、不食用豆類的素食者以及燒傷患者可能需要更多。賴氨酸不足會導致疲勞、噁心、頭暈、食慾不振、躁動不安、眼睛充血、生長緩慢、貧血和生殖障礙。對於素食者來說,豆類(如豆類、豌豆和扁豆)是賴氨酸的最佳來源。
食物來源富含賴氨酸的食物包括肉類、乳酪、魚類、堅果、雞蛋、大豆、螺旋藻和胡蘆巴種子。啤酒酵母、豆類和其他豆類以及乳製品也含有賴氨酸,許多堅果都含有賴氨酸。
甲硫氨酸 - Met/ M
[edit | edit source]
結構甲硫氨酸是兩種側鏈中含有硫的氨基酸之一。它含有大量脂肪族側鏈,其中包括一個硫醚 (-S-) 基團。與半胱氨酸不同,甲硫氨酸中硫的化學鍵是硫醚。這種硫不像半胱氨酸那樣參與共價鍵。甲硫氨酸中硫氧化的很高傾向是人類肺組織中吸菸誘發的肺氣腫的原因之一。
特徵甲硫氨酸是一種天然存在的必需氨基酸,在提供代謝中游離甲基和硫方面起著至關重要的作用。它也是唯一兩種由單個密碼子編碼的氨基酸之一。
功能甲硫氨酸有助於脂肪的分解並降低血液膽固醇水平。它是一種抗氧化劑,可以中和自由基並清除肝臟中的廢物。DNA 和 RNA 的合成需要甲硫氨酸的存在。它也是人體中幾種關鍵氨基酸、激素和神經遞質的前體。它的 AUG 密碼子也充當信使 RNA 或 mRNA 核糖體翻譯的“起始”訊號;這意味著每條肽鏈在其 N 端都以甲硫氨酸殘基開始。然而,它可能在隨後透過裂解被移除。
缺乏和過量甲硫氨酸缺乏可見於化學暴露和素食者。過量攝入甲硫氨酸會導致嚴重的肝病。
苯丙氨酸 - Phe/ F
[edit | edit source]
結構苯丙氨酸是一種丙氨酸的衍生物,其中苯基取代了 CH3 基團上氫原子之一。與其他芳香族氨基酸(即酪氨酸和色氨酸)相比,苯丙氨酸具有更強的疏水性。酪氨酸和色氨酸由於其羥基和吲哚取代基而比苯丙氨酸疏水性更弱。苯丙氨酸由於其疏水性而經常埋藏在蛋白質中。相鄰的苯環(在相鄰的氨基酸上)可以透過π堆積相互穩定。
特徵單個氨基酸以及肽有時透過紫外光進行分析。苯丙氨酸以及其他一些芳香族氨基酸在照射紫外光時會發出熒光。紫外光可以作為一種有用的技術來驗證 Tyr、Phe 和 Trp 的存在。如果開發出足夠靈敏的測定方法,它還可以量化這些氨基酸。
功能苯丙氨酸是酪氨酸氨基酸的前體,酪氨酸會產生神經遞質,如多巴胺、去甲腎上腺素和腎上腺素。它可以作為一種強效的抗抑鬱藥來治療某些型別的抑鬱症,還可以增強記憶、思維和情緒。這種氨基酸還在降低高血壓患者的血壓中發揮作用。苯丙氨酸的 D 型可以用來減輕關節炎的疼痛,這在氨基酸中很少見。苯丙氨酸是一種天然存在的氨基酸,可以促進嬰兒生長並調節成人體內的氮濃度。
缺乏和過量苯丙氨酸缺乏可見於抑鬱症、艾滋病、肥胖症、帕金森病等。有些人患有一種稱為苯丙酮尿症或 PKU 的常染色體隱性遺傳病。這種疾病是由於缺乏分解苯丙氨酸氨基酸的酶導致的,這會導致這種氨基酸大量積累,而大量的苯丙氨酸是有毒的,尤其是對大腦。這會導致這種疾病導致智力遲鈍的可能性。因此,對嬰兒進行早期血液檢測以瞭解 PKU 的跡象,如果他們患有這種疾病,則必須遵循嚴格的飲食以減少食物中天然苯丙氨酸的含量。
脯氨酸 - Pro/ P
[edit | edit source]
結構脯氨酸是二十種 DNA 編碼氨基酸之一。它在 20 種蛋白質形成氨基酸中是獨一無二的,因為它的 α-胺基是二級而不是一級,就像其他氨基酸一樣。脯氨酸側鏈的獨特環狀結構將它的 φ 主鏈二面角鎖定在大約 -75°,與其他氨基酸相比,脯氨酸具有非凡的構象剛性。因此,脯氨酸在摺疊時失去的構象熵更少,這可能是其在蛋白質中更普遍的原因。嚴格來說,脯氨酸也可以稱為亞氨基酸。由於它的環狀結構使其在構象上比其他氨基酸更受限制,因此它極大地影響了蛋白質的結構。
功能脯氨酸在常規二級結構元素中間充當結構破壞者。然而,脯氨酸通常作為 α 螺旋的第一個殘基和 β 摺疊片的邊緣鏈存在。脯氨酸最常出現在轉角中,這可能解釋了為什麼脯氨酸通常暴露在溶劑中,儘管它有一個完全的脂肪族側鏈。由於脯氨酸的醯胺基團上沒有氫,因此它不能充當氫鍵供體,只能充當氫鍵受體。脯氨酸在癒合、軟骨構建以及柔韌的關節和肌肉支撐中很重要。它還有助於減少因陽光照射導致的皮膚鬆弛、皺紋和衰老。脯氨酸透過分解蛋白質並幫助生成健康細胞。它對皮膚健康和生成健康的結締組織以及肌肉組織的維持至關重要。
缺乏和過量脯氨酸缺乏通常是由於長時間運動的人導致的。維生素 C 缺乏也會導致脯氨酸因膠原蛋白分解而流失到尿液中。一般來說,脯氨酸缺乏的人在血糖水平低時傾向於首先代謝肌肉細胞而不是碳水化合物。脯氨酸是維持適當的膠原蛋白生成和穩定肌肉組織所必需的。缺乏脯氨酸會導致疲勞、體重減輕、脫水、頭暈和噁心等症狀。

結構 該氨基酸的R基團是連線到CH2基團的羥基。羥基是極性的,使絲氨酸具有極性/親水性。它的pH值為5.68。pKa = 2.21, 9.15。
特點 絲氨酸是一種非必需氨基酸,這意味著它可以由人體合成。例如,絲氨酸可以由甘氨酸合成。絲氨酸是甘氨酸和半胱氨酸的前體。
生物合成 絲氨酸的生物合成始於3-磷酸甘油酸(糖酵解中的中間體)氧化為3-磷酸羥基丙酮酸,然後經轉氨基作用生成30磷酸絲氨酸。最後,該中間體被水解為絲氨酸。
功能 絲氨酸是一種非必需氨基酸,這意味著它可以由人體合成。例如,絲氨酸可以由甘氨酸合成。絲氨酸也是甘氨酸和半胱氨酸的前體。絲氨酸存在於磷脂、胰蛋白酶和胰凝乳蛋白酶的活性位點中。它可以合成嘧啶和蛋白質、半胱氨酸和色氨酸。它也參與脂肪和脂肪酸的形成、肌肉合成。絲氨酸可以被催化劑絲氨酸脫水酶脫氨基,生成丙酮酸和銨離子。蘇氨酸的脫氨基作用遵循類似的過程。

結構 蘇氨酸是一種極性、不帶電的氨基酸。它的側鏈包含一個仲醇和一個甲基;因此,它可以被歸類為親水性氨基酸。蘇氨酸包含兩個手性中心,就像異亮氨酸一樣。如果不是由於生物體對特定立體異構體的選擇性,由於有兩個手性中心,將會有4種可能的立體異構體。然而,只有一種版本存在於生物體中:2S, 3R版本。
特點 蘇氨酸是一種必需氨基酸,這意味著它不能由人體合成。人類必須以含有蘇氨酸的食物的形式攝入它。
功能 蘇氨酸有助於彈性蛋白和膠原蛋白的形成。在免疫系統中,蘇氨酸有助於抗體的形成。它還有助於胸腺的生長和功能以及營養物質的吸收。此外,蘇氨酸是異亮氨酸的前體。蘇氨酸可以被催化劑蘇氨酸脫水酶脫氨基,生成α-酮丁酸和銨離子。絲氨酸的脫氨基作用遵循類似的過程。

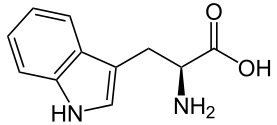
結構 色氨酸是一種芳香族氨基酸,其吲哚基團連線到亞甲基基團作為側鏈,該側鏈包含兩個芳香環的氮和氫基團,並且是親水的。側鏈之一是5元的,而另一個是6元的,兩個碳原子由這兩個芳香環共享。
特點 單個氨基酸以及肽偶爾會透過紫外線進行分析。色氨酸以及其他一些芳香族氨基酸在應用紫外線照射時會產生熒光。紫外線分析可以作為一種有用的技術來驗證Tyr、Phe和Trp的存在。如果開發出足夠靈敏的測定方法,它還可以對這些氨基酸進行定量分析。
功能 色氨酸是各種蛋白質、血清素和煙酸的前體。它還有助於肽和蛋白質的形成。它是一種必需氨基酸,這意味著它不能由人體產生。它通常存在於肽、酶和結構蛋白中。
缺乏和過量 色氨酸過量與嗜酸性粒細胞增多-肌痛綜合徵(EMS)有關。色氨酸缺乏症被稱為糙皮病,會導致煙酸缺乏症。然而,透過維生素補充劑,這種疾病不再那麼突出。該疾病的症狀包括痴呆和精神分裂症。哈特納病是一種遺傳性常染色體隱性遺傳病,患者無法有效地消化其消化道中的這種氨基酸。雖然該疾病的症狀與糙皮病類似,但輕微一些。患有該疾病的患者通常會出現紅色皮疹,並且在陽光中會進一步加重。如果未透過維生素補充劑進行正確治療,可能會導致進一步的智力遲鈍。

酪氨酸 酪氨酸是一種非極性芳香族氨基酸,它包含一個連線到芳香環的羥基。羥基尤為重要,因為這些殘基被用於其他蛋白質的磷酸化。酪氨酸是一種非必需氨基酸,這意味著它可以在體內合成。它在體內使用苯丙氨酸合成。
特點 單個氨基酸以及肽偶爾會透過紫外線進行分析。酪氨酸以及其他一些芳香族氨基酸在應用紫外線照射時會產生熒光。紫外線可以作為一種有用的技術來驗證Tyr、Phe和Trp的存在。如果開發出足夠靈敏的測定方法,它還可以對這些氨基酸進行定量分析。
功能 酪氨酸在人體中發揮著至關重要的作用:它有助於透過成為適應原來應對壓力,有助於最大限度地減少壓力綜合徵的影響,在藥物解毒中(例如可卡因、咖啡因和尼古丁成癮)中。它減少戒斷症狀和濫用。它有助於治療白癜風、皮膚色素沉著、苯丙酮尿症,即苯丙氨酸無法代謝的疾病。此外,它對治療抑鬱症有效。
酪氨酸對於腎上腺素、去甲腎上腺素、血清素、多巴胺、黑色素和腦啡肽的產生也很重要,腦啡肽在體內具有鎮痛作用。它還透過調節甲狀腺、垂體和腎上腺的功能來影響激素的功能。例如,只需看看甲狀腺激素甲狀腺素,就會發現它是從酪氨酸合成的。酪氨酸可以清除可能對細胞有害的分子,因此它具有保護作用。
缺乏和過量 酪氨酸缺乏會導致低血壓、抑鬱和體溫過低。酪氨酸是皮膚、頭髮和眼睛色素的主要氨基酸。體內酪氨酸氨基酸的損失會導致無法形成黑色素色素,從而導致部分或完全白化病。有趣的是,酪氨酸主要由苯丙氨酸產生,其中一個的損失會導致生物體中存在的另一種氨基酸的增加。

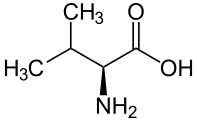
結構 纈氨酸是一種具有脂肪族異丙基側鏈的氨基酸,因此它是一種疏水性氨基酸。纈氨酸與蘇氨酸的不同之處在於蘇氨酸的OH基團被CH3基團取代。這是一種非極性氨基酸。它是一種必需氨基酸;因此它不能由人體產生。由於是疏水性的,這種氨基酸通常存在於蛋白質的內部。
特點 在動物中,纈氨酸必須透過攝入獲得。在植物中,它是透過使用丙酮酸,將其轉化為亮氨酸,然後透過與穀氨酸的還原氨化作用而產生的。纈氨酸存在於以下食物中:大豆粉、魚、乳酪、肉類和蔬菜。
功能 纈氨酸在肌肉的生長和發育、肌肉代謝以及維持人體氮平衡中必不可少。它可以作為能量來源代替葡萄糖使用。它還可以用作治療酒精引起的腦損傷的藥物。
缺乏和過量 纈氨酸缺乏會影響神經的髓鞘。楓糖尿症是由亮氨酸、纈氨酸和異亮氨酸無法代謝引起的。
20 種標準氨基酸具有兩個酸鹼基團:連線到 Cα 原子上的α-氨基和α-羧基。那些具有可電離側鏈的氨基酸 (Asp、Glu、Arg、Lys、His、Cys、Tyr) 具有一個額外的酸鹼基團。在低 pH 值(即高氫離子濃度)下,氨基和羧基都被完全質子化,因此氨基酸處於陽離子形式 H3N+CH2COOH。當溶液中的氨基酸用越來越多的強鹼(例如 NaOH)滴定,它會失去兩個質子,首先從 pK 值較低的羧基(pK=2.3)失去。Gly 無淨電荷時的 pH 值稱為其等電點,pI。所有 20 種標準氨基酸的α-羧基的 pK 值範圍為 1.8-2.9,而它們的α-氨基的 pK 值範圍為 8.8-10.8。酸性氨基酸 Asp 和 Glu 的側鏈的 pK 值分別為 3.9 和 4.1,而鹼性氨基酸 Arg 和 Lys 的側鏈的 pK 值分別為 12.5 和 10.8。只有 His 的側鏈,其 pK 值為 6.0,在生理 pH 範圍內 (6-8) 電離。需要注意的是,當氨基酸在蛋白質中連線在一起時,只有側鏈基團和末端的α-氨基和α-羧基可以自由電離。
磷酸吡哆醛 5'-磷酸酯介導的α-氨基酸脫羧反應
[edit | edit source]步驟 1:氨基酸與酶結合的磷酸吡哆醛 5'-磷酸酯 (PLP) 反應。氨基酸與 PLP 之間形成亞胺鍵 (CoeN),並置換酶。
步驟 2:當吡啶環在氮上被質子化時,它會成為更強的吸電子基團,脫羧反應透過電荷中和來促進。
步驟 3:質子轉移到α碳和從吡啶氮上奪取一個質子,導致吡啶環的重芳構化。
步驟 4:PLP 結合的亞胺與酶反應釋放胺,並恢復酶結合的輔酶。
參考文獻
[edit | edit source]Berg, Jeremy, Tymoczko J., Stryer, L.(2012). 蛋白質組成和結構。生物化學(第 7 版)。W.H. Freeman and Company。ISBN1-4292-2936-5
Berg, Jeremy M., 編著。(2002),生物化學(第 6 版)。紐約市,紐約州:W.H. Freeman and Company
Hames, Daivd,Hooper,Nigel。生物化學,第 3 版。泰勒和弗朗西斯集團。紐約。2005 年。
Wise R, David; Thompson B, Craig “谷氨醯胺依賴症:癌症治療的新靶點” 生化科學趨勢 35 (2010) 427—433。檢索日期:2010 年 10 月 16 日。
https://wikibook.tw/wiki/Structural_Biochemistry/Chemical_Bonding/Hydrogen_bonds https://wikibook.tw/wiki/Structural_Biochemistry/Chemical_Bonding/Hydrophobic_interaction https://wikibook.tw/wiki/Structural_Biochemistry/Organic_Chemistry/Organic_Functional_Group/Carboxyl https://wikibook.tw/wiki/Structural_Biochemistry/pH http://en.wikipedia.org/wiki/Alpha_carbon https://wikibook.tw/wiki/Structural_Biochemistry/Enzyme https://wikibook.tw/wiki/Structural_Biochemistry/Nucleic_Acid/DNA https://wikibook.tw/wiki/Structural_Biochemistry/Nucleic_Acid/RNA https://wikibook.tw/wiki/Structural_Biochemistry/Organic_Chemistry/Important_Organic_Reactions_in_Biochemistry/Peptide_Bonding http://en.wikipedia.org/wiki/Ramachandran_plot http://en.wikipedia.org/wiki/List_of_standard_amino_acids http://en.wikipedia.org/wiki/Glycine http://en.wikipedia.org/wiki/Alanine http://en.wikipedia.org/wiki/Valine http://en.wikipedia.org/wiki/Leucine http://en.wikipedia.org/wiki/Isoleucine http://en.wikipedia.org/wiki/Methionine http://en.wikipedia.org/wiki/Serine http://en.wikipedia.org/wiki/Cysteine http://en.wikipedia.org/wiki/Threonine http://en.wikipedia.org/wiki/Proline http://en.wikipedia.org/wiki/Phenylalanin http://en.wikipedia.org/wiki/Tyrosine http://en.wikipedia.org/wiki/Tryptophan http://en.wikipedia.org/wiki/Histidine http://en.wikipedia.org/wiki/Lysine http://en.wikipedia.org/wiki/Arginine http://en.wikipedia.org/wiki/Aspartate http://en.wikipedia.org/wiki/Glutamate http://en.wikipedia.org/wiki/Asparagine http://en.wikipedia.org/wiki/Glutamine https://wikibook.tw/wiki/Structural_Biochemistry/Protein_function/Antibodies http://en.wikipedia.org/wiki/Ramachandran_plot http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6VS6-4V16RKY-1&_user=4429&_coverDate=12/31/2008&_rdoc=1&_fmt=high&_orig=search&_origin=search&_sort=d&_docanchor=&view=c&_acct=C000059602&_version=1&_urlVersion=0&_userid=4429&md5=4f09c690eac3ec0f0c4b8f31dc907058&searchtype=a http://www.ncbi.nlm.nih.gov/pubmed/20570523 Wise DR. Thompson CB., "谷氨醯胺依賴症:癌症治療的新靶點". 生化科學趨勢。2010 年 8 月; 35(8):427-33。 https://wikibook.tw/wiki/Structural_Biochemistry/Nucleic_Acid/Nitrogenous_Bases/Purines https://wikibook.tw/wiki/Structural_Biochemistry/Nucleic_Acid/Nitrogenous_Bases/Pyrimidines https://wikibook.tw/wiki/Structural_Biochemistry/Proteins/Amino_Acids#Asparagine_-_Asn.2F_N https://wikibook.tw/wiki/Structural_Biochemistry/Hemoglobin https://wikibook.tw/wiki/Structural_Biochemistry/Proteins/Purification/High_Pressure_Liquid_chromatography https://wikibook.tw/wiki/Structural_Biochemistry/Chromatography/Thin_Layer https://wikibook.tw/wiki/Structural_Biochemistry/Lipids/Cholesterol https://wikibook.tw/wiki/Structural_Biochemistry/Nucleic_Acid/RNA/Messenger_RNA_(mRNA) https://wikibook.tw/wiki/Structural_Biochemistry/Entropy
“健康化學”,美國衛生與公眾服務部,國立衛生研究院出版物,2006 年重印
http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=5950 http://www.biology.arizona.edu/biochemistry/problem_sets/aa/alanine.html http://www.mayoclinic.com/health/l-arginine/NS_patient-arginine http://www.webmd.com/heart/arginine-heart-benefits-and-side-effects http://www.anyvitamins.com/asparagine-info.htm#Asparagine 是 http://www.biology.arizona.edu/biochemistry/problem_sets/aa/asparagine.html http://www.biology.arizona.edu/biochemistry/problem_sets/aa/aspartate.html http://www.umm.edu/altmed/articles/cysteine-000298.htm http://www.umm.edu/altmed/articles/glutamine-000307.htm http://www.biology.arizona.edu/biochemistry/problem_sets/aa/glutamate.html http://www.webmd.com/vitamins-supplements/ingredientmono-1072-GLYCINE.aspx?activeIngredientId=1072&activeIngredientName=GLYCINE http://www.anyvitamins.com/histidine-info.htm http://www.anyvitamins.com/isoleucine-info.htm http://www.umm.edu/altmed/articles/lysine-000312.htm 所必需的。
- ↑ Berg, Jeremy, Tymoczko J., Stryer, L.(2012). 蛋白質組成和結構。生物化學(第 7 版)。W.H. Freeman and Company。ISBN1-4292-2936-5