結構生物化學/蛋白質
蛋白質是一種功能性生物分子,由一個或多個多肽組成,這些多肽摺疊/盤繞成特定的結構 [1]。蛋白質是重要的生物大分子,充當結構元素、運輸通道、訊號受體和傳遞者以及酶。蛋白質是線性的聚合物,由稱為氨基酸的單體單元構成。有 20 種不同的氨基酸,它們透過羧基和氨基之間的肽鍵連線,形成一條稱為多肽的線性鏈。每種蛋白質都有不同的側鏈或“R”基團。蛋白質具有許多不同的活性官能團附著在其上,以幫助定義其性質和功能。蛋白質涵蓋了廣泛的功能,從非常剛性的結構元件到細胞之間的資訊傳遞。每個人體內都有數十萬種不同的蛋白質。蛋白質根據功能基團之間的分子內鍵合或分子間鍵合(僅四級結構)摺疊成二級、三級和四級結構,並且可以根據氨基酸序列獲得各種三維形狀。所有蛋白質都具有初級、二級和三級結構,但四級結構僅在蛋白質由兩個或多個多肽鏈組成時出現 [1]。蛋白質的摺疊也受到鏈的不同部分之間形成許多鍵的驅動和增強。這些鍵的形成取決於氨基酸序列。對它們結構的研究很重要,因為蛋白質對人體中的所有活動至關重要,並且是生物材料的關鍵成分。一級結構是指氨基酸透過肽鍵連線在一起形成多肽鏈。二級結構是指多肽鏈摺疊成規則的結構,如β摺疊、α螺旋、轉角或環。功能性蛋白質遠不止多肽,它是一個或多個已精確摺疊成具有非常特定、獨特形狀的分子,這對其功能至關重要 [1]。
蛋白質通常以 3D 結構顯示,並分為四種不同的特徵和級別

一級: 蛋白質的一級結構是指蛋白質結構的級別,它指的是氨基酸的特定序列 [1]。當兩個氨基酸處於這樣的位置,即每個氨基酸的羧基彼此相鄰時,它們可以透過進行脫水反應來結合,從而導致肽鍵的形成 [1]。多肽(蛋白質)中的氨基酸透過肽鍵連線,肽鍵從具有遊離氨基的 N 端開始,到具有遊離羧基的 C 端結束。肽鍵是平面的,由於部分雙鍵特徵,無法自由旋轉。雖然肽鍵的旋轉受限,但 (N-C) 鍵和 (C-C) 鍵有兩個自由旋轉,稱為扭轉角,更具體地說,稱為 φ 角和 ψ 角。由於空間位阻,這兩個鍵的旋轉自由度也受到限制。基因攜帶製造具有確定氨基酸序列的多肽的資訊。一個平均多肽大約有 300 個氨基酸長,有些基因編碼的肽鏈有幾千個氨基酸長。重要的是要知道蛋白質的一級結構,因為一級結構編碼在其生物學功能中具有功能重要性的基序;結構和功能在所有級別的生物組織中都是相關的 [1]。
二級: 多肽的氨基酸序列,以及化學和物理定律,導致多肽摺疊成更緊湊的結構。氨基酸可以在蛋白質內的鍵周圍旋轉。這就是蛋白質靈活且可以摺疊成各種形狀的原因。摺疊可以是不規則的,或者某些區域可以具有重複的摺疊模式。由於多肽主鏈重複片段之間形成的氫鍵導致的螺旋和摺疊稱為二級結構 [1]。雖然單個氫鍵很弱,但由於它們在鏈的大部分割槽域重複多次,因此它們能夠支撐蛋白質該部分的特定形狀 [1]。蛋白質的二級結構是由鮑林和科裡提出的。它的結構是由位於彼此短距離內的氨基酸形成的。由於肽鍵的平面性質,只存在某些型別的二級結構。三個重要的二級結構是 α-螺旋、β-摺疊和β-轉角。此外,β摺疊可以是平行的、反平行的或混合的。反平行β摺疊更穩定,因為氫鍵成 90 度角。α-螺旋是一種螺旋結構,由鏈內氫鍵穩定。
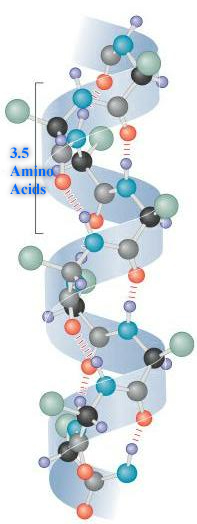
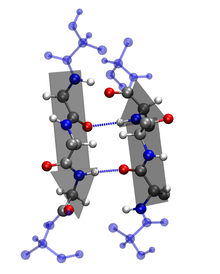
二級結構的特徵:
1. α-螺旋: 在 α-螺旋中,多肽主鍊形成重複的螺旋結構,由羰基氧和胺氫之間的氫鍵穩定。這些氫鍵以每四個氨基酸一個氫鍵的規律間隔出現,導致多肽主鍊形成螺旋 [1]。最常見的螺旋結構是右手螺旋,其氫鍵平行於其軸線。氫鍵在四個氨基酸殘基外的羰基氧和胺氫基團之間形成。每個氨基酸沿著其軸線將螺旋前進 1.5 Å。螺旋的每個週轉由 3.6 個氨基酸組成;因此螺旋的螺距為 5.4 Å。螺旋平均包含十個氨基酸殘基,其側鏈朝向螺旋外部。不同的氨基酸具有形成 x-螺旋的不同傾向,但脯氨酸是螺旋破壞者,因為脯氨酸沒有遊離的氨基。更喜歡在蛋白質中採用螺旋構象的氨基酸包括蛋氨酸、丙氨酸、亮氨酸、穀氨酸和賴氨酸(malek)。
2. β-摺疊: ß-摺疊透過肽鏈之間的氫鍵穩定。在 β-摺疊中,多肽主鏈的區域彼此平行排列,並透過氫鍵連線 [1]。氫鍵在多肽中相鄰鏈的氨基酸的羰基氧和胺氫之間形成,這意味著氫鍵是鏈間的。β-摺疊區域比 α-螺旋更伸展,相鄰氨基酸之間的距離為 3.5 Å。β-鏈中的氫鍵可以平行、反平行或混合出現。β-平行構型中的氨基酸殘基以相同的方向執行。褶皺片構成了許多球狀蛋白質的核心,並且也是一些纖維狀蛋白質(如蜘蛛網)中的主要結構 [1]。大的芳香族化合物(如:色氨酸、酪氨酸和苯丙氨酸)和β-支鏈氨基酸(如:異亮氨酸、纈氨酸和蘇氨酸)更喜歡採用β-鏈構象。這種方向在能量上不利,因為其氫鍵傾斜且非垂直。色氨酸、酪氨酸和苯丙氨酸是疏水性的,而其他氨基酸是親水性的。
3. β-轉角: 多肽鏈可以透過進行反轉彎和環來改變方向。連線兩個反平行 β-鏈的環區域稱為反轉彎或 β-轉角。這些環區域的長度和形狀不規則,通常位於蛋白質表面。轉角透過羰基氧和胺氫的主鏈之間的氫鍵穩定。在許多反轉彎中,殘基的 CO 基團與殘基 i + 3 的 NH 基團鍵合。這種相互作用穩定了多肽鏈方向的突然變化。與α-螺旋和ß-鏈不同,環沒有規律的週期性結構。然而,它們通常是剛性的和明確定義的。由於環位於蛋白質的表面,因此它們能夠參與蛋白質和其他分子之間的相互作用。Ramachandran 圖是一個顯示蛋白質可以找到的可用扭轉角的圖。然而,在圖中,如果到處都有很多點,那就意味著存在一個環。
三級: 由於一級結構,二級結構開始建立,多肽摺疊並在自身上重新摺疊,以形成稱為蛋白質三級結構的複雜三維形狀。三級結構是多肽的整體形狀。[1] 三級結構是由各種氨基酸的側鏈(R 基團)之間的相互作用產生的 [1]。這種三維結構是由於多肽鏈中側基之間的分子內相互作用而產生的。其結構域通常包含 300-400 個氨基酸,當從其親本蛋白質中分離出來時,它會採用穩定的三級結構。當多肽摺疊成其功能形狀時,具有疏水側鏈的氨基酸往往會聚集在蛋白質的核心,以使其與水隔離 [2]。稱為二硫鍵的共價鍵也會影響蛋白質的形狀 [1]。二硫鍵是在蛋白質摺疊方式使兩個包含其側鏈上巰基的氨基酸彼此靠近時形成的 [1]。對於某些蛋白質(如核糖核酸酶)來說,三級結構是功能性蛋白質的最終結構。其他蛋白質由兩個或多個多肽組成,並採用四級結構。
四級結構:雖然所有蛋白質都包含一級、二級和三級結構,但四級結構是為由兩個或多個多肽鏈組成的蛋白質保留的 [1]。具有四級結構的蛋白質包含不止一個多肽,並且每個多肽都採用三級結構,然後透過分子間相互作用組裝在一起。蛋白質的四級結構是這些多肽亞基新增後的整體結構 [1]。單個多肽被稱為蛋白質亞基,這意味著不同的多肽分別摺疊。亞基可以是相同的多肽,也可以是不同的多肽。當蛋白質由多個多肽鏈組成時,它們被稱為具有四級結構,也稱為多聚體蛋白質,這意味著由許多部分組成的蛋白質。四級結構也可以定義為當多個蛋白質聚在一起形成二聚體、三聚體、四聚體等時 [2]。血紅蛋白是四級結構的一個例子,它由兩個α亞基和兩個β亞基組成。

球狀蛋白和纖維狀蛋白
[edit | edit source]纖維狀蛋白:纖維狀蛋白也稱為硬蛋白,是長長的蛋白質鏈,形狀像棒狀線。與球狀蛋白不同,它們不容易變性,並且包含許多重複的二級結構。它們主要是結構蛋白,負責生物體的支撐和保護,例如形成結締組織、肌肉纖維、骨骼和肌腱。纖維狀蛋白的兩個例子是
1. α-角蛋白:α-角蛋白(頭髮、蹄子、角、指甲等中必不可少)是一種螺旋狀蛋白,由兩個相互纏繞的α-螺旋組成。螺旋狀結構存在於其他結構蛋白中,例如骨骼肌的肌球蛋白;它具有與每個轉彎 3.5 個氨基酸相對應的七肽重複。這些蛋白質螺旋中 a、d、a' 和 d' 位置的殘基通常是疏水的。螺旋狀結構中的兩條鏈透過疏水相互作用以及離子相互作用和二硫鍵連線在一起。
2. 膠原蛋白:膠原蛋白(肌腱、軟骨、血管壁)是人體中最豐富的蛋白質。膠原蛋白是一種三螺旋結構,與α-螺旋不同,它有 3.3 個氨基酸和每圈 10 Å。膠原蛋白透過氫鍵穩定,氫鍵形成於位於相鄰鏈上的氨基酸的羰基氧和胺氫之間,並且垂直於纖維軸。它富含脯氨酸,並含有羥脯氨酸和羥賴氨酸。然而,由於脯氨酸含量豐富,沒有鏈內氫鍵,脯氨酸和賴氨酸的羥基化需要維生素 C。維生素 C 缺乏會導致壞血病。膠原蛋白中三分之一的氨基酸是甘氨酸,因為空間擁擠;只有甘氨酸存在於膠原蛋白分子的中心。膠原蛋白分子可以透過共價鍵交聯形成更大的纖維和片層。
球狀蛋白:球狀蛋白摺疊起來以埋藏疏水側鏈。所有球狀蛋白都有一個內部,疏水核心排列在其中。它有一個朝外的部分,親水基團朝向該部分。不帶電荷的極性氨基酸殘基通常位於蛋白質表面,但它也可能出現在內部。在後一種情況下,它會與其他基團形成氫鍵,即 ser、thr、tyr 都是極性的、不帶電荷的。
影響蛋白質結構的因素
[edit | edit source]幾個因素決定了多肽如何採用它們的二級、三級和四級結構。多肽的氨基酸序列是區分一種蛋白質與另一種蛋白質結構的決定性特徵。隨著多肽在細胞中合成,它們摺疊成二級和三級結構,對於大多數蛋白質,它們組裝成四級結構。如前所述,化學和物理定律以及氨基酸序列共同支配著這個過程。五個因素對於 蛋白質摺疊 和穩定性至關重要
1. 氫鍵:氫鍵形成於氫鍵供體和氫鍵受體之間。對於氨基酸,氫鍵將在胺基的骨架和羰基的氧之間發生。
2. 離子鍵:靜電相互作用發生在兩個帶相反電荷的分子之間。離子相互作用在水中比在真空中弱,這是由於蛋白質結構中相反電荷之間面對的介電常數不同。
3. 疏水效應:疏水相互作用源於非極性分子最小化它們與水的相互作用的趨勢。當非極性分子與水相互作用時,這些分子傾向於聚集在一起形成一個膠束。
4. 範德華力:範德華力存在於非極性分子之間,在很近的距離。在三種範德華相互作用中,永久偶極之間的相互作用最強,偶極-誘導偶極相互作用比永久偶極弱,而倫敦色散力最弱。雖然單個原子之間的範德華力很弱,但許多原子在大型大分子中相互作用所產生的範德華力的總和可能很大。範德華相互作用的強度隨原子之間距離的變化而變化,在範德華接觸距離時最大。
5. 二硫鍵:二硫鍵可以透過氧化在兩個半胱氨酸之間形成。這些也是蛋白質三級結構中最強的共價鍵。
蛋白質變性
[edit | edit source]蛋白質變性:是指三級結構的天然構象喪失。變性蛋白質經歷內部三級或二級結構的破壞或破壞。然而,變性不會破壞相鄰氨基酸之間的肽鍵,因此不會影響蛋白質的一級結構。然而,變性會干擾蛋白質中正常的α-螺旋和β-摺疊,最終扭曲其 3D 形狀。
變性會導致靠近的氨基酸之間的氫鍵斷裂,從而干擾蛋白質的二級和三級結構。在三級結構中,"側鏈"之間有四種類型的鍵合相互作用,包括:氫鍵、離子橋、二硫鍵和疏水分子間相互作用。換句話說,有幾種不同的條件可以使蛋白質的構象變性。
使蛋白質變性的條件:
1. 極端 pH (pH < 4 或 pH > 9) : 改變 H-鍵
2. 熱 (temp >70oC): 熱效應,破壞非共價鍵的弱力
3. 去垢劑或有機溶劑 : 破壞疏水相互作用
4. 變性劑 (高濃度) : 例如,尿素和鹽酸胍
特定蛋白質的啟用需要定位在其特定位置
[edit | edit source]隨著科學家開始發現化學的更多方面,他們實際上發現了細胞化學/生物學中的複雜性程度。雖然科學家發現蛋白質在體內起著至關重要的作用,但他們也發現蛋白質在細胞中的特定部位自行組裝,只有在需要時才會被啟用。使用 GFP 標記蛋白(熒光)在活細胞中,觀察到蛋白質的位置和重新定位響應特定訊號的變化。當細胞外訊號分子與受體蛋白結合時,它會將不同的蛋白質拉入質膜的內部區域,以建立傳遞訊號的蛋白質裝置。

人類有 10 種 PKC 酶,它們在調節和功能方面都不同。當 PKC 被啟用時,它將從細胞質移動到各種細胞內位置,最終與其他蛋白質形成特定的複合物,從而使它們能夠磷酸化不同的蛋白質底物。各種連線酶表達這種行為,例如 SCF 泛素連線酶。這些機制涉及蛋白質磷酸化和支架蛋白之間的協作,這些支架蛋白將特定的啟用、抑制、銜接子和底物蛋白連線到細胞的特定部分。

這種現象被稱為誘導鄰近性,它描述了為什麼具有相同反應位點的酶的微小不同形式可以具有不同的功能的原因。這可以透過多種方式共價修飾蛋白質的位置來完成。這些改變在蛋白質上構建結合位點,以便它可以與支架蛋白結合,使它們聚集在一起,以便不同的反應可以在細胞的特定位置發生。因此,支架允許細胞在不需要膜的情況下對反應進行分組。
人們過去認為支架蛋白將蛋白質固定在彼此相關的特定位置,但實際上,多肽鏈的無結構區域連線著相互作用的蛋白質。這使得蛋白質能夠以隨機方向頻繁地相互碰撞,其中一些碰撞會導致成功的反應。蛋白質的束縛允許更快的反應速度。因此,支架蛋白為控制細胞化學提供了靈活的方法。

DEAD 盒蛋白由 RNA 解旋酶組成,它們參與 RNA 代謝過程,並且在細菌和病毒到人類中發現的九個結構域中是保守的。它們長 350 個氨基酸。DEAD 盒蛋白參與前 mRNA 加工、剪接體形成和核糖核蛋白 (RNP) 複合物的重新排列。DEAD 盒蛋白是前 mRNA 剪接和體內剪接過程所必需的。在 pre-mRNA 加工過程中,DEAD 盒蛋白解旋以提供能量來重新排列前 mRNA 剪接所需的五個 snRNP(U1、U2、U4、U5 和 U6)。在體內剪接中,需要三種 DEAD 盒蛋白,Sub2、Prp28 和 Prp5。Prp5 幫助重新排列 U2 的構象,這使得 U2 序列能夠結合到分支點序列。Prp28 有助於識別 5' 剪接位點。
第一個 DEAD 盒蛋白,ElF4A 翻譯起始因子,依賴於 RNA ATPase 活性。這種蛋白有助於解開二級結構,從而阻止掃描。
細胞的分子生物學 第 5 版 阿爾伯茨
生物化學 第 6 版 伯格、蒂姆科和斯特里爾
坎貝爾生物學 第 9 版 尼爾·坎貝爾和簡·里斯 2010
