結構生物化學/核酸/DNA/複製過程
DNA 複製是所有細胞分裂所必需的,這使得生物體能夠生長。在 DNA 複製中,DNA 首先被分成基因組中的兩條子鏈,這些子鏈攜帶與原始細胞完全相同的遺傳資訊。該鏈分離的起點稱為“起點”。DNA 的雙鏈結構有助於複製機制;這兩條鏈首先被分離成兩條單獨的鏈。然後,這兩條分離鏈的互補鏈由 DNA 聚合酶(一種專門用於製造互補鏈的酶)重新建立;它將找到每條鏈的正確互補鹼基,並將從 5' 到 3' 延伸。原始鏈被儲存的過程稱為“半保留複製”。DNA 複製在生物體的生命週期中是必不可少的。它是在位於複製起點處的雙鏈 DNA 分離或熔化時啟動的。當雙鏈 DNA 熔化時,熔化區域會傳播,並形成成熟的複製叉。DNA 熔化以及複製叉的形成由起始因子、解旋酶和其他細胞因子協調。最近在起始因子和複製解旋酶的結構生物化學研究方面的進展在古細菌和真核細胞中得到了強調。這些研究的結果為 DNA 複製早期階段的可能機制提供了新的見解。
基因組 DNA 是所有生物體中普遍存在的、必要的和必不可少的過程。複製可以分為起始、延伸和終止三個步驟。
在起始過程中,起始因子識別並結合複製起點 DNA,將其轉化為複製叉。起始的步驟由以下步驟組成:起始因子在 DNA 起點周圍組裝,並且 dsDNA 起點被熔化。dsDNA 的熔化在起點的兩側產生複製叉,以允許雙向複製。然而,在這一步發生之前,必須克服拓撲限制才能將熔化的起點轉化為叉結構。為了誘導起始因子在起點的組裝,可以利用生化方法來檢測起點 dsDNA 的初始熔化。在古細菌和真核細胞系統中,起點熔化的持續時間尚不確定。然而,已證明起點熔化是由 LTag 的組裝誘導的。SV40 LTag 能夠誘導起點熔化和解旋,因此被認為是真核系統中的起始因子[檢查拼寫]。它已被用作研究起點識別、組裝和熔化過程的模型。為了從熔化的 dsDNA 起點轉化,在活性複製叉處組裝的起始因子會擴充套件熔化區域並將解旋酶定位到叉上。
起始步驟是 DNA 複製中三個步驟之一(連同延伸和終止)。在起始中,許多稱為起始因子的複製蛋白將 DNA 轉化為複製叉。首先是起始蛋白在 DNA 周圍組裝,導致 dsDNA(雙鏈 DNA)起點的熔化。然後,起點熔化開始在熔化起點的兩側產生複製叉。這產生了雙向複製。環形解旋酶協助這個過程。然而,由於缺乏高解析度結構,起始因子和解旋酶如何熔化和解旋起點 DNA 的機制尚不清楚。
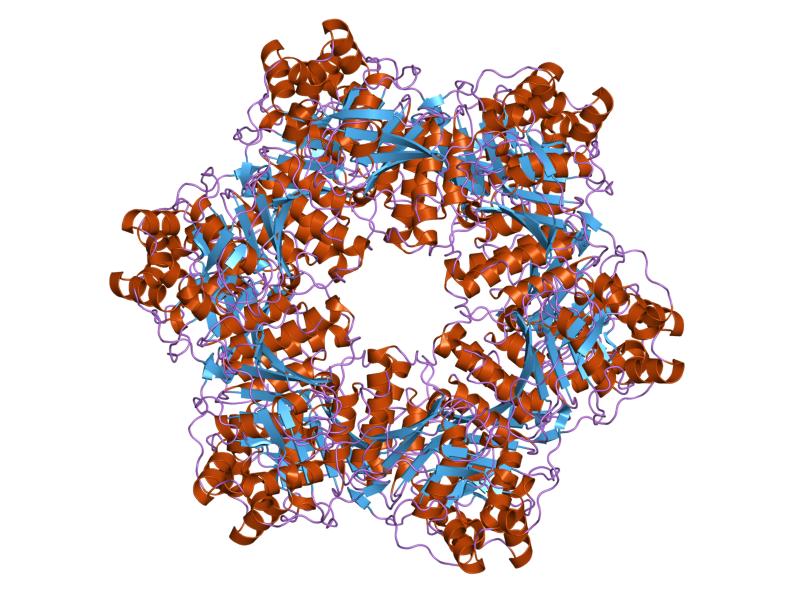
在真核和古細菌細胞系統中,起始蛋白包括 Orc、Cdc6、Cdt1 和 MCM(微型染色體維持)解旋酶。MCM 是解旋叉形成中最重要的因素之一。MCM 形成六聚體,可以二聚化為雙六聚體。SV40 大 T 抗原(LTag)的解旋酶能夠識別起點 DNA,並且可以在不使用輔因子的情況下將 DNA 熔化並解旋為複製叉。SV40 LTag 被認為是真核系統中的典型起始因子/解旋酶,是研究識別、組裝和熔化的模型。
LTag 六聚體的晶體結構揭示了一個(13-17Å)的通道,足以讓 ssDNA 透過,但不能讓 dsDNA(20 Å)透過。據信,即使在起點處組裝期間,熔化的 ssDNA 也被包圍在六聚體解旋酶的中心通道中。
LTag 還顯示了中心通道中的 β-髮夾,它以平面排列的方式配置。β-髮夾與 DR/F 環形成 2 個相鄰的平面環,這有助於 AAA+ 結構域中通道的最窄部分。人們質疑 LTag 是否可以擴充套件以容納 dsDNA,或者 dsDNA 是否由起始因子/解旋酶修飾以適應狹窄的通道。然而,對於後者來說,LTag 必須擠壓和壓碎 dsDNA,這會破壞鹼基對並熔化 dsDNA。這種模型通常被稱為“擠壓開啟模型”。
最廣泛接受的叉解旋模型是環形解旋酶圍繞 DNA 鏈遷移,並將其分離為 ssDNA。
在原核細胞中,細菌複製酶包含聚合酶、聚合酶 III(Pol III)、β2 因子和 DnaX 複合物。它們在許多方面都是非常高效的,並且在岡崎片段合成期間迴圈速度更快。DnaA(一種起點識別蛋白)可以啟動起點熔化為單鏈 DNA(ssDNA)。ssDNA 是載入六聚體解旋酶 DnaB(僅以單六聚體形式存在)的位點。細菌擁有的一個解旋酶是 DnaB6,它可以在複製叉處分離兩條鏈。它在 5'-->3' 方向上轉運。DNA 聚合酶 III 全酶(Pol III HE)在複製叉處接觸,並且也充當二聚體,在岡崎片段合成期間似乎對滯後鏈具有受調節的親和力,以便在引物之間迴圈。DnaB 利用 ATP 水解沿著鏈向下移動,以分離兩條鏈。引物酶與解旋酶相互作用,並與岡崎片段合成的短 RNA 引物結合。RNA 引物透過 Pol III HE 不斷延伸,直到接收到訊號以更換複製叉處的下一個引物。在這個過程中,岡崎片段之間的間隙被填補,RNA 引物被 DNA 聚合酶 I 刪除,並被 DNA 連線酶封閉。DnaB 的 N 端是自由的,用於停靠引物酶,這使得引物酶在叉解旋期間很容易捕獲從 N 端結構域出現的 ssDNA。
儘管人們對雙鏈 DNA 熔化啟動的複製知之甚少,但最近的研究揭示了該過程可能機制的一些資訊。從古細菌中發現了兩種包含起始因子和起點 DNA 的共晶體結構,它們表明起始因子是如何識別雙鏈起點 DNA 的。這些複合物,Cdc6/Orc-dsDNA 顯示雙鏈 DNA 發生變形和彎曲,但沒有熔化。因此,研究人員認為,為了觸發雙鏈 DNA 的熔化並生成複製起點處的更高階複合物,需要像上面提到的 MCM 這樣的起始因子。
此圖展示了 DNA 複製起始複合物結構的示例,具體展示了 Cdc21 和 Cdc54(類似於上面描述的 Cdc6)的 N 端結構域。起始複合物,Cdc6/ORC 1(未在此圖中展示,但可以由上圖表示)結合到複製起點並彎曲 DNA。引用:http://www.ebi.ac.uk/ http://upload.wikimedia.org/wikipedia/commons/c/c6/PDB_1ltl_EBI.jpg 在真核生物中,SV40 Ltag 在複製起點能夠觸發複製起點的解鏈和隨後 DNA 的解旋,使其成為作為模型系統用於研究複製起點識別、組裝和雙鏈 DNA 解鏈的起始解旋酶。已顯示未與 DNA 結合的 Ltag 六聚體的晶體結構具有通道,這些通道似乎只能結合單鏈 DNA,而不能結合雙鏈 DNA,因為這些通道通常約為 13 至 17 Å(埃),而雙鏈 DNA 分子的直徑約為 20 Å,導致雙鏈 DNA 分子無法進入通道。通常,DNA 易位研究表明,為了使雙鏈 DNA 進入 Ltag 六聚體通道而不改變其形狀,通道的直徑必須至少為 20 Å。除了不夠大之外,Ltag 六聚體的晶體結構在中間通道中具有 β 髮夾的平面排列。
這裡是一個 β 髮夾的示例,它是 LTag 六聚體結構的一個組成部分。β 髮夾中的 β 鏈是反平行的,這意味著一個 β 片的 N 端與另一個 β 片的 C 端對齊。在 LTag 六聚體的情況下,β 髮夾位於通道中心區域的同一平面上。引用:http://commons.wikimedia.org/wiki/File:Beta_hairpin.png
最近,冷凍電鏡證明了 Ltag 六聚體通道可以透過兩個六聚體包圍雙鏈 DNA 分子而結合雙鏈 DNA 分子。然而,研究人員仍然不確定雙鏈 DNA 是否因起始解旋酶而改變構型,或者 Ltag 是否變寬以允許雙鏈 DNA 結合。一種模型,即擠壓開放模型,斷言 Ltag 六聚體可以透過將 DNA 擠過通道來將複製起點雙鏈 DNA 塞入其更窄的通道中。結果,鹼基對被破壞,雙鏈 DNA 複製起點解鏈發生。該模型已被提出,並且正在確認中,因為它似乎與有關 DNA 解鏈的已知資料一致。
擠壓泵模型形成的複製叉
擠壓泵模型源於 Ltag 六聚體結構的資訊。該結構包括如上所述的窄通道、AAA+ 運動結構域、單鏈 DNA 可以離開的側通道和 Zn 域間。該模型基於上面描述的擠壓開放模型使 DNA 解鏈,其中解鏈的 DNA 被泵送到 Zn 域,直到它產生單鏈 DNA 環,然後可以離開通道並形成複製叉。
單鏈和部分水解雙鏈 DNA 的易位:研究人員證明了雙六聚體 LTag 和 MCM 具有解旋 DNA 的能力。已顯示 Ltag 能夠在雙六聚體形式中解旋包含內部複製起點序列的長雙鏈 DNA。這與叉解旋的立體排斥模型不同,後者是目前最廣泛接受的模型。該模型基於證據表明,環形解旋酶圍繞一條 DNA 鏈並沿其移動到雙鏈 DNA 叉,同時在此過程中暴露單鏈 DNA 鏈。
上圖展示了一個環形六聚體解旋酶結構,它圍繞 DNA 鏈並沿其移動(圖中未顯示)。引用:http://www.ebi.ac.uk/Information/termsofuse.html ; http://commons.wikimedia.org/wiki/File:PDB_1g8y_EBI.jpg
資料來源
Curr Opin Struct Biol. 2010 年 9 月 24 日。[提前出版] DNA 複製中的複製起點 DNA 解鏈和解旋。Gai D, Chang YP, Chen XS。南加州大學分子和計算生物學,美國加州洛杉磯市 Childs Way 1050 號,90089。
幾十年來,人們對 DNA 複製和蛋白質合成進行了單獨的研究。很少有科學家討論這兩個對生物體至關重要的過程之間的聯絡。Jonathan Berthon、Ryosuke Fujikane 和 Patrick Forterre 在他們的文章“當 DNA 複製和蛋白質合成走到一起”中共同提供了對這些看似獨立的結構生物化學領域之間聯絡的詳細解釋。他們認為,DNA 複製和蛋白質合成之間意想不到但真實的聯絡存在於生命的三域中,尤其是在古細菌和真核生物中。他們相信存在著將 DNA 和蛋白質合成耦合在一起的機制。這種機制可以在(p)ppGpp(鳥苷多磷酸衍生物)和 GTP 酶或 Obg 家族的活性中找到。
- 嚴格應答是一種現象,可以很好地將細菌中 DNA 複製過程與蛋白質中氨基酸濃度的變化聯絡起來。當發生氨基酸飢餓時,觀察到細胞內(p)ppGpp 濃度急劇增加,從而啟動 rRNA 基因轉錄和蛋白質合成的關閉。然而,這個過程在不同的細菌體內有所不同。例如,在枯草芽孢桿菌系統中,氨基酸飢餓以及 rRNA 基因轉錄的抑制會阻斷 DNA 複製的延伸步驟。在枯草芽孢桿菌中,(p)ppGpp 還會抑制 DnaG 引物酶,並可能直接影響滯後 DNA 鏈在自我複製過程中的岡崎片段合成。另一方面,大腸桿菌的嚴格應答會導致 DNA 複製起始的瞬時干擾。此類證據對於證明蛋白質與 DNA 複製過程之間的直接聯絡非常重要。蛋白質的氨基酸飢餓有可能阻止 DNA 複製。
- 另一個聯絡來源是 Obg 家族。Obg 以其將核糖體生物合成(蛋白質合成中一個關鍵步驟,因為蛋白質合成是透過 mRNA 在核糖體中完成的)與 DNA 複製耦合的能力而聞名。科學家們認為,核糖體生物合成與 DNA 複製之間的聯絡始於最初在核糖體制造中發揮作用的蛋白質。這些蛋白質參與細菌中嚴格應答的調節以及 DNA 複製叉的穩定。一種稱為 ObgE 的 Obg 型別在控制(p)ppGpp 水平方面很有用。在 ObgE 中發現的 DNA 複製和蛋白質合成之間的一個重要聯絡是,ObgE 的耗竭會導致染色體分離和細胞分離問題。這項研究意義重大,因為它表明體內某些蛋白質的變化會直接影響 DNA 複製模式和生物體的遺傳加工。出於這個原因,進行了 Obg 研究以證明這種蛋白質在連線 DNA 複製和蛋白質合成中所起的重要作用。
- 類似地,一個稱為 NOG1(核仁 G 蛋白)的蛋白質家族也參與核糖體的製造。來自該家族的 Nog1p 屬於一個複雜的複合物,其中包含許多其他直接參與 DNA 複製的蛋白質,例如 Orc6p(複製起點識別複合物)、Mcm6p、MCM 複合物的一些亞基、Yph1p 和 Rrb1p。Kilian 做出了一個非常重要的宣告,即連線核糖體生物合成與 DNA 複製的蛋白質的改變會導致“染色體不穩定”和“腫瘤形成”。他還得出結論,存在一個蛋白質網路,直接將核糖體的產生與真核生物域中的 DNA 複製聯絡起來。
- 以上所有研究和結論僅適用於真核生物,因為尚未找到關於古細菌域的明確證據。然而,科學家們發現,存在一個基因簇,這些基因簇編碼 DNA 複製和翻譯蛋白。該簇包含許多基因,包括必需基因,例如 aIF-2,它是調節 DNA 複製和蛋白質合成的極佳來源。來自該簇的 eIF-2 磷酸化是真核細胞中蛋白質合成機制的主要組成部分。另一個重要組成部分是 Nop10,它在 rRNA 的發育中發揮作用。僅從檢查這些組成部分就可以得出明確的結論,即蛋白質和 DNA 複製研究確實存在密切關係。一個重要的例子是 L44E 和 S27E 這兩種核糖體蛋白在特殊條件下(例如之前討論的嚴格應答情況下的氨基酸飢餓)會干擾 DNA 複製過程的現象。
- 總之,在古細菌和真核生物中,許多實驗資料證實或表明蛋白質合成與 DNA 複製之間存在密切聯絡。嚴格應答是氨基酸飢餓如何抑制 DNA 複製起始過程的一個例子。

DNA 複製過程以“流水線”的方式進行。DNA 雙螺旋被撕裂,併產生每條鏈的副本。許多生物酶參與其中,並且必須存在才能使這種重要作用正確發生。
當 DNA 被複制時,它會形成一個複製叉,該複製叉是在解旋酶過程中建立的,解旋酶分離了 DNA 鏈。分離的鏈被稱為引導鏈和滯後鏈。引導鏈在 5'-3' 方向合成。它是新的 DNA 鏈,由 DNA 聚合酶合成。另一方面,滯後鏈位於對側,從 3' 到 5' 方向延伸,由岡崎片段合成。然後,引物酶會構建 RNA 引物,允許 DNA 聚合酶利用 RNA 引物上的 3' OH 基團作用於從 5' 到 3' 方向延伸的 DNA。然後,這些 RNA 片段被新的脫氧核糖核苷酸取代,並且該鏈將與 DNA 連線酶連線在一起以完成鏈。
隨著 DNA 的解旋,它會自動迫使 DNA 旋轉,扭曲結構。這實際上是複製 DNA 的一個問題,因為它最終會在過度扭曲時物理上無法複製。為了解決這個問題,使用了一種稱為 DNA 拓撲異構酶的酶。拓撲異構酶 I 會切斷 DNA 的骨架以允許 DNA 自行解旋,而拓撲異構酶 II 會切斷兩條鏈的骨架以允許與其他 DNA 分子的相互連線,從而消除纏繞在一起的可能性。
解旋酶是沿雙鏈核酸移動並主動解開雙螺旋的馬達蛋白。該酶利用 ATP 水解為 ADP 所產生的能量來解開和分離 DNA 鏈。這是透過破壞退火核苷酸鹼基之間氫鍵來實現的。解旋酶開啟雙鏈可以分為兩種情況:主動開啟和被動開啟。在主動開啟的情況下,解旋酶直接破壞雙鏈核酸 (dsNA) 以促進兩條鏈的分離。在被動開啟的情況下,解旋酶結合到由於熱波動而存在的單鏈核酸 (ssNA) 上,從而誘導部分雙鏈的開啟。據發現,與被動開啟相比,主動開啟可以使 DNA 鏈的解旋速度提高 7 倍。這種作用的產物是兩條模板鏈。一條被稱為引導鏈,另一條被稱為滯後鏈。
引導鏈是親本 DNA 的單鏈,它連續合成而不會中斷,而親本 DNA 的滯後鏈則以片段的形式形成。這些片段被稱為岡崎片段。這對於解釋親本 DNA 的兩條鏈如何在 5'->3' 方向形成很重要,儘管兩條鏈是反平行的。片段合成使 5'->3' 增長能夠發生,同時似乎在 3'->5' 方向形成。
單鏈 DNA 結合蛋白以一種阻止新形成的兩條鏈重新退火的方式結合到 DNA 模板上。這些蛋白使鏈保持分離,以便兩條鏈都可以作為複製的模板。這使複製機制的其餘部分能夠就位並開始製造新的 DNA 鏈。
(參見 DNA 聚合酶部分)
RNA 引物酶以與解旋酶相鄰的位置附著在滯後鏈上。RNA 引物酶在 DNA 複製中的功能是以 3' 到 5' 的方式放置 RNA 引物。這些 RNA 引物充當 DNA 聚合酶新增互補核苷酸的起始和結束位置。RNA 引物之間的核苷酸序列被稱為岡崎片段。RNA 引物酶僅在滯後鏈中是必需的,因為 DNA 聚合酶只能在 5' 到 3' 方向新增互補鹼基,而滯後鏈在 3' 到 5' 方向解旋。

線粒體 DNA (mtDNA) 與核 DNA 分開維持。由於 mtDNA 的體積小,它只能擁有 37 個基因和 13 個蛋白質產物,而單倍體核基因組編碼超過 20,000 個基因。然而,它可以為研究核 DNA 複製提供模型系統。人類的環狀 mtDNA 基因組包含大約 16,600 個鹼基對。編碼的基因也被發現對於透過氧化磷酸化生成 ATP 是必要的。mtDNA 似乎沒有特定的階段進行復制,這意味著複製可以在細胞週期中反覆進行。
內共生假說認為,線粒體被吞噬形成了第一個真核生物。支援這種假說的證據來自 mtDNA 本身的存在。由於線粒體曾經是自由生活的細菌,可以預期 mtDNA 維持的機制將與原核生物相比更相似。
mtDNA 複製的機制是在 1972 年透過電子顯微鏡發現的。所有複製的 mtDNA 分子都具有一個單鏈分支。這進一步導致線粒體中引導鏈和滯後鏈合成解偶聯,這與核 DNA 的複製叉不同。人類 mtDNA 通常排列成共價閉合的環狀結構,這些結構約為一個基因組的長度。在 mtDNA 複製中,存在一個鏈置換複製叉,其中引導鏈 DNA 合成在沒有滯後鏈 DNA 合成的條件下發生。DNA 合成是由傳統的偶聯引導鏈和滯後鏈進行的。然後,延遲的滯後鏈 DNA 合成伴隨著在滯後鏈上摻入 RNA,稱為 RITOLS,表示整個滯後鏈上的 RNA 摻入。
哺乳動物如何複製其 mtDNA 的問題導致了 mtDNA 複製重現,它試圖檢驗這樣一種觀點,即人類病理 mtDNA 變異的偏向性分離與複製優勢有關,如酵母 mtDNA 所表明的那樣。2D 瓊脂糖凝膠電泳 (2D-AGE) 用於分離來自線粒體的複製中間體。這用於定義核、質粒和病毒基因組複製機制的細節。據發現,來自粗線粒體制劑的許多複製中間體對單鏈核酸酶敏感,正如 SDM 所預測的那樣,其中一部分形成了與複製的核和原核 DNA 相關的弧線無法區分。
然而,更純淨的線粒體制劑產生了不是部分單鏈 DNA 而是 RNA/DNA 雜交體。這表明,早期研究中的 SDM 中間體可以透過分離和處理過程中 RNA 的丟失來解釋。
總之,關於 mtDNA 複製機制仍存在爭議。mtDNA 複製的鏈置換模型是,每條鏈至少有兩個引物成熟事件,這同樣適用於 RITOLS 複製。線粒體中 Dna2 和 Fen1 的鑑定為研究 mtDNA 複製提供了新的工具。透過操縱它們的表達並研究破壞 mtDNA 複製的突變變體,這可能被證明非常有資訊量。
據發現,mtDNA 的突變、缺失和其他有問題的排列與哺乳動物的衰老呈正相關。單個細胞中突變的 mtDNA 的積累會導致呼吸鏈缺陷。這會導致哺乳動物的壽命縮短。當存在許多突變時,它還會導致衰老表型,例如體重減輕和脫髮。 [1]
霍爾特,伊恩 J. "線粒體 DNA 複製與修復:全都是一團糟."
- 貝特頓 MD,朱麗徹 F,"解旋酶開啟核酸雙鏈:主動開啟與被動開啟.", 物理評論 E. 2005 年 1 月; 71 (1): 011904.
- 伯通,喬納森,藤岡良介和帕特里克·福特雷。“當 DNA 複製和蛋白質合成結合在一起”。生物化學科學趨勢。第 34 卷,第 9 期(2009 年):429-434。細胞出版社。
- 蓋大海,Y 保羅·昌和陳曉江。“DNA 複製中的起始 DNA 熔解和解旋”。結構生物學最新觀點 2010 年,20:1-7。愛思唯爾。
- 查爾斯·S·麥克亨利。“從細菌角度看 DNA 複製酶”。生物化學年度評論 第 40 卷 2011 年 7 月,403-36。