結構生物化學/有機化學

研究含碳分子的科學被稱為有機化學。 碳原子使生命成為可能的特性之一是它能夠與其他原子(包括其他碳原子)形成四個共價鍵。 這種結合能力源於碳原子外殼中的四個電子,使其需要另外四個電子才能使外殼充滿。
在生物體中,碳原子最常與其他碳原子以及氫、氧、氮和硫原子形成共價鍵。 在有機化合物中,兩個碳原子之間、碳和氧之間或碳和氮之間的鍵可以是單鍵或雙鍵。 然而,在無機化合物中可以發現這些原子之間更高階的鍵。 碳與自身以及不同元素和不同型別的鍵的組合使得僅從幾種化學元素就能形成大量的有機化合物。 這更加令人印象深刻,因為碳鍵可能以線性、環狀或高度分支的構型存在。 這些分子形狀可以產生具有多種功能的分子。 碳在生物化學中重要的最後一個特徵是碳鍵在與生命相關的不同溫度下都很穩定。 這種性質部分源於碳原子與大多數其他原子相比非常小,因此形成碳-碳鍵的碳原子之間的距離相當短。 兩個大原子之間形成的較短鍵往往比較長的鍵更強更穩定。 因此,碳原子與我們今天觀察到的生命相容,即生物體可以抑制從地球冰冷的兩極到深海熱液噴口的各種環境。 除最簡單的烴外,大多數有機分子和生物大分子都含有官能團 - 一組具有特殊化學特徵的原子,這些特徵在功能上很重要。 每種型別的官能團在所有包含它的分子中都表現出相同的特性。 例如,氨基(NH2)充當鹼。 在生物體中發現的 pH 值下,氨基很容易結合 H+ 成為 NH3+,從而從水溶液中去除 H+ 並提高 pH 值。
在有機反應中合成新的碳-碳鍵是一項重要的有機合成技術,它導致了人工化學品的生產,例如新藥和塑膠。 在羰基化學中,許多合成技術基於生物系統中形成碳-碳鍵的自然過程。 形成新的碳-碳鍵的有機反應的一些例子包括醛醇縮合反應、克萊森縮合反應、狄爾斯-阿爾德反應和邁克爾反應。

醛醇縮合反應是一種在有機化學中形成新的碳-碳鍵的強大技術,因為它將兩個簡單的分子聯合成一個複雜的分子。 該反應將兩個羰基化合物結合在一起,形成一個新的 β-羥基羰基化合物。 這種反應的產物被稱為醛醇,被稱為醛 + 醇的產物。 典型的醛醇縮合反應涉及酮烯醇負離子對醛的親核加成。 當醛醇產物失去一個水分子形成 α,β-不飽和羰基化合物時,就會發生醛醇縮合反應。 可用於醛醇縮合反應的親核試劑包括酮、醛和其他帶有羰基官能團的化合物的烯醇、烯醇負離子以及烯醇醚,而親電試劑通常是醛或酮。 當使用不同的親核試劑和親電試劑時,該反應被稱為交叉醛醇縮合反應。 另一方面,使用相同的親核試劑和親電試劑的反應被稱為醛醇二聚化。

克萊森縮合反應發生在兩個酯或一個酯和另一個羰基化合物之間,在強鹼的存在下,生成 β-酮酯或 β-二酮。 在克萊森縮合反應中,酯烯醇負離子對羰基的進攻會生成一個新的碳-碳鍵。 該反應機理包括透過用具有酯官能團的試劑與乙酸乙酯反應生成酯烯醇負離子,另一個酯分子的親核加成產生酮酯,烷氧基的消除,最後是酮酯的去質子化,然後在水性後處理中質子化。 整個過程是吸熱的,去質子化酮酯之前的步驟都是可逆的。 酮酯的去質子化驅動平衡,因為它去除了催化先前步驟所需的鹼。 為了防止酯交換,烷氧基和酯通常都衍生自相同的醇。

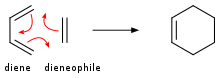
在狄爾斯-阿爾德反應中,共軛二烯與取代的烯烴加成,生成取代的環己烷衍生物。 這種反應是π體系之間環加成反應的特例;包含四個π電子的四個共軛原子與包含兩個π電子的雙鍵反應。 四碳組分稱為二烯,新增的烯烴稱為親二烯體。 該反應也稱為 [4+2] 環加成反應。 這種型別的反應仍然可以在新形成的環中沒有碳的情況下進行。 可逆的狄爾斯-阿爾德反應稱為逆狄爾斯-阿爾德反應;例如,環狀體系的分解反應。
邁克爾反應是碳負離子或其他親核試劑對α,β-不飽和羰基化合物的親核加成。 由β-二羰基化合物與α,β-不飽和羰基化合物衍生的穩定負離子會導致 1,4-加成。 它是用於溫和形成新的碳-碳鍵的最有用的方法之一。 邁克爾加成反應是鹼催化的,適用於 α,β-不飽和酮、醛和其他羧酸衍生物;它們被稱為邁克爾受體。 邁克爾供體是親核試劑上的吸電子基團,如醯基和氰基。 [Vollhardt] [1]

有機分子也存在異構體。 異構體是具有相同原子數和相同原子型別的分子。 但是,它們的鍵合方式不同。 異構體的型別包括結構異構體(或結構異構體)和立體異構體。
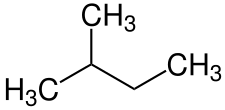
結構異構體(結構異構體)是指具有相同分子式但原子排列和連線方式不同的化合物。 鏈狀異構體、位置異構體和官能團異構體都是結構異構體。
鏈狀異構體
例如:戊烷和 2-甲基丁烷
位置異構體
例如:3-己酮和 2-己酮
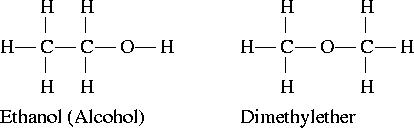
官能團異構體
例如:乙醇和二甲醚
立體異構體包括構象異構體和構型異構體。 構象異構體是指具有相同分子式和原子連線性但圍繞鍵旋轉不同的化合物。 換句話說,構象異構體可以透過圍繞單鍵的旋轉相互轉化。 它們在室溫下無法分離。 存在不同型別的構象異構體。 它們是重疊、交叉、反式和鄰位構象。 構型異構體是指只能透過斷裂鍵才能相互轉化的異構體。 存在兩種不同型別的構型異構體。 它們是 enantiomers 和 diastereomers。 對映異構體是非對映體的映象。 非對映異構體是非對映體的非映象。
葡萄糖和果糖,儘管它們的化學式都是 C6H12O6,但原子排列方式不同,是結構異構體的典型例子。對映異構體則是立體異構體的一種。立體異構體是具有相同原子間鍵合方式,但在空間排列上不同的異構體。例如,對映異構體是彼此的映象。它們可以重疊(非手性)或不能重疊(手性),並且可能表現出 R(順時針)或 S(逆時針)構型。手性分子的每個映象與其對應物表現出不同的性質。判斷一個分子是否手性的一種方法是尋找和識別手性中心。碳的手性中心有四個不同的基團與之相連。它必須是 sp3 雜化的,並且呈四面體形狀。一個分子的手性中心也可以稱為立體中心。
富勒烯是有機分子,僅由碳原子組成。
有機合成是構建分子的科學。有機合成研究主要有兩個領域:探索性研究和目標導向型研究。這兩個領域的研究都需要創新、想象力和藝術創造力。
探索性研究涉及開發新的有機反應。該領域許多研究人員專注於最佳化已知反應。開發新的有機反應有很多因素,例如反應物、溶劑、溫度、pH 值等。該領域任何研究人員的主要目標是最大限度地提高目標產物的產率,最小化副反應/副產物,並且能夠可靠地用於各種起始原料。有機合成方法學方面的進步擴充套件了目標導向型研究中使用的工具和技術。
目標導向型研究涉及透過一系列有機反應開發有機分子。該領域的研究人員利用現有的反應和市售材料合成目標產物。“目標”分子可以是天然產物或設計分子。對於簡單的分子,線性合成(一個接一個地進行的線性反應系列)就足夠了。對於複雜的分子結構,採用其他方法,例如收斂合成(關鍵中間體的獨立合成)。固相合成等方法在蛋白質合成中非常有用。
“目標”分子是生物學上、醫藥上或理論上有趣的產品。生物有機合成領域始於 1828 年弗里德里希·維勒合成尿素。天然產物合成曾多次獲得諾貝爾化學獎。目標導向型天然產物對醫學研究非常有用。在多種天然產物中,包括海洋天然產物中,都發現了抑制癌症的分子。
新的反應不斷被開發和最佳化。許多反應在藥物和生物標誌物的合成中特別有用。鈀交叉偶聯反應等反應,該反應獲得了 2010 年諾貝爾化學獎,在藥物、生物標誌物和其他有用分子的合成中非常有用。
最簡單的鈴木偶聯反應涉及苯硼酸和溴苯的鈀交叉偶聯反應,生成聯苯。
在過去幾十年中,偏離傳統合成方法帶來了分子構建技術替代方法的巨大進步。固相合成是一種創新技術的例子,該方法將分子構建單元連線到珠子上,並透過一系列線性反應物溶液獲得“目標”分子。與傳統的溶劑型合成相比,固相合成有幾個優點。一些優點是功能基團可以很容易地被保護,而且更容易從目標“目標”分子中提取不需要的副產物或反應物。固相合成在肽、脫氧核糖核酸 (DNA) 和其他基於序列的分子合成中非常有用。
“有機合成中充滿了興奮、冒險和挑戰,而且它可以成為偉大的藝術”——R.B.伍德沃德(1965 年諾貝爾獎獲得者)
在肽合成中使用偶聯劑是活化一個氨基酸的羰基碳的一種方式,從而使其對相鄰氨基酸的胺基更具反應性。二環己基碳二亞胺和各種脲鹽在該領域中主要用作偶聯劑 [1]。雖然使用偶聯劑並不是一項艱鉅的任務,但構建一個內在活化的氨基酸將繞過這些試劑的使用,從而節省時間、金錢和反應產率。
本文將描述獲得活化氨基酸的一般合成方法。特定異腈與任意醛反應生成 α-羥基吲哚類物質 [2]。

將該物質上的羥基轉化為氨基將生成活化的氨基酸。請注意,吲哚功能是芳香穩定的,作為一個很好的離去基團,從而活化羰基碳。重要的是,轉化後的胺功能需要被保護,以防止單體之間的交叉反應。完成這項任務並不容易,因為許多化學合成需要極端條件,不適合肽合成。高溫或 pH 值波動很容易破壞肽鍵,導致目標肽被破壞。因此,人們希望在進行這種置換時使用溫和的條件。[2] [Gianneschi]
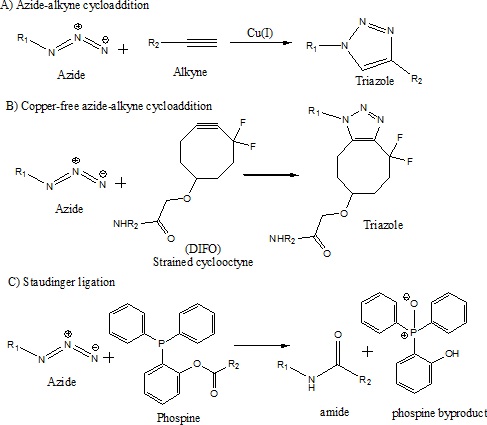
能夠以高選擇性生成分子修飾對於化學和生物體系的研究非常寶貴。點選化學是化學哲學,它利用 Sharpless、Finn 和 Kolb 在 2001 年開發的一組高效反應合成分子。點選化學發展的靈感來自於大自然往往從較小的亞基產生物質的想法。點選化學背後的邏輯是用小分子單元結合在一起,用反應快速生成產物,這些反應在環境條件下以高產率進行。這些反應需要具有很高的熱力學驅動力,並且與生物分子中可能存在的其他官能團正交。點選化學反應對標記生物分子很有效。它們還在生物條件下以高產率進行。反應的一個重要方面是它們是生物正交的,這意味著它們不會與生物體系中的官能團發生反應。點選化學反應的一些例子是(a)疊氮化物-炔烴環加成、(b)無銅疊氮化物-炔烴環加成和(c)斯陶丁格連線,如下面的方案所示。
點選合成的主要目標是簡化分子合成方法,從而改善識別和合成具有生物學重要性的分子的過程。這些方法已被證明對現代藥物開發有利;對原位片段基礎藥物設計特別有用。透過點選化學進行原位藥物開發已擴充套件到選擇性生成強效的碳酸酐酶和 HIV-1 蛋白酶抑制劑。下面顯示了利用點選化學進行抑制劑開發過程的示意圖。
這些技術在組合藥物開發中非常有用。疊氮化物-炔烴環加成的產物三唑在藥物設計中是很有利的,因為它具有多種有用的性質。這些反應高度調節的性質,具有高產率、選擇性以及能夠在溫和(生物)環境中進行轉化,使得產物能夠直接分析其活性,而無需純化(這是一個重要的捷徑!)。下面顯示了點選化學產物與 α-1,3-巖藻糖基轉移酶 (fuc-T) 直接篩選的例子。
點選化學設計包括與生物分子反應相反的反應。這對於選擇性地標記分子以在生物體系中檢測非常有用。斯陶丁格連線和疊氮化物-炔烴環加成已被證明對以前非常具有挑戰性的任務非常有用。
有廣泛的應用範圍,下面簡要描述和示例示意圖:
(1) 將帶有反應性標籤的非天然氨基酸引入蛋白質。
(2) 標記病毒表面。
(3) 透過翻譯後修飾將標記探針摻入蛋白質。
(4) 標記核苷酸以成像 DNA 和 RNA。
(5) 脂質探針的衍生化。
(6) 基於活性的蛋白質譜分析。
從化學生物學中的廣泛應用可以清楚地看出這些方法的優勢。這些反應的範圍相當廣泛,使用這些方法的研究人員的創新發揮了其最大潛力。這些方法也擴充套件到純有機化學實驗室。在沒有生物環境的限制的情況下,這些反應在精確控制目標結構方面具有明顯的優點。生物正交化學的進展(已經並)繼續為未來的研究提供新的有效工具。[最佳]
維勒合成是合成反應的一個例子,在該反應中,分子被製造出來。在這個反應中,碳化合物,有機產物,是由無機鹽製成的。
Pb(OCN)2 + 2 H2O + 2 NH3 -----> 2 H2N(C=O)NH2 + Pb(OH)2
氰酸鉛 水 氨 尿素 氫氧化鉛
正常人的胃每天大約含有 0.02 M 的 HCl。如果胃中 HCl 增加,胃液的 pH 值會從 2.5 降至 1.0。HCl 會破壞食物中蛋白質分子的正常摺疊形狀。結果,酸會破壞胃中的許多消化酶。因此,為了保護自身免受這種酸增加的影響,胃中的細胞必須共同努力來防止這種情況發生。首先,胃組織由蛋白質分子構成,內部覆蓋著胃粘膜層。當聞到和嚐到等刺激啟用胃粘膜中的細胞時,訊號分子組胺會使壁細胞隱藏胃中的酸性汁液。結果,胃中酸性汁液的產生會增加。為了防止這種情況發生,西咪替丁、法莫替丁和雷尼替丁等活性成分透過阻斷組胺幫助壁細胞,從而幫助減少酸。 [2]
http://en.wikipedia.org/wiki/Claisen_condensation
http://en.wikipedia.org/wiki/Aldol_reaction
http://en.wikipedia.org/wiki/Claisen_condensation
http://en.wikipedia.org/wiki/Diels%E2%80%93Alder_reaction
http://en.wikipedia.org/wiki/Michael_reaction
Vollhardt and Schore. Organic Chemistry. 第 6 版。紐約:W.H. Freeman and Company
http://en.wikipedia.org/wiki/Carbon%E2%80%93carbon_bond
http://en.wikipedia.org/wiki/Peptide_synthesis
Gianneschi, C. N., Rubinshtein, M., James, R.C., Kobayashi, Y., Yang, J., Young, J., Yanyan, J.M. Org. Lett., 2010, 12 (15), pp 3560–3563
Best, M.D. Biochemistry, 2009, 48 (6571), pp 6571–6584
- ↑ Vollhardt,Peter 和 Schore,Neil。(2009)。有機化學第 9 版。W.H. Freeman and Company。 ISBN 978-1-4292-0494-1。
- ↑ Vollhardt,Peter 和 Schore,Neil。(2009)。有機化學第 9 版。W.H. Freeman and Company。 ISBN 978-1-4292-0494-1。