結構生物化學/有機化學/鑑定方法

薄層色譜 (TLC) 有助於確定混合物中化合物的組成,以及區分兩種化合物。在 TLC 中,塗有薄層吸附劑的玻璃、金屬或塑膠板充當固定相,純溶劑或混合溶劑充當流動相。大多數非揮發性固體有機化合物都可以透過 TLC 進行分析。要進行 TLC 實驗,將少量待分離的混合物溶解在合適的溶劑中,並將其點在 TLC 板一端附近。然後將板放置在一個封閉的室中,最靠近點跡的邊緣浸入一層稱為展開劑的流動相中。然後讓溶劑透過毛細作用上升到固定相中。隨著溶劑上升到板中,樣品在流動相和固定相之間分配,由於兩相之間以及待分離化合物之間的極性不同而分離。化合物極性越強,與吸附劑結合越緊密,在 TLC 板上移動越慢。展開劑使非極性物質最迅速地向上移動到板上,而極性物質向上移動得更慢。當溶劑前沿距頂部約 1 釐米時,取出 TLC 板並標記其位置。Rf(保留前沿或相對於前沿的比例)可以根據化合物相對於基線移動到板上的距離計算得出。Rf = 化合物移動距離 / 溶劑前沿移動距離。該值的範圍可以從 0 到 1。Rf 為 0.2 通常是理想的。但是,可以透過改變流動相中使用的溶劑的極性來調整該值。然後在通風櫥中乾燥板,並使用視覺化方法來分析板。
為了更好地理解此過程背後的基本原理,將薄層色譜放大到我們經常看到的物體尺寸會有所幫助。
想象一下
固定相是海灘
流動相是拍打海岸然後返回海洋的波浪。
化合物是不同質量的人
最初,兩個不同質量的人坐在海灘上的同一個位置。當波浪拍打到他們的位置時,它會將體重較輕的人拉到海里。隨著時間的推移,由於對沙子的吸引力不同,體重較輕的人會與體重較重的人拉開距離。他們從初始位置移動的距離是不同的,可以作為這兩個人的特徵和分離因素。儘管在薄層色譜中,流動相在一個方向上移動,化合物不一定按質量不同,而是按其對固定相和流動相的親和力差異不同,但這個例子有助於理解這個重要過程的基本概念,用於識別和分離混合化合物。
固定相結合的固體載體可以由玻璃、塑膠或鋁板製成。用於製造固定相的最常見化合物是矽膠。由於它具有多孔性,因此具有很大的表面積,這有助於與化合物進行理想的廣泛相互作用。固定相必須結合到所選的固體載體上。這可以透過將矽膠與有助於矽膠顆粒粘附到固體載體的化合物混合來實現。然後將製備好的混合物塗抹到固體載體上並使其乾燥。
有兩種簡單而基本的視覺化方法,即熒光和碘視覺化。熒光涉及使用含有熒光指示劑的吸附劑。然後,在暗箱中使用短波長紫外燈照射板的吸附劑側時,檢測出不溶性無機指示劑。分離的化合物在熒光場中顯示為深色斑點,因為形成斑點的物質通常會淬滅吸附劑的熒光。這些斑點隨後可以進行分析。另一種視覺化無色有機化合物的方法是使用它們對碘蒸汽的吸附。這是透過將板放置在碘蒸汽浴中來實現的。物質與碘蒸汽的反應逐漸產生彩色斑點。斑點在白色到棕褐色的背景上呈深棕色。10-15 分鐘後,可以取出板,並用鉛筆勾勒出斑點,因為斑點經常在以後分析之前消失。
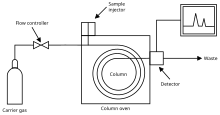
氣相色譜 (GC) 可以快速評估化合物的純度,但不能僅憑自身識別化合物,除非有已知相同化合物可用作標準。透過比較保留時間、峰值增強和色譜圖,可以確定混合物組分的身份。GC 對混合物組分的定量分析非常有用,因為色譜圖上相對峰面積的比較通常可以很好地近似每種化合物之間的相對含量。
氣相色譜的工作原理本質上是讓兩個相彼此作用。流動相,換句話說,是“移動相”,由惰性氣體(如氦氣)或非反應性氣體(如氮氣)來實現。固定相是液體或聚合物的微觀層,它被支撐在放置在稱為柱子的玻璃管內的惰性固體上。混合物中待分析的氣態化合物與塗有固定相的柱壁相互作用。由於各種化合物在固定相中顯示出不同的極性和親和力,因此根據化合物在固定相中結合的時間來計算保留時間,而流動相向上移動到固定相中。各種化合物不斷地與固定相和流動相結合,並透過它們與固定相之間相互作用強度的差異來分離。保留時間的比較顯示了氣相色譜儀的效率和應用。
紅外光譜是**有機化學**中最實用的光譜技術之一,因為它是一種快速有效的方法,能夠識別化合物中是否存在簡單官能團。當紅外能量透過樣品時,會觀察到吸收帶,這些吸收帶與化學鍵型別相關聯,可以提供有關樣品中官能團性質的重要資訊。紅外光譜以吸收強度的函式繪製能量(以頻率或波長表示)。這是分子振動的結果。組成分子的原子處於不斷運動中,原子相對於彼此的運動可以被描述為振動。被有機化合物吸收的紅外輻射光子具有恰好足以拉伸或彎曲其共價鍵的能量。由於這種振動,紅外光譜中出現吸收帶。這些帶受到化合物不同振動模式、極性和鍵級的影響。在四面體碳中,存在不同型別的振動模式。它們分別是伸縮、彎曲、剪刀式、搖擺、扭轉和擺動。對於伸縮,它可以是對稱的或非對稱的。
非對稱伸縮
對稱伸縮
彎曲
剪刀式
扭轉
擺動
**紅外光譜形成原理** 中紅外區域為有機化學家提供了最多的資訊。該區域從 4000 cm-1 到 600 cm-1。大多數有機分子簡單官能團的吸收出現在該區域。紅外光譜以官能團的波數(頻率的倒數)為橫座標,以吸收強度為縱座標。透過在紅外光譜儀中執行感興趣的樣品來實現這一點,當識別出某個官能團時,光譜上會出現一個峰。波數對應於官能團吸收能量的頻率,強度衡量官能團吸收的強弱。由於構成分子的原子處於不斷運動中,因此它們被稱為“振動”。當這些基團從它們遇到的光子中吸收恰當的能量時,分子將獲得足夠的能量來拉伸或彎曲它們的共價鍵。拉伸和彎曲是兩種不同的振動型別。分子的分子振動能級是量子化的,這意味著振動只有在紅外能量與分子振動頻率完全匹配時才會發生。如果能量不匹配,則不會發生吸收。因此,如果不存在官能團,紅外光譜上就不會出現吸收峰,這使得紅外光譜成為識別分子中官能團的非常強大的工具。此外,鍵級可以提供有關某些峰在紅外光譜中出現位置的額外資訊。鍵級是指兩個分子之間發生的鍵合量。從烷烴到烯烴再到炔烴,碳原子之間的鍵級增加。鍵級隨著兩個成鍵原子之間鍵的數量增加而增加。原子鍵級越高,分子吸收的波數越高,產生伸縮振動所需的能量也越大。原子質量也提供有關某些分子在紅外光譜中吸收位置的資訊。振動原子的原子質量越大,頻率越高,拉伸分子鍵所需的能量也越大。
**識別紅外光譜上的官能團** 透過使用紅外光譜儀進行的許多實驗,科學家們已經找到了某些官能團和鍵的伸縮發生的區域。下表顯示了這些區域。
| 鍵或官能團 | 波數 (cm−1) |
|---|---|
| RO — H (醇) | 3200 - 3650 |
| RC(=O)O — H (羧酸) | 2500 - 3300 |
| R2N — H (胺) | 3250 - 3500 |
| RC=C — H (炔烴) | 3260 - 3330 |
| C=C — H (烷烴) | 2840 - 3000 |
| C—H (烷烴) | 2840 - 3000 |
| RC=CH (炔烴) | 2100–2260 |
| RC=CN (腈) | 2220–2260 |
| RC(C=O)H (醛, RC(C=O)R’ (酮) |
1690–1750 |
| RC(C=O)OR’ (酯) | 1735–1750 |
| RC(C=O)OH (羧酸) | 1710–1760 |
| -C=C- (烯烴) | 1620–1680 |
| RC — OR’ (酯,醇) | 1000–1260 |
每個官能團可以吸收的波數有三個不同的區域:官能團區域、指紋區域和芳香區域。官能團區域在 4000 – 1500 cm-1 之間,大多數主要官能團的峰出現在該區域。指紋區域在 1500 – 900 cm-1 之間,許多彎曲振動出現在該區域。它不像官能團區域那麼重要,但如果您不確定,它會為您提供一個區域來確認某個鍵的存在。最後一個區域在 900 – 600 cm-1 之間,提供有關芳香族化合物(如苯)存在的資訊。
僅靠紅外光譜不足以確定分子的結構。它必須與核磁共振光譜相結合才能產生用於結構識別的資訊。
以下是某些官能團存在時的一些紅外光譜。
醇的紅外光譜
(3200 – 3400 之間的大寬峰)
羰基的紅外光譜
(大約 1700 處的強峰)
核磁共振
[edit | edit source]核磁共振是**有機化學**和**生物化學**中最重要分析工具之一。與其他蛋白質測定技術相比,核磁共振具有優勢,因為它可以分析溶液中大分子結構。其他技術(如 X 射線晶體學)需要大分子結晶。核磁共振在顯示蛋白質結構的動態方面也非常有用,揭示了有關構象變化、摺疊和與其他蛋白質相互作用的細節。核磁共振技術使用無線電頻率範圍內的低能輻射。輻射激發原子核,但只有某些特定同位素被激發;最常見的是 1H 和 13C。這些原子核可以被模擬為繞一個軸旋轉,這種性質被稱為核自旋。由於氫本質上是一個質子,它的自旋運動會產生磁場。就所有實際目的而言,可以想象氫與漂浮在空間中的磁鐵是同義詞。
當這些原子核被外部磁場激發時,它們可以具有兩種取向之一,α 自旋態或 β 自旋態。這些核,1H 和 13C,可以被視為可以與磁場對齊(α)或與磁場相反(β)的微小原子磁鐵。α 處於能量更有利的狀態,而 β 處於高能狀態。以恰好足以在 α 和 β 自旋態之間翻轉的頻率輻射樣品,就會產生共振;樣品吸收能量翻轉到 β 自旋態。激發後,原子核恢復到原始狀態,因此在共振時,原子核不斷切換自旋狀態。處於 β 狀態的原子核在弛豫到 α 狀態時釋放能量。發生這種情況的共振頻率與外部磁場的強度成正比。共振頻率因原子核而異,這取決於其原子核和環境的特性。
氫 (1H) 核磁共振
[edit | edit source]共振頻率在很大程度上取決於鍵的極性、連線原子的雜化和存在供電子或吸電子基團。當氫靠近吸電子基團(例如氯甲烷)時,氫被認為是去遮蔽的,因為鍵的極性將氫的電子雲拉離原子核。相反的情況被稱為遮蔽。這兩種現象導致不同的氫具有不同的共振頻率,因此具有不同的峰。當相應的原子核被遮蔽時,峰被稱為處於高場或向右移動,而當原子核被去遮蔽時,峰被稱為處於低場或向左移動。

從上面的 NMR 示例中,您可以看到遮蔽和去遮蔽如何影響峰值。“C” 基團氫位於最左側,因為它被羰基去遮蔽。“B” 基團氫由於芳香性而被去遮蔽程度略低,而“A” 基團氫幾乎沒有被去遮蔽。
1H 核磁共振是使用最多的核磁共振之一,因為 1H 具有核自旋。它是帶正電的。當它旋轉時,它會產生磁場。當新增外部磁場時,質子可以具有 *a* 或 *B* 自旋。這兩種狀態之間的能量差產生共振。不同的原子具有不同的施加磁場強度。(CH3)4Si 用作標準。原子頻率與 (CH3)4Si 頻率之間的距離稱為化學位移。
化學位移 = (峰與 (CH3)4Si 之間的距離,以赫茲為單位) / (光譜儀頻率,以兆赫為單位)ppm
以下是一些常用化學位移的示例
伯烷基:0.8-1.0 ppm
仲烷基:1.2-1.4 ppm
叔烷基:1.4-1.7 ppm
末端烯烴:4.6-5.0ppm
內烯烴:5.2-5.7ppm
炔烴:1.7-3.1ppm
醇:0.5-5.0 ppm
芳香:6.0-9.5ppm
需要注意的是,醇的 OH 官能團、硫醇的 SH 官能團和胺的 NH2 基團的核磁共振光譜具有典型的寬峰。
處於不同化學環境中的氫原子(意味著它們連線了不同的原子,因此具有不同的鍵強度和鍵長,從而改變了電子在周圍的“聚集”方式)會產生不同的化學位移。電子貧乏的環境被稱為去遮蔽,併產生低場吸收(在光譜中更靠左)。相反,電子富集的環境被稱為遮蔽,並導致高場峰(更靠右)。等效氫原子會產生相同的訊號。如果化合物具有相同的連線性和鍵強度/鍵長,則它們具有相同的環境。例如,苯分子有 6 個不同的氫原子,但它們都處於相同的環境中。
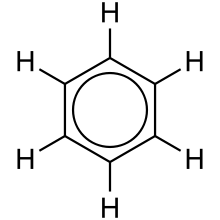
瞭解如何區分氫原子的等效性對於解讀 1H NMR 非常重要。這可能很容易識別,例如感興趣的原子核(此處為氫)周圍原子的電負性,但變化可能更為細微,例如分子中的對稱性使某些氫原子等效。為此,將展示苯酚分子。

雖然羥基確實改變了氫原子的遮蔽程度,但只有三種不同的氫原子。直接連線到 OH 基團的氫原子在連線性方面相似,但在對稱性方面也相似。對稱軸使它們相似,因為自然界不知道左右。連線到同一碳原子的氫原子通常具有相同的位移,但並非所有情況下都是如此。如果無法評估對稱性,則氫原子完全不同。除此之外,1H NMR 還提供另一個提示,幫助我們推斷化合物的結構,即積分。透過比較峰下方的相對面積,可以確定氫原子的比例。我們可以透過觀察積分來找到氫原子的相對數量。此外,透過觀察分裂,我們可以找到相鄰的氫原子。氫原子之間的相互作用會干擾它們的磁場,從而影響其峰的形狀。一個尖銳的峰稱為單峰;一對峰中的一個稱為雙峰;一組三個峰中的一個稱為三重峰;一組四個峰中的一個稱為四重峰等等。它遵循 **n + 1 規則**。例如,如果我們看到一個峰,則沒有氫原子連線到與連線到氫原子的原子相鄰的原子。如果我們看到一個雙峰,則意味著連線到此氫原子或這些等效氫原子的碳原子的相鄰原子連線了一個氫原子,因為氫原子影響了峰。
碳 (13C) NMR
[edit | edit source]碳與 1H NMR 有著相同的原理,但 12C 對 NMR 沒有反應,因此含量較少的 13C 將在 NMR 光譜中顯示出來。分子中存在的碳原子中只有大約 1% 是 13C,因此峰的強度不如 1H。這種缺乏丰度至關重要,因為現在碳原子不受相鄰碳原子影響,因為兩個 13C 原子相互相鄰的可能性非常小。這實際上非常有用,因為如果 13C 含量更多,不僅 13C NMR 會受到干擾,而且 1H NMR 也將受到干擾,這將使 NMR 光譜複雜化。唯一改變峰的因素是相鄰的氫原子。與 1H 相同的原理適用於單峰、雙峰、三重峰等。

混合熔點
[edit | edit source]可以使用混合熔點法確定未知晶體的成分。混合熔點法涉及混合等量的未知晶體和另一種已知熔點的化合物。首先,確定未知晶體的熔點;然後,可以使用熔點最接近未知晶體的已知化合物進行混合熔點。等量未知物和已知物的混合物將用刮刀一起研磨,並插入毛細管中。然後,將混合物插入熔點測定儀中,以確定其熔點。在這種情況下,未知物充當已知化合物的雜質。雜質通常會降低已知晶體的熔點。當混合兩種不同的晶體時,會觀察到不同的熔點,因為混合兩種不同的化合物會破壞晶體的晶格結構,從而影響其熔點等物理性質。一種化合物充當另一種化合物的雜質,降低其熔點。如果這種混合物的熔點與已知物的熔點相同,則該混合物由兩種相同的化合物組成,這意味著未知物和已知物具有相同的成分,因為相同的化合物不能充當自身的雜質。
示例:如果確定未知化合物(可能不是純化合物)的熔點為 110°C,現在選擇熔點最接近未知物的已知化合物。在本例中,將選擇芴,並與未知物進行混合熔點。已知化合物及其熔點(攝氏度)安息香 – 95 芴-114 9 芴酮-84 未知物+ 芴- 112°C
以防萬一,使用另一種已知化合物(熔點與未知物最接近的第二種化合物)與未知物進行混合熔點,即安息香。快速混合熔點表明,兩種化合物的混合物熔點根本不在 110s°C 範圍內,這排除了安息香作為未知物的可能性。因此,本例中的未知化合物被確定為芴,因為混合物的熔點與未知物的熔點幾乎相同。熔點對於確定化合物的純度也至關重要。例如,如果已知化合物是純的,則該已知化合物的熔點可作為測量純度的標準。透過將這種純化合物的熔點與相同成分的樣品化合物的熔點進行比較,可以確定樣品化合物的純度。樣品熔點越接近純化合物的熔點,樣品就越純。這是因為樣品越純,雜質就越少。正如我們之前所討論的那樣,化合物中存在的雜質越多,其熔點就會降低。因此,具有最高熔點的相同化合物也是最純的。
熔點測定使用熔點測定儀進行。將化合物裝入一端封閉的熔點毛細管中。通常需要輕敲幾下才能使化合物到達管子的底部。將管子裝入熔點測定儀後,逐漸施加熱量,化合物將開始熔化。實驗者可以透過顯微鏡觀察化合物來跟蹤熔化的過程。熔點測定儀提供了一種簡單快速的方法來確定樣品的純度和成分! [1]
參考文獻
[edit | edit source]Mohrig, Jerry R. 有機化學技術。 2006 年,W.H. Freeman 和公司
有機化學實驗室,化學 143A
Shore Vollhardt. 有機化學,結構與功能,第 5 版。W.H. Freeman 和公司。紐約。
Ternansky, Robert. “實驗 4a-b” CHEM 143A 講座。加州大學聖地亞哥分校,拉荷亞。2012 年 2 月 3 日。講座。







