結構生物化學/有機化學/有機合成
有機合成是有機化學中研究從其他可用化合物合成化合物的部分。有許多不同的方法來製造物質,合成研究了這些方法。有四種非常基本的反應用法可以幫助瞭解合成包括什麼:SN1(單分子親核取代)、SN2(雙分子親核取代)、E1(單分子消除)和E2(雙分子消除)。
顧名思義,SN2反應涉及用其他基團取代某些基團。進來的基團和離開的基團需要具有一定的特性才能使反應發生,例如,如果離開基團無法離開或是不想離開的基團,反應就不會發生。進來的基團被稱為親核試劑。親核試劑具有可以捐贈給某些缺乏電子密度的原子的電子,這種原子被稱為親電試劑。在取代反應中,親電試劑具有與離開基團相連的基團。為了被認為是好的親核試劑,該基團需要具有大量的電子密度,通常帶負電荷,並且不能平衡這些額外的電子。分子可以通過幾種方式平衡其電子密度。三種方法是:共振、原子半徑、感應效應。其中,共振是最重要的因素,儘管原子半徑也起著重要作用。感應效應可能很重要,但它是一種平衡力,其效力會迅速減弱。共振是指分子在兩種不同狀態之間振盪的現象,通常透過雙鍵的移動來實現。這使得電荷在分子中移動。這種電荷的移動是一種過於簡化的觀察方式。實際上,分子以所有不同共振形式的混合狀態存在。這種混合狀態實際上將電子密度擴散到整個分子中。


原子半徑在穩定電荷方面起作用。例如,所有鹵素都有-1的離子形式。電荷對所有鹵素來說都是一樣的。變化的是原子半徑。較大的半徑意味著電子密度可以更多地分散,從而更好地平衡電荷。

感應效應是電負性原子將電子密度拉向自己的能力,並能以這種方式穩定電荷。然而,這種力隨著電負性原子離電荷越遠而迅速減弱。
可以捐贈電子的分子被稱為路易斯鹼,事實上大多數親核試劑都是鹼性的,儘管好的鹼不一定就是好的親核試劑。能夠承受負電荷的分子(透過上述方法)可能是一個好的離去基團。
在溴甲烷分子中,離去基團是溴基團,親電試劑是碳。這個溴基團具有很強的吸電子性,並且由於它具有很大的原子半徑,因此可以消散電荷,這種現象被稱為極化率。典型的SN2反應涉及溴甲烷和NaOH
反應發生後,新產物的立體化學將與之前完全相反。例如,如果它是與溴反應的(R)-碘丙烷,它將變成(S)-溴丙烷。立體異構中心發生反轉的原因是親核試劑在Sn2反應中進行背面進攻。


提高反應速率的方法
1. 增加親核試劑或底物的濃度將提高反應速率。這是因為這是一個雙分子反應,其中速率=k[親核試劑][底物]:速率取決於親核試劑和底物的濃度。增加親核試劑的濃度將提高速率,因為速率與親核試劑的濃度和底物的濃度成正比。底物也是如此。
2. 使用好的離去基團。
3. 提高體系溫度。
4. 任何不會對親核試劑造成空間位阻的東西都會提高反應速率。
5. 使用極性非質子溶劑,這意味著溶劑不含酸性質子。
SN2反應中2的原因是離去基團和親核試劑都在反應的速率方程中。這意味著溴甲烷和NaOH的濃度都會影響反應速率。這是因為反應一步完成,只有一箇中間體,其中離去基團-親電試劑鍵斷裂,親核試劑-親電試劑鍵形成。在SN1反應中,有兩步,兩個中間體。第一步是形成碳正離子,其中離去基團離開,碳帶上正電荷。第二步是形成親核試劑-親電試劑相互作用。在這兩步中,第一步是最慢的,稱為速率決定步驟。這意味著無論親核試劑有多少,反應速率都不會改變,直到底物的濃度發生變化。第一步非常慢,因為形成碳正離子不是非常有利的。要做到這一點,唯一的方法是離去基團必須非常優秀,並且必須有一種方法來穩定碳正離子。第一個很簡單,找到一個具有非常好的離去基團的分子。透過使碳正離子成為仲碳正離子或叔碳正離子,電荷得到了更好的穩定。這是透過共振或超共軛實現的。甲基中的電子與碳正離子相互作用,並使其得到一定程度的穩定。
親核試劑可以從底物的α面或β面進攻碳正離子。因此,通常會看到外消旋混合物,或者在生成的化合物中R和S構型的50:50混合物。
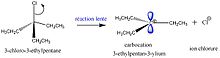
為了使慢速第一步發生,需要減慢快速第二步。要做到這一點,不要使用非常好的親核試劑。可以不使用氫氧化物離子,而使用其共軛酸水。

提高Sn1反應速率的方法
1. 提高Sn1反應速率的另一種方法是使用極性質子溶劑。極性質子溶劑將提高反應速率,因為它將有助於穩定離去基團。它將穩定離去基團,因為它將溶劑化電荷。任何有助於穩定離去基團的東西都將使其更有可能離開,因為它將進入更低的能量狀態。
2. 提高Sn1反應速率的另一種方法是新增鹽。鹽將透過離子相互作用來幫助穩定離去基團,並且由於離去基團將更加穩定,因此更有可能離開並形成碳正離子,速度快得多。
3. 提高Sn1反應速率的另一種方法是提高溶劑的極性。溶劑的極性將透過氫鍵來幫助穩定碳正離子。因此,如果要提高Sn1反應的反應速率,只需提高所用溶劑的極性。
4. 提高反應速率的另一種方法是提高體系溫度。
5. 使用極性質子溶劑,這意味著溶劑具有酸性氫。
β支化對反應速率的影響
β支化意味著在與離去基團相連的碳原子相鄰的碳原子上有一個碳鏈。對於SN2反應,β支化將由於空間位阻而減慢反應速度,因此烷基鹵化物中β支化越少,SN2反應速度越快。根據SN1反應的實驗結果,更多的β支化將由於空間位阻而減慢SN1反應速度,空間位阻會阻礙親核試劑對碳正離子的進攻。
環狀效應
實驗表明溴環戊烷反應速度非常快,而溴環己烷需要一定時間才能進行反應,這表明五元環比六元環反應更快。造成這種情況的原因是環張力,指的是環上非相鄰碳上的取代基之間的不利相互作用。環張力越小,SN1 和 SN2 反應速度越慢。五元環是這個規則的唯一例外,但一般來說,3、4、6 元環反應速度較慢,因為它們更穩定,能量更低。
芳香環效應
芳香環可以使伯滷代烷進行 SN1 反應,因為芳香環可以透過共振穩定碳正離子。芳香環的位置必須與離去基相隔一個碳原子,這樣電子才能發生共振並穩定碳正離子。供電子基團會增加電子密度,從而“活化”環,使其更容易受到親電進攻,從而提高反應速率,而吸電子基團會降低反應速率,因為它從芳香環中移除電子密度,如實驗所示,甲氧基苄基氯(供電子基團)反應,而硝基(吸電子基團)則根本沒有反應。
1. Vollhardt, K. Peter C., and Neil Eric Schore. Organic Chemistry: Structure and Function. New York: W.H. Freeman, 2011. Print.
