結構生物化學/有機化學/立體化學
立體化學:根據定義,立體化學是不同原子在空間中的排列方式。立體化學是 sp3 雜化的碳的 3D 表示。有許多不同型別的立體異構體。首先讓我們討論一些基本概念。
雖然大多數人習慣於將有機化學視為一堆圖紙和結構,但這種“紙面化學”並不真正反映這些分子在現實生活中的行為。當然,這些分子實際上是三維形狀,而不僅僅是二維圖紙。立體化學旨在解釋這些有機分子的空間排列的自然現象。

立體中心:分子中任何與 4 個不同原子相連的原子。也稱為手性中心。手性分子很特別,因為它與其映象影像不相同,或者換句話說,手性的唯一標準是物體與其映象影像必須是非可疊合的。 [1]例如,甲烷 (CH4) 與其映象影像相同;因此,該分子不是手性的。通常,具有“n”個手性中心的分子具有 2^n 個立體異構體。例如,具有 3 個立體中心的分子將產生具有 8 個立體異構體的分子。立體異構體是具有相同分子式和連通性,但空間原子排列不同的分子異構體。兩種立體異構體的原子以相同的順序連線在一起,但這兩個分子沒有相同的三維形狀。楔形表示指向觀察者的鍵,而虛線表示遠離觀察者的鍵。
被歸類為非手性的分子要麼不是 sp3 雜化的,要麼是 sp3 雜化的,但具有兩個或多個相同的取代基。這些分子不是手性的。非手性分子與其本身是可疊合的。

異構體是具有相同分子式,但結構彼此不同的分子。異構體主要分為兩類:結構異構體和立體異構體。結構異構體,也稱為結構異構體,是具有相同分子式,但連通性不同的分子。通常,結構異構體具有非常不同的物理和化學性質。立體異構體可以細分為兩個子類別:對映異構體和非對映異構體。對映異構體是彼此映象影像,且不可疊合的分子。這些分子具有相同的連通性,但在碳取代基的 3D 排列方面有所不同。通常,對映異構體具有非常相似的物理性質,但它們在化學性質上可能有所不同。非對映異構體不是映象影像,但與對映異構體一樣,具有相同的連通性,但在碳取代基的 3D 排列方面有所不同。
對映異構體是彼此映象影像,且不可疊合的結構。不可疊合意味著無論你以何種方式旋轉它,你都無法將它直接放在另一個與相同方向面對的頂部。你可以很容易地用你的手來證明這一點,因為你的手也是不可疊合的,因為你無法將你的手放在彼此的頂部,讓你的拇指朝向相同的方向,而你的手掌朝向相同的方向。對映異構體具有相同的物理和化學性質。

對映異構體通常用 R 或 S 結構進行分類。要確定立體中心是標記為 R 還是 S,首先必須根據分子量對它的四個取代基進行排序。最高優先順序取代基(等級 1)將是具有最大分子量的取代基原子;相反,最低優先順序取代基(等級 4)將是具有最小分子量的取代基原子。因此,氫取代基總是被賦予最低優先順序。一旦四個取代基按優先順序排序,就可以遵循一系列規則來確定立體中心的 R 或 S 結構。 [1]
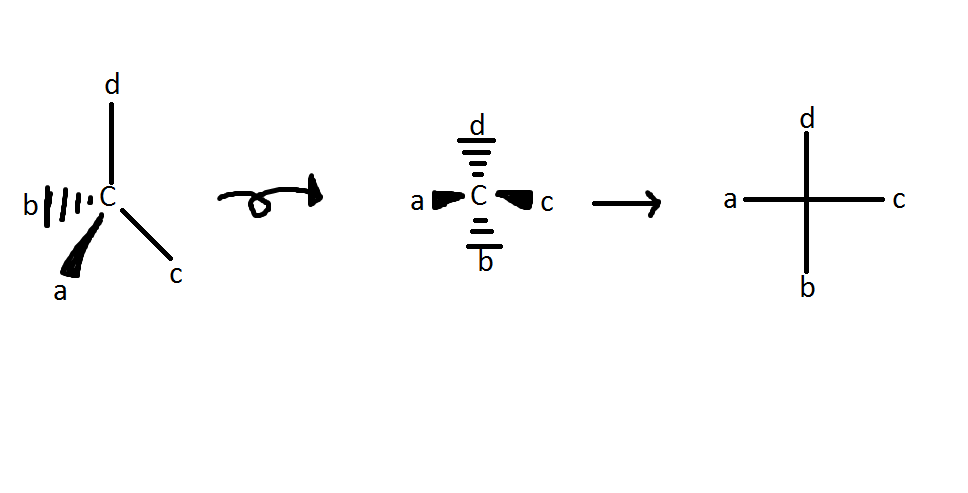
規則 1:最低優先順序取代基總是被放置在儘可能遠的地方,或者換句話說,被放置在紙張或板子中。
規則 2:一旦最低優先順序取代基(通常是氫)被放置在“紙張中”,剩下的三個取代基(R 和 S)只有兩種可能的排列方式。從最低優先順序取代基鍵向下看碳原子,如果剩下的三個取代基按順時針方向遞增(1、2、3),則立體中心被歸類為 R。如果三個取代基按逆時針方向遞增,則立體中心被歸類為 S。
規則 3:差別點規則。此規則有助於確定取代基的優先順序,這些取代基在檢視直接連線到立體中心的原子時具有相同的等級。一個簡單的例子是甲基和乙基取代基之間的區別。沿著取代基超越初始碳原子,甲基連線到三個氫原子,而乙基的碳連線到兩個氫原子和另一個碳原子。這是取代基的差別點。由於乙基中的碳原子比甲基中的第 3 個氫原子具有更高的優先順序,因此乙基取代基的優先順序高於甲基取代基。 [1]
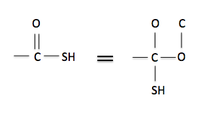
規則 4:雙鍵和三鍵可以被視為單鍵,但額外的鍵被新增到多鍵的每一端作為單鍵。這可以在右邊的圖上看到。碳連線到硫醇基團,並與氧形成雙鍵。這個雙鍵可以被視為碳連線到兩個單鍵氧原子,而第二個氧連線到碳原子(代表與初始碳的雙鍵)。
對映異構體具有旋光性,這意味著它們能夠旋轉平面偏振光。右旋 (+) 分子使平面偏振光按順時針方向旋轉,而左旋 (-) 分子使平面偏振光按逆時針方向旋轉。對映異構體在每個化合物旋轉平面偏振光的方向上有所不同。

從圖中可以看出,在左側,甲基指向我們,而羥基指向後。在右側的分子上,這個順序顛倒了。這是對映異構體的典型例子。
人們可能認為你可以簡單地旋轉分子,它們就會完全相同,但事實並非如此。如果你旋轉上面的分子,羥基和甲基會互相疊合,但是,氟和氫現在將位於相對側。這就是不可疊合的含義
通常,人們會對內消旋化合物感到困惑。例如,假設有兩個分子:一個分子以其立體中心的 1R,2S 結構為特徵(手性中心),另一個分子以其各自立體中心的 1S,2R 結構為特徵。人們可能想知道為什麼這些分子不是彼此的對映異構體——畢竟,它們在所有各自的立體中心處確實具有相反的結構。然而,這些分子不是對映異構體,因為它們是內消旋化合物。在這種情況下,每個化合物都有一條對稱線將它的兩個立體中心分開。由於每個分子都有對稱平面,因此每個化合物都被認為是非手性的(不是手性的)。
如果兩種分子由相同數量的每個對映異構體組成,即左旋對映異構體和右旋對映異構體的 50:50 比例,則它們被認為是外消旋的。
外消旋分子沒有顯示出旋轉平面偏振光。單獨地,每個對映異構體都會旋轉平面偏振光,但它們會以相等且相反的方向旋轉,從而導致淨旋轉為 0。
光學活性與化合物中兩種對映異構體的比例成正比。當化合物中兩種對映異構體的比例相等時,該樣品被認為是光學非活性或外消旋體。如果只存在一種對映異構體,則該樣品被認為是光學純的。為了描述介於這兩種極端之間的混合物,可以使用對映異構體過量 (ee) 關係。這用於當混合物中一種對映異構體比另一種對映異構體過量時。[1] 對映異構體過量方程為
對映異構體過量 (ee) = 主要對映異構體的百分比 - 次要對映異構體的百分比
對映異構體過量方程告訴我們,在一個外消旋溶液中,一種對映異構體比外消旋溶液多多少(因為在外消旋體中,對映異構體的比例是 1:1)。對映異構體過量也稱為光學純度,可以透過以下關係式求得
對映異構體過量 (ee) = 光學純度 = ([a]混合物/[a]純對映異構體) X 100%
示例
從文物中獲得的 (+)-丙氨酸溶液的值為 [a]混合物 = 3.7;[a]純對映異構體 = 8.5。求光學純度和樣品的實際對映異構體組成。[1]
解答
對映異構體過量 = 光學純度 = (3.7/8.5) X 100% = 43.5% 因此,樣品的 56.5% 是外消旋體,樣品的 43.5% 是純 (+) 異構體。因此,可以得出結論,所檢驗的文物中 (+) 和 (-) 丙氨酸的實際組成分別為 71.75% 和 28.25%。
光學活性
[edit | edit source]如果將手性分子的兩種對映異構體以純形式分離到兩個不同的容器中,則僅憑它們的物理性質,如沸點、熔點和密度,很難區分這兩種對映異構體。因為只有某些藥物的某些對映異構體有效,而其他對映異構體對人體無效甚至有害,所以能夠區分對映異構體非常重要。
幸運的是,手性分子具有一個獨特的性質,當一束稱為平面偏振光的特殊光透過包含對映異構體的樣品時,手性分子會以特定方向旋轉。手性分子與平面偏振光之間這種獨特的反應稱為光學活性,因此對映異構體通常被稱為光學異構體。從面對光源的觀察者的角度來看,特定手性分子的旋轉方向可以是順時針方向,即右旋性(“dexter”在拉丁語中意為“右”),或者逆時針方向,即左旋性(“laevus”在拉丁語中意為“左”)[2]。順時針旋轉的分子被稱為 (+) 對映異構體,而逆時針旋轉的分子被稱為 (-) 對映異構體 [2]。任何特定手性分子的旋轉方向始終相同,該手性分子的對映異構體將具有相反的旋轉方向。
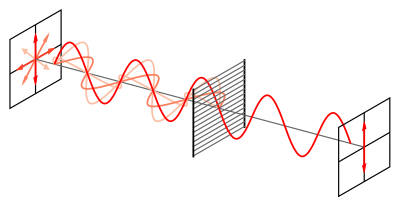
平面偏振光是由一束普通光透過一種稱為偏振器的特殊材料產生的。偏振器充當透過它的光波的過濾器,過濾掉除一種光波(平面偏振光波)以外的所有光波 [2]。光被過濾成僅平面偏振光後,光波穿過手性分子。光波的電場與手性分子周圍的電子相互作用,導致分子以特定方向旋轉;這種旋轉稱為光學旋轉 [2]。如果樣品中存在光學旋轉,則該樣品被稱為光學活性。為了確定樣品是否具有光學活性,必須使用旋光儀測量光學旋轉。
通常,產生手性分子的反應不是立體專一的,這可能導致產物具有 1:1 的對映異構體混合物。這種反應混合物被稱為外消旋混合物,因為當一束平面偏振光透過該樣品時,一半的手性分子會順時針旋轉,而另一半會逆時針旋轉。這會導致樣品沒有淨光學活性。然而,當對映異構體的比例不是 1:1 時,則會存在光學活性。製藥公司的主要目標之一是進行產生光學純產物的反應,因為這可以節省他們在光學不純樣品純化過程中花費的大量時間,更不用說生產過程中使用的試劑的成本了。
氨基酸的立體化學
[edit | edit source]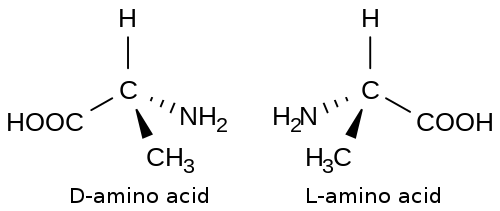
氨基酸是蛋白質的組成部分。氨基酸的一般結構具有一個 sp3 雜化的碳原子,連線到另外四個取代基。連線到所有氨基酸碳原子的四個取代基中的三個是氨基、羧基和氫原子。最後一個取代基通常用 R 表示,如果氨基酸沒有指定。R 可以代表二十種不同氨基酸所具有的二十種不同的側鏈。
氨基酸的立體化學用 L,D 體系表示。L,D 體系本質上與絕對構型的 R,S 體系相同,區別在於 L,D 體系用於氨基酸。對於 L,D 體系,L 等於 S 絕對構型,D 等於 R 絕對構型。
氨基酸主要以 L 絕對構型存在。目前沒有關於 L 異構體在 D 異構體上占主導地位的結論性證據。許多人推測,L 異構體成為占主導地位的氨基酸構型是由於偶然而非任何物理或化學性質。已經進行了一些實驗試圖闡明 L 異構體占主導地位的原因。在這些實驗中,用僅含 D 絕對構型的氨基酸人工合成蛋白質。結論是,僅由 D 氨基酸組成的蛋白質與由 L 氨基酸組成的蛋白質一樣具有活性,唯一的區別是,由 D 氨基酸組成的蛋白質的反應是與由 L 氨基酸組成的蛋白質相反的反應。
非對映異構體
[edit | edit source]非對映異構體是任何不是對映異構體的立體異構體。因此,非對映異構體不是彼此的映象。由於非對映異構體是彼此不是映象的立體異構體,因此它們可以透過不同的物理和化學性質來區分。因此,可以透過標準的實驗室技術分離非對映異構體。當分子的立體異構體在其至少一個立體中心(但不是全部,因為它們將是對映異構體)具有不同的構型時,就會出現非對映異構體。每個立體中心具有兩種構型,因此立體異構體的數量增加了兩倍。順反異構是一種非對映異構體形式(順式 - 兩個取代基指向相同方向;反式 - 兩個取代基指向相反方向)。
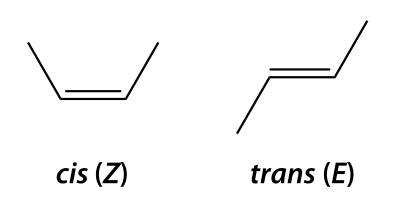

雖然對映異構體具有相同的化學性質,但非對映異構體則不同。
下面分子中含有 3 個立體中心。第一個和第三個碳原子上的原子已被交換。這是一個非對映異構體的例子。如果第二個碳原子也被交換,那麼這兩個分子將是對映異構體。
烯烴的立體化學
[edit | edit source]當使用 E,Z 體系命名烯烴時,順式和反式字首基本上不存在。E,Z 體系為碳取代基設定優先順序的方式與 R,S 體系相同,區別在於雙鍵對優先順序沒有影響,只有與碳單鍵連線的兩個取代基。E 異構體(E 來自德語單詞“entgegen”,意思是“相反”)是指雙鍵上每個碳的最高優先順序取代基彼此相反 [1]。Z 異構體(Z 來自德語單詞“zusammen”,意思是“一起”)是指雙鍵上每個碳的最高優先順序取代基在彼此的同一側 [2]。
差向異構體
[edit | edit source]差向異構體是隻在一個立體中心上不同的非對映異構體。
下面分子中含有 3 個立體中心。原子只在第三個碳原子(右側)的立體中心上被交換了。這是一個差向異構體的例子。
異頭物
[edit | edit source]"異頭物是在環閉合時形成的新不對稱碳原子上不同的異構體"。[2] α-D-葡萄糖和 β-D-葡萄糖(如下所示)就是這種情況。


費歇爾投影式
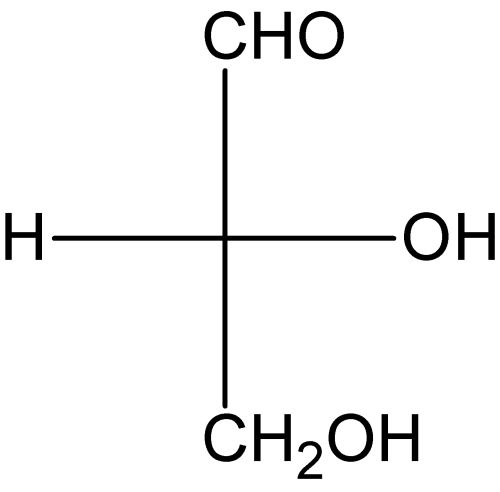
[edit | edit source]在費歇爾投影式中,連線取代基到中心碳的鍵用水平線和垂直線表示。類似於虛線-楔形線結構,水平線表示指向觀察者的鍵,而垂直線表示背離觀察者的鍵。這是一種簡化的方法,用於在二維空間中顯示四面體碳原子及其取代基。將虛線-楔形線結構轉換為費歇爾投影式是一個簡單的過程。下面給出了一個示例。
區分對映異構體和非對映異構體的一種簡單方法是觀察比較的分子,假設它們都是立體異構體,然後觀察每個手性中心。如果每個手性中心的碳取代基都被交換了一次,那麼這些分子是對映異構體。如果並非所有手性中心的碳取代基都被交換了一次,那麼這些分子是非對映異構體。在這種情況下,碳取代基的交換意味著,例如,同一個碳上的虛線 OH 取代基和楔形 H 取代基被交換為楔形 OH 取代基和虛線 H 取代基,而其他兩個碳取代基保持在相同的位置。根據這種邏輯,如果手性中心的碳取代基被交換了兩次,那麼這些分子是對映異構體,而不是非對映異構體。
如今,大多數手性藥物以外消旋混合物的形式出售。在兩種對映異構體中,其中一種是無活性的。根據 Vollhardt[3],另一個對映異構體會透過成為生物受體位點的阻斷劑來阻止另一個對映異構體的活性。因此,FDA 開始生產藥物的單個對映異構體。因此,他們開始測試純對映異構體,以幫助提高藥物的效能,並可能有助於延長藥物的專利。此外,他們應用了“手性轉換”方法來開發不同的對映選擇性合成方法。“手性轉換”是指在手性催化劑催化的反應中,將非手性反應物轉變為手性產物的過程。Vollhardt 指出,此類方法已應用於生產抗關節炎藥物、止痛藥萘普生和降壓藥心得安。
1. Schore, Neil E. (2011). 有機化學結構與功能 第 6 版. W. H. Freeman.
2. Berg, Jeremy Mark, John L. Tymoczko, 和 Lubert Stryer. 生物化學. 第 6 版. 紐約:W H Freeman & Co, 2012.
3. Schore, Neil E. (2007). 有機化學結構與功能 第 5 版. W. H. Freeman.
3. Berg, Jeremy M. (2002). 生物化學 第 5 版. W. H. Freeman.
4. Vollhardt, Peter 和 Schore, Neil. (2009). 有機化學 第 9 版. W.H. Freeman and Company. ISBN 978-1-4292-0494-1.