結構生物化學/蛋白質/核磁共振波譜
NMM 光譜法獨一無二,它能夠揭示溶液中大分子(只要能獲得高濃度溶液)的原子結構。這種技術依賴於某些原子核本身具有磁性。原子核的化學位移取決於它們區域性的環境。此外,相鄰原子核的自旋以提供確定性結構資訊的方式相互作用。這些資訊可用於確定蛋白質的完整三維結構。
核磁共振波譜(NMR)是一種分析技術,它利用了某些原子核具有稱為自旋(I)的性質這一事實。NMR 波譜法之所以成為可能,是因為塞曼效應,塞曼效應最早是在 19 世紀 90 年代發現的。透過首先製備同位素標記的樣品,可以透過 NMR 確定蛋白質的結構。在磁體中,樣品中原子中的“天然磁鐵”與 NMR 磁體的磁場對齊。然後,樣品暴露於一系列無線電波脈衝以破壞原子的磁平衡。可以觀察這些原子核的反應以評估它們的化學性質,特別是它們的化學位移特性。可以進行一組實驗來細化可能的結構,並將實驗的平均值作為最終結構呈現。它與 X 射線晶體學相比具有優勢,因為蛋白質樣品可以處於溶液狀態而不是結晶形式,並且可以確定樣品蛋白質的其他性質,例如靈活性相互作用,而 X 射線晶體學只能揭示蛋白質的結構。
當原子置於磁場中時,原子能級發生分裂。後來發現這種效應是由於核自旋造成的。1924 年,沃爾夫岡·泡利首次提出了 NMR 的理論基礎,他得出結論,一些原子核應該具有核自旋,而這些原子核在置於磁場中時會分裂成簡併能級。這些原子核本身具有磁矩,稱為自旋。具有自旋的原子核被稱為 NMR 活性。表 1 中顯示了一些 NMR 活性原子核,其中斜體字的原子核是生物分子中常見的原子核。

分別在 1946 年,斯坦福大學的博爾奇和哈佛大學的珀塞爾將塞曼效應轉化為第一個 NMR 譜圖。1949 年,斯坦福大學的普羅克特和於首次測量了化學位移和自旋耦合。最初,商用 NMR 光譜儀是連續波型的,只能檢測最靈敏的原子核,即 1H 和 19F。如果原子核自旋 I 不為零,則 NMR “活性”原子核是活性的。
確定原子核自旋
質量數為偶數且中子數為偶數,I=0,因此沒有自旋
質量數為偶數且中子數為奇數,I=整數,因此具有自旋
質量數為奇數且中子數為偶數或奇數,I=半整數,因此具有自旋
可以使用以下類比來直觀地理解自旋的原因。旋轉的帶電粒子(例如氫原子核,也稱為質子)將在旋轉方向上產生一個垂直的磁場,類似於條形磁體的磁場,如圖 1 所示。

在沒有外部磁場(B¬0)的情況下,這些活性原子核隨機地定向,但在存在外部磁場(B¬0)的情況下,這些原子核會與場對齊,要麼順磁場方向,要麼逆磁場方向,如圖 2 所示。

原子核在不同能量狀態之間分散。外部磁場(B¬0)的存在會導致不同能級。對於自旋 1/2 原子核,兩種方向是可能的,較高能量方向是“β 自旋態”,較低能量方向是“α 自旋態”。這在以下方程中很明顯,其中 E=能量,h=普朗克常數,ν=頻率,γ=旋磁比(取決於原子核),B0=外部磁場
ΔE= h ν = γ B0
要從圖形上看到這一點,請參見圖 3。

這些誘導的能級差使得 NMR 的使用成為可能。在平衡時,原子核將佔據兩個能級,低能級和高能級。然而,根據麥克斯韋-玻爾茲曼分佈,低能級將被更多數量的原子核佔據。低能級和高能級之間原子核數量的這種差異是 NMR 利用的。引起自旋翻轉,即從低能態到高能態躍遷所需的能量對應於電磁頻譜的無線電頻率範圍。ΔE= h ν 當電磁輻射的頻率恰好與能量變化 ΔE 相匹配時,原子核才會翻轉自旋,吸收能量。這被稱為共振點。原子核的共振頻率將根據其區域性的電子環境而不同。這可以在“質子 (1H) NMR 譜圖的手工示例”中看到。所有正在觀察的原子核都被無線電波照射到較高能量狀態,然後被允許衰變回較低能量狀態。這種衰變是觀察到的。當原子核回落到較低能量狀態時,會收集自由感應衰減訊號,圖 4 描繪了一個通用的 FID。

然後將該 FID 進行傅立葉變換,以從時域轉換為頻域,如圖 5 所示。

磁場強度的變化將改變原子核的共振頻率。因此,為了比較不同磁場強度儀器的譜圖,必須從頻率轉換為百萬分率(ppm)。這可以使用圖 6 中所示的方程式完成。

隨著 20 世紀 70 年代傅立葉變換儀器的出現,可以採集自然丰度不高的原子核的譜圖,例如 13C,它在自然界中的丰度僅為 1.1%。這需要採集多個譜圖並將它們加在一起才能獲得更高的靈敏度。由於訊號幅度隨採集次數線性增加,而噪聲幅度隨採集次數平方增加,因此信噪比 (S/N) 會隨著採集次數的增加而增加。因此,S/N 會隨採集次數的平方增加,如圖 7 所示。

2002 年諾貝爾化學獎部分授予庫爾特·武特里希,以表彰他“對生物大分子結構和功能的 NMR 研究”。[1] 因此,NMR 對結構生物化學很重要。表 2 列出了與 NMR 波譜相關的發現而獲得的諾貝爾獎。


NMR 是一種強大的技術,可以透過分析某些原子的相對位置來確定高度濃縮溶液中蛋白質的結構(Shriner 136)。蛋白質 NMR 利用碳和氧的最豐富同位素(12 和 16)以及氮 (14) 的豐富同位素的淨核自旋為零這一事實,而氮 (14) 的淨核自旋為 1。無法對淨核自旋為零的原子進行 NMR。由於單個蛋白質中存在許多不同的原子核,因此在透過 NMR 分析產生的化學位移中預計會出現大量重疊,因此採用多維方法。透過電磁脈衝將磁化作用施加到蛋白質和原子核上,這些脈衝可以透過兩種方式磁化原子核。第一種涉及透過原子核鍵合磁化,第二種涉及透過開放空間磁化。每種方法都提供了一種不同的分析蛋白質的方法,例如第一種方法允許針對不同的原子核,而第二種方法允許結構計算距離約束並針對未標記的蛋白質。
本身具有磁性的原子核表現出自旋特性,從而產生磁矩。當對系統施加外部磁場時,磁矩可以採用 α 態或 β 態。磁場強度決定了 α 與 β 的比例,傾向於有利於 α,因為它與場對齊並具有較低的能量。透過提供電磁脈衝,α 自旋原子核將變為 β 併產生共振。透過保持系統上的恆定磁場並調整電磁脈衝的頻率,可以獲得共振譜圖。
目前,NMR 光譜儀使用脈衝輻射的傅立葉變換方法。為了將 α 態的原子核變為 β 態,使用強輻射脈衝。然後去除輻射脈衝,原子核回到其原始的 α 態,產生衰減訊號。該訊號由計算機以非常快的速度轉換為頻域譜圖。透過儲存多個訊號,會產生更強烈的譜圖。(Shriner 136)
磁性原子核周圍的電子會產生一個區域性磁場,該磁場與外加磁場方向相反。磁性原子核可以在特定頻率下吸收電磁脈衝,這些頻率被稱為“化學位移”(訊號位置),用百萬分率 (ppm) 表示。這些化學位移是相對於標準化合物(例如四甲基矽烷 (TMS) 的衍生物 (CH3)4Si(化學位移為 0.0))來確定的,該化合物可溶於水。透過該分析產生的核磁共振譜可以進行分析,並結合多維分析確定蛋白質的結構。
當原子核受到磁場的影響時,它會產生一個磁矩,該磁矩會使其自身旋轉。旋轉的不同方向,即自旋狀態,存在於不同的能量狀態——α狀態和β狀態——其中α狀態被發現更穩定,能量更低,因為透過實驗發現它與磁場方向相同。為了使α狀態轉變為β狀態(激發態),需要脈衝電磁輻射來增加電磁輻射的頻率(透過照射),以使旋轉的原子核克服能量勢壘並改變其方向。(有關更多資訊,請參見 玻爾模型)。因此,將獲得共振。它是由美國物理學家愛德華·米爾斯·珀塞爾和瑞士物理學家菲利克斯·布洛赫於 1946 年發現的。
磁場分裂的能級差對應於無線電波的能量。因此,直到二戰期間,政府大量投資雷達技術,才開發出核磁共振波譜儀所需的電子裝置。雷達就是利用無線電波來探測移動物體的位置和方向。更好的頻率合成器、放大器、接收器和訊號處理器都有助於核磁共振波譜領域的發展。核磁共振波譜儀的組成部分如圖 8 所示。

表 3 中顯示了一些常見的二維實驗。
| 常見的二維實驗 (表 3) | |
|---|---|
| COSY | 相關譜 透過鍵 H-H 相關性 |
| TOCSY | 全相關譜 擴充套件透過鍵 H-H 相關性 |
| 一維 NOE | 核 Overhauser 效應譜 H-H 空間相關性 |
| NOESY | 核 Overhauser 效應譜 H-H 空間相關性 |
| ROESY | 旋轉框架 Overhauser 效應譜 類似於 NOESY |
用於核磁共振的磁體非常強。用於高解析度蛋白質結構測定的磁體頻率範圍為 500 兆赫茲至 900 兆赫茲,產生的磁場強度是地球磁場的數千倍。雖然樣品暴露在強磁場中,但很少有磁力從機器中逸出。核磁共振磁體是超導體,因此必須用液氦冷卻,液氦保持在 4 開爾文。液氮保持在 77 開爾文,有助於保持液氦的低溫。
只有某些同位素適合用於核磁共振。核磁共振中最常用的同位素是氫-1(質子核磁共振)。其他常用的同位素是碳-13 和氮-15。
向量模型僅適用於未耦合的自旋。在核磁共振波譜下活躍的原子核與其相關的核自旋磁矩相關聯,這意味著這些原子核會產生微弱的磁場。當這些原子核置於磁場中時,相互作用的能量取決於磁場和磁矩之間的角度。當磁場和磁矩指向相反方向時,相互作用的能量最高;當磁場和磁矩指向相同方向時,相互作用的能量最低。在對原子核群體施加磁場之前,由於隨機熱運動,這些原子核的磁矩隨機排列。施加磁場後,必須等待自旋達到平衡,這一過程稱為弛豫。指向磁場方向在能量上略微有利,因此只有極少數的自旋會這樣做,形成主體磁化向量。因此,樣品被磁化。在平衡時,主體磁化向量將指向磁場方向(我們將假設它是 z 方向),並且是靜止的。如果磁化向量偏離軸線,它將以拉莫爾頻率(-旋磁比 * 磁場)進動。脈衝的目的是快速改變磁化向量的方向。這可以透過在所需方向上產生一個更弱的磁場來實現,但允許它以上述拉莫爾頻率振盪。這將導致磁化向量指向所需的方向。發生這種情況是因為當 B1 場(更弱的場)以拉莫爾頻率附近振盪時,結果是 B0 場(z 方向上更強的場)的強度似乎降低了。因此,如果 B1 場遠大於減小的場,則產生的磁場(有效場)可以指向非常接近 B1 場的方向。共振脈衝涉及透過在特定方向上施加 B1 場特定時間來改變磁化向量的方向。磁化向量旋轉的角度等於有效場頻率和脈衝施加時間的乘積。透過施加不同的時間,可以將磁化向量旋轉到不同的角度。對於實際的核磁共振實驗,樣品中將存在多個共振頻率。如果使 B1 場足夠強,則有可能將磁化向量非常接近所需方向,這意味著我們可以將其接近於共振脈衝的理想情況。向量模型可用於理解簡單的核磁共振實驗。
化學位移是蛋白質核磁共振分析圖中使用的單位。化學位移與穿過蛋白質樣品的不同射頻電磁脈衝相關。每個表現出自旋特性的分子都顯示出不同的化學位移。可以透過向蛋白質樣品傳送核磁能來觀察化學位移。圍繞每個自旋核的電子雲會產生一個區域性磁場,該磁場與外加磁場方向相反。當電磁脈衝穿過樣品時,α自旋核被正確的能量擊中以切換到β自旋,然後它們這樣做並隨後引起共振。這種共振隨後可以被記錄下來,並且被報告為以百萬分率 (ppm 化學位移) 應用於樣品的不同頻率。例如,當核磁場強度發出 1 ppm(百萬分率)的頻率時,CH3 對其做出反應,並表現出β自旋行為,從該行為中,光譜捕捉到該訊號並將其記錄下來。
在 300-MHz 1H 核磁共振中,大多數氫吸收落在 3000 Hz 的範圍內。我們不是記錄每個共振的精確頻率,而是相對於內部標準物四甲基矽烷 (CH3)4Si 來測量它。它的 12 個等效氫相對於大多數有機分子中的氫來說是遮蔽的,從而導致共振線方便地移出通常的光譜範圍。然而,這些數字的問題是它們會隨著外加磁場強度的變化而變化。由於場強和共振頻率成正比,因此將場強度加倍或三倍將使觀察到的峰相對於 (CH3)4Si 的距離(以赫茲為單位)加倍或三倍。為了便於比較已報道的文獻光譜,我們透過將到 (CH3)4Si 的距離(以赫茲為單位)除以波譜儀的頻率來標準化測量的頻率。此過程產生一個與場無關的數字,即化學位移 δ。
核磁共振譜使用超導磁體來研究許多金屬核。由於其天然丰度低和核磁共振實驗靈敏度低,碳 13 核磁共振在促進研究方面越來越有用。整合有機金屬配合物的核磁共振峰可以提供不同環境中原子比例的資訊。由於有機金屬化合物中碳原子的弛豫時間不同,因此會產生很大的誤差。但它也有自身的優勢。例如,末端羰基峰通常在 195 到 225ppm 的範圍內,這使得它很容易與其他配體區分開來。13C 化學位移與 CO 鍵強度相關。鍵越強,化學位移越小。環戊二烯基配體中的 13C 在順磁性化合物中具有很寬的化學位移範圍,而在抗磁性化合物中則更窄。
在核磁共振中,某些原子核必須天生具有磁性,才能使用此技術。但是,只有某些同位素具有這種稱為自旋的磁性特徵。一個例子是氫。當施加外磁場時,氫的自旋質子會產生一個磁矩,該磁矩可以處於 α 或 β 自旋狀態。兩種狀態之間的能量差與施加的外磁場量成正比。α 狀態與施加的場對齊,能量低於 β 狀態。當對 α 狀態施加電磁輻射脈衝時,它可以被激發到 β 狀態,從而獲得共振。
核磁共振只能檢測某些原子,並且只能檢測某些同位素。例如,它可以檢測質量為 1 amu 的氫分子,但不能檢測其他同位素。最常用的是氫和碳核磁共振。核磁共振可以確定的資訊非常多。在氫核磁共振的情況下,可以使用表格中的一些知識來確定每個峰對應於樣品中的哪個基團。解釋核磁共振可能有點棘手,因為必須理解裂分模式。例如,您可能正在檢查的碳原子可能只有一個氫原子連線,但是如果連線到一個甲基,它將顯示為一個四重峰。
遮蔽和去遮蔽
[edit | edit source]處於不同化學環境中的質子受到不同程度的遮蔽。當一個被電子包圍的原子核暴露在強度為H0的磁場中時,這些電子以產生一個小區域性磁場hlocal的方式移動,該磁場與H0相反。因此,氫核附近的總磁場強度減小,因此可以說該原子核被其電子雲遮蔽了磁場強度。遮蔽程度取決於原子核周圍的電子雲密度。增加電子會增加遮蔽;相反,去除電子會導致脫遮蔽。此外,當感應磁場增強外加磁場時,質子會發生脫遮蔽。例如,感應磁場可以增強外加磁場。結果,這些質子脫遮蔽,它們的化學位移在更高的ppm值處。
耦合
[edit | edit source]J-耦合源於不同自旋態透過分子化學鍵的相互作用,導致NMR訊號分裂。這種耦合提供了關於原子連線性和分子結構的詳細資訊。自旋-自旋分裂由N+1規則給出:1)與一個H相鄰的H共振為雙峰。2)與兩個組等效的H相鄰的H共振為三峰。3)與三個等效的氫相鄰的H共振為四重峰。
當存在耦合模式的混合時,可以顯示多重峰,其中一些可以分解成小部分(例如,qd-雙峰四重峰)。但在大多數情況下,如果耦合模式顯示出無法透過N+1規則輕鬆計數的複雜性,則這種模式稱為多重峰。此外,含有醇(-OH)官能團的醇,如醇,羧酸在NMR譜圖上具有寬頻。這是因為醇上的氫可以很容易地形成氫鍵,因此能夠在比其他H更寬的譜圖中耦合。因此,僅透過檢視譜圖的型別(例如多個峰或寬峰),就可以輕鬆地對H所關聯的官能團進行分類。
分裂峰的比例由一個稱為帕斯卡三角形的數學助記符給出。該三角形中的每個數字都是它上方一行中兩個最接近數字的總和。重要的是要記住,不等價的核相互分裂。換句話說,觀察到一個分裂吸收需要在光譜中存在另一個分裂訊號。此外,這些模式的耦合常數必須相同。雙鍵和三鍵的特徵化學環境顯示出複雜的裂峰。例如,炔烴可以具有額外相鄰碳原子遠離的氫分裂模式。烯烴根據氫相對於相對化學環境的位置(順式或反式),可以顯示出略微扭曲的峰。
積分
[edit | edit source]積分在NMR譜圖中非常有用,可以確定分子的結構。訊號的相對積分強度與產生該吸收的核的相對數量成正比。通常,NMR譜圖會顯示非常複雜的積分數。但是,積分並不需要完全準確。你只需將每個積分數除以NMR譜圖中最小的數字即可。該比率將幫助你瞭解由峰表示的H的相對數量。結合化學位移和峰積分,你可以使用化學位移表確定分子的結構。研究人員通常使用NMR來檢查他們從反應中得到的產物是否正是他們想要的。因此,他們不必透過檢視複雜的光譜來確定分子的結構。他們知道如果反應有效,光譜應該是什麼樣子。透過將實際光譜與理想光譜進行比較,他們能夠驗證他們想要的分子是否在產物中。使用的溶劑通常是CD2Cl2,因為D在H NMR譜圖中不會顯示出來。結合化學位移,它們可以用來確定結構。
質子NMR解釋
[edit | edit source]為了解釋質子NMR,重要的是要知道每種型別的質子位於何處。下面列出了質子的型別及其在NMR上的化學位移。
重要的是要知道,質子NMR峰僅指示質子(H)的存在。它不顯示其他原子,如碳、氧等。如上文所述,質子峰由於與相鄰質子的耦合而顯示分裂。每個峰的積分是質子相對於NMR上其他質子的數量。在從H NMR中解決結構時,重要的是寫下每個峰的化學位移、積分和分裂。然後根據峰的化學位移,寫下可能的官能團和結構。最後,排列和連線每個結構,使其與質子NMR的分裂和積分相匹配。以下是手繪製的質子NMR的示例以及解釋質子NMR的詳細說明。
示例
[edit | edit source]每個質子NMR的解釋直接在每個圖表下方給出。儘量不要看結構,只看分子式和質子NMR來解釋化合物的結構。請注意,給出的例子是基礎和簡單的化合物。蛋白質結構的NMR比這些例子複雜得多。這些例子的目的是讓你瞭解質子NMR是如何解釋的。
根據質子NMR的化學位移,應該有一個酮官能團或包含羰基的結構,在約2.0的峰值處。約1.3的峰值可能是伯烷基或仲烷基。
現在看一下化學位移1.3 (C) 處的峰值分裂,三峰(3個峰)表明質子可能被2個相鄰質子分裂(基於積分部分中提到的n+1規則)。如果它只被1個相鄰質子分裂,那麼它將是雙峰(2個峰)。接下來,看一下化學位移2.0 (B) 處的峰值。單峰(單個峰)意味著該質子環境可能沒有相鄰質子。化學位移4.2 (A) 處的峰值是四重峰(4個峰)。這意味著質子環境A附近大約有3個相鄰質子。由於已知B在其旁邊沒有質子,而A和C都有相鄰質子,因此可以安全地假設質子環境A就在質子環境C旁邊,這可能是-CH2CH3。上面推斷出的以下可能結構是酮和乙基。
| 亞結構 | 
|

|
|---|---|---|
| 分裂模式 | 單峰 | 四重峰和三峰 |
| 分析 | C沒有相鄰的H | C有三個相鄰的H C有兩個相鄰的H |
請注意,分子式中有兩個氧原子。其中一個氧原子包含在酮中。另一個氧原子必須連線到這兩個結構之一。看一下峰A,化學位移接近4.0,這意味著它可能連線到像氧這樣的雜原子。將氧原子放在-CH2CH3旁邊,並將結構連線在一起,你將得到乙酸乙酯,如質子NMR下方所示。請注意,質子B沒有相鄰質子。質子A被質子C分裂成4個峰(n+1規則,n = 3個相鄰質子)。質子C被質子A分裂成3個峰(n = 2個相鄰質子)。CH2,仲烷基,根據質子頻率表,應該在約1.2 ppm的化學位移附近,但實際上它在約4.2 ppm處。造成這種情況的原因是CH2連線到氧,氧是一種吸電子基團。結果是化學位移被拉到了左場,導致4.2 ppm的化學位移。另一種看待這個問題的方法是假設在4.2 ppm的化學位移處存在一個酯官能團,伯烷基連線到酯。質子NMR的積分也與結構很好地匹配。羰基旁邊的甲基CH3有3個質子,CH2旁邊的伯烷基也有3個質子。這解釋了為什麼峰B與峰C的高度相同(相同的質子數量)。峰A的高度最低,因為它只有兩個質子。
 這個質子核磁共振譜例子看起來比第一個複雜,但實際上更容易。從這個質子核磁共振譜中得到的一個重要資訊是,在 6.0~ 7.0 ppm 附近有峰(F,B,D,E)。這幾乎總是表明芳香環的存在。注意到從 6.0 到 7.0 ppm 有大約 4 組峰?這意味著有四個質子連線到芳香環上的 4 個碳原子上。這使得芳香環的 2 個碳原子可以自由連線到兩個取代基上。這些取代基的位置顯然是芳香環上的鄰位和對位。原因是芳香環上鄰位和對位上的兩個不同取代基會給出 4 種質子環境。如果在 6.0~ 8.0 ppm 附近只有兩種質子環境,並且積分(高度)相同,這意味著芳香環可能在兩側對稱,具有雙對位取代基。現在看一下 5.5 ppm 處的峰(A)。該峰是寬峰,而不是像其他峰一樣的尖銳峰。這意味著該環境的質子連線到雜原子。根據給出的分子式,樣品中存在的唯一雜原子是氧原子。這意味著質子直接連線到氧原子,這將是一個醇基團 -OH(注意,醇基團上的質子可以具有從 0.5 到 5.0 ppm 的化學位移範圍)。重要的是要記住,連線到雜原子的質子也被稱為可交換質子。可交換質子有時不會出現在 H NMR 上,所以當預期的可交換峰沒有出現在 HMNR 上時不要擔心。化學位移約為 3.9 ppm 的峰(C)具有最高的積分(高度)並且是單峰。通常,當在分子式中含有氧原子時,在 3.9 ppm 附近觀察到如此高的單峰時,很有可能是一個醚基團,-OCH3。由於醚的 CH3 旁邊沒有相鄰質子,所以它是單峰。此外,該峰的高度與其他峰相比很高,這表明可能存在 CH3,其質子數至少是其他質子環境的 3 倍。根據以上解釋,這些是可能的官能團:
這個質子核磁共振譜例子看起來比第一個複雜,但實際上更容易。從這個質子核磁共振譜中得到的一個重要資訊是,在 6.0~ 7.0 ppm 附近有峰(F,B,D,E)。這幾乎總是表明芳香環的存在。注意到從 6.0 到 7.0 ppm 有大約 4 組峰?這意味著有四個質子連線到芳香環上的 4 個碳原子上。這使得芳香環的 2 個碳原子可以自由連線到兩個取代基上。這些取代基的位置顯然是芳香環上的鄰位和對位。原因是芳香環上鄰位和對位上的兩個不同取代基會給出 4 種質子環境。如果在 6.0~ 8.0 ppm 附近只有兩種質子環境,並且積分(高度)相同,這意味著芳香環可能在兩側對稱,具有雙對位取代基。現在看一下 5.5 ppm 處的峰(A)。該峰是寬峰,而不是像其他峰一樣的尖銳峰。這意味著該環境的質子連線到雜原子。根據給出的分子式,樣品中存在的唯一雜原子是氧原子。這意味著質子直接連線到氧原子,這將是一個醇基團 -OH(注意,醇基團上的質子可以具有從 0.5 到 5.0 ppm 的化學位移範圍)。重要的是要記住,連線到雜原子的質子也被稱為可交換質子。可交換質子有時不會出現在 H NMR 上,所以當預期的可交換峰沒有出現在 HMNR 上時不要擔心。化學位移約為 3.9 ppm 的峰(C)具有最高的積分(高度)並且是單峰。通常,當在分子式中含有氧原子時,在 3.9 ppm 附近觀察到如此高的單峰時,很有可能是一個醚基團,-OCH3。由於醚的 CH3 旁邊沒有相鄰質子,所以它是單峰。此外,該峰的高度與其他峰相比很高,這表明可能存在 CH3,其質子數至少是其他質子環境的 3 倍。根據以上解釋,這些是可能的官能團: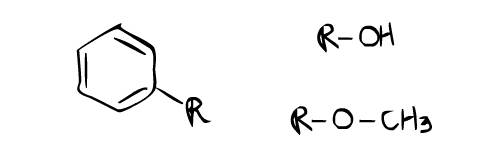
將醇基團和醚基團連線到鄰位-對位位置將導致該化合物的正確結構。
核Overhauser效應譜 (NOESY)
[edit | edit source]
NOESY 是一種核磁共振技術,它利用核 Overhauser 效應來幫助理解蛋白質和其他大分子三級結構。核 Overhauser 效應是指彼此距離很近的原子核之間的相互作用。該效應的程度大約為 5 埃。對於不能形成晶體結構而需要在溶液中分析的蛋白質來說,這是一種更好的三級結構分析方法。就像在核磁共振中一樣,在分子周圍產生一個磁場,併產生不同頻率的射頻波來產生共振。當原子核反轉自旋時,就會產生共振。與普通核磁共振不同,NOESY 的目的是確定一個原子核的共振對該區域中其他原子核的影響。產生的圖譜可以讓你瞭解原子核彼此之間的相對位置。
NOESY 實驗揭示了質子彼此之間的距離。彼此非常靠近的質子(大約 3 埃)會產生非常強的訊號。檢測限大約是 5-6 埃,只會產生非常微弱的訊號。
該圖譜具有對角線上的點,這些點對應於原子核在一維核磁共振譜上的位置。對角線譜外也有點。這些點顯示了哪些原子核彼此靠近。如果從外點水平和垂直畫一條線,則對角線譜上的線上的點彼此靠近。利用來自核磁共振和 NOESY 的資訊,可以形成大分子的三級結構。然而,所得到的三級結構將包含一系列結構。出現這種情況有三個原因。第一個是原子核之間距離的近似值。其次,可能沒有足夠的約束條件來產生單一的結構。第三,蛋白質處於溶液中,而溶液中包含許多蛋白質。
這種技術主要用於氫原子,因為它們是生物系統中最豐富的原子,也是最簡單的原子。
蛋白質核磁共振
[edit | edit source]核磁共振儀本質上是一個巨大的磁鐵。許多原子本質上都是微小的磁鐵。當放在核磁共振儀中時,所有微小的磁鐵都會排列起來,與大磁鐵對齊。透過利用這一物理定律,核磁共振光譜學家能夠弄清楚有關分子物理、化學、電子和結構的資訊。
核磁共振依賴於施加的磁場與某些原子核中天然存在的“微小磁鐵”之間的相互作用。對於蛋白質結構測定,光譜學家專注於蛋白質中最常見的原子:氫、碳和氮。研究人員透過核磁共振試圖瞭解的是,這條氨基酸鏈是如何圍繞自身纏繞和摺疊,從而形成三維的活性蛋白質。使用核磁共振解決蛋白質結構是一系列實驗,每個實驗都提供有關樣品分子中原子性質的部分線索,例如兩個原子彼此之間有多近,這些原子是否物理結合在一起,或者這些原子位於同一個氨基酸中的哪個位置。其他實驗顯示相鄰氨基酸之間的聯絡,或揭示蛋白質中靈活的區域。每組新的實驗都會進一步細化可能的結構,直到最後科學家仔細選擇 10 到 20 個最能代表其資料的解決方案,並呈現平均值作為其最終結構。
核磁共振樣品製備
為了透過核磁共振研究蛋白質結構,必須製備感興趣蛋白質的高度純化的樣品。蛋白質可以從天然來源中分離出來,也可以透過重組 DNA 技術在宿主生物體(如大腸桿菌)中表達。含有編碼特定蛋白質的重組基因的細菌在用 15NH4Cl 作為細菌唯一氮源的最小培養基中生長,而 13C-葡萄糖為細菌製造蛋白質提供唯一碳源。這樣,當細菌產生目標蛋白質時,這些蛋白質被標記為 15N 和 13C,這兩者都是核磁共振活性。然後透過各種蛋白質純化技術純化目標蛋白質(參見蛋白質純化技術)。最後,將蛋白質在適當的緩衝液中裝入核磁共振管中,並準備放入核磁共振磁鐵中。

核磁共振實驗
二維實驗 可以進行許多不同型別的核磁共振實驗來幫助揭示有關蛋白質結構的資訊。這些實驗通常在檢測到的相關性方面有所不同。例如,二維 [1H-1H]-NOESY 實驗將揭示距離在 0.5 奈米內的氫原子。表現出這種相互作用的質子將在二維譜圖上顯示為交叉峰(圖 2)。

從理論上講,利用這些資訊,可以將 1D 譜圖上 8 ppm 和 9 ppm 處的質子分配給氨基酸序列中的特定殘基。例如,如果 Ala1 是 8 ppm 處的點,Ala54 是 9 ppm 處的點,並且存在交叉峰,那麼觀察到這種 NOE 揭示了該多肽鏈的環狀結構(圖 3)。

由於蛋白質比上面的例子複雜得多,二維 NOESY 譜圖通常雜亂無章,交叉峰無法清晰地識別出來,因為許多這些點可能會堆疊在一起。需要其他實驗來揭示確定蛋白質 3D 結構所需的資訊,例如 3D 實驗。
三維實驗 三維實驗使用第三維來揭示可能在二維譜圖中堆疊在一起的峰。一個例子是三維 15N 相關 [1H-1H]-NOESY(圖 4)。還有許多其他實驗可以關聯不同的原子核及其鄰居。

蛋白質核磁共振優勢
[edit | edit source]核磁共振是一種很好的方法,可以嘗試解決蛋白質結構以及持續不斷的未解蛋白質摺疊問題。然而,它不是唯一的方法,因為晶體學也是一種可能的蛋白質結構測定方法。然而,核磁共振比晶體學有其優勢。
一個例子是它使用溶液中的分子,因此它不侷限於那些結晶良好的分子,因為結晶是 X 射線晶體學中一個非常不確定且耗時的步驟。此外,一些蛋白質不容易結晶。此外,雖然結晶蛋白質中存在的結構非常接近於不受晶體環境約束的蛋白質的結構,但溶液中的結構可能是額外見解的來源。核磁共振還使研究分子結構以外的性質變得相當容易,例如分子的柔性和它如何與其他分子相互作用。對於晶體學,要麼無法研究這些方面,要麼需要一個全新的晶體。
大多數核磁共振光譜學家專注於不超過 20-30 千道爾頓的分子。X 射線晶體學家已經解析了高達 2,500 千道爾頓的結構。
2004 年分離出存在於葡萄籽中的 15 個碳化合物 Viniferone。Viniferone 屬於葡萄籽中的一類物質,對自由基和氧化應激非常活躍。從大量的葡萄籽中回收的 Viniferone 很少(10.5 公斤葡萄籽中約 40 毫克 Viniferone),因此必須在用於獲得其結構的技術中採取預防措施。大多數測試會破壞獲得的微量原花青素 Viniferone,因此採用了一系列光譜技術(包括核磁共振)來獲得 Viniferone 的結構。獲得1H 和13C 核磁共振資料對於確定 Viniferone 的結構至關重要。各種在不同化學位移下的吸收訊號有助於確定烯烴和苯環的存在。相關光譜學,最終的 X 射線晶體學被用來驗證 Viniferone 的結構排列。[1]
- ↑ Schore, Neil E. (2011)。有機化學結構與功能 第 6 版。W. H. Freeman
如果您想了解更多關於解釋核磁共振峰的資訊,我強烈建議您訪問此網站。 http://www.wfu.edu/~ylwong/chem/nmr/h1/
Berg, Jeremy M., Lubert Stryer 和 John L. Tymoczko。生物化學。第 6 版。波士頓:W. H. Freeman & Company,2006。98-101。
Shriner, Christine K. F. Hermann, Terence C. Morrill, David Y. Curtin, Reynold C. Fuson。有機化合物的系統鑑定。第 8 版。美國。John Wiley & Sons, Inc. 2004。136-142。
Vollhardt, K. Peter C.,Schore, Neil E. 有機化學 - 結構與功能。第 5 版。紐約:W. H. Freeman & Company,2005。398-432。
Keeler, James。理解核磁共振光譜學。西薩塞克斯,英國。John Wiley & Sons。51-77。
Clore, Marius G.,Gronenborn, Angela M. “第 34 章:透過多維異核核磁共振確定較大蛋白質、蛋白質-配體和蛋白質-DNA 複合物的結構”。溶液狀態的多維核磁共振方法。英國。John Wiley & Sons Ltd.
Wuthrich, Kurt。 “第 33 章:生物大分子:溶液中的結構測定”。溶液狀態的多維核磁共振方法。英國。John Wiley & Sons Ltd.
美國國立衛生研究院,美國國立普通醫學科學研究所,紐約,2007,29-30,http://www.nigms.nih.gov.
[1]"Kurt Wüthrich - 諾貝爾演講"。Nobelprize.org。2010 年 10 月 25 日 http://nobelprize.org/nobel_prizes/chemistry/laureates/2002/wuthrich-lecture.html


