結構生物化學/蛋白質/剪接蛋白的訊號控制
測序和微陣列技術方面的進步使我們能夠更好地理解不同細胞中前 mRNA 剪接模式。例如,當細胞受到諸如 DNA 損傷、神經元去極化或細胞代謝變化等因素刺激時,細胞剪接會發生變化。在過去幾年中,關於將細胞刺激與下游可變剪接控制相關聯的機制模式的研究越來越多。這些剪接事件中的一些包括剪接因子的降解、核易位改變以及剪接因子的調控合成。
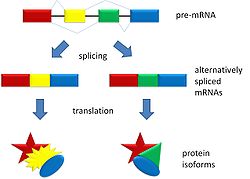
可變剪接是在基因表達過程中發生的一種過程,它允許從單個基因編碼產生多個蛋白質(蛋白質亞型)。可變剪接可能由於外顯子從信使 RNA 中排除或包含的不同方式而發生。它也可能發生在當外顯子的一部分被排除/包含或內含子被包含時。例如,如果前 mRNA 有四個外顯子(A、B、C 和 D),則這四個外顯子可以以多種不同的組合進行剪接和翻譯。外顯子 A、B 和 C 可以一起翻譯,或者外顯子 A、C 和 D 可以翻譯。這就是導致可變剪接的原因。
剪接模式和可變剪接信使 RNA 的產生是由調控蛋白(含有基因的反式作用蛋白)與位於前 RNA 上的順式作用位點結合控制的。這些調控蛋白中的一些包括剪接啟用劑(促進特定剪接位點的蛋白質)和剪接抑制劑(降低特定位點使用率的蛋白質)。一些常見的剪接抑制劑包括:異質核核糖核蛋白 (hnRNP) 和多嘧啶區結合蛋白 (PTB)。從可變剪接信使 RNA 翻譯的蛋白質在氨基酸序列上有所不同,這導致蛋白質功能發生改變。這就是人類基因組能夠編碼多種蛋白質的原因。可變剪接是真核生物中常見的一種過程;人類中大多數多外顯子基因都是可變剪接的。不幸的是,剪接的異常變化也是導致許多遺傳疾病和疾病的原因。

信使 RNA 的剪接是透過稱為剪接體的巨型分子複合體完成和催化的。連線和切割的區域由剪接體的許多亞基決定。這些亞基包括分支位點 (A) 以及 5' 和 3' 剪接位點。這些亞基與剪接體中發現的小核核糖核蛋白 (snRNP) 之間的相互作用形成了剪接體 A 複合體,它有助於確定哪些內含子要排除在外,哪些外顯子要保留並連線在一起。一旦內含子被切割和移除,外顯子就會透過磷酸二酯鍵連線在一起。
如上所述,剪接受抑制蛋白和啟用蛋白的調控,這些蛋白也稱為反式作用蛋白。同樣重要的是在信使 RNA 上發現的沉默子和增強子,也稱為順式作用位點。這些調控功能共同作用以建立確定可變剪接的剪接程式碼。順式作用位點將在此處討論。

剪接沉默子是在前信使 RNA 中發現的調控位點,剪接抑制蛋白與之結合。當抑制蛋白與沉默子位點結合時,它會降低選擇附近位點作為剪接連線的可能性。這些沉默子位點可以在內含子或外顯子上找到。當位於內含子上時,這些位點被稱為內含子剪接沉默子,而在外顯子上被稱為外顯子剪接沉默子。在這些位點上發現的序列數量眾多,這使得不同型別的蛋白質能夠結合。

另一方面,剪接增強子是剪接啟用蛋白可以與之結合的調控位點。當啟用蛋白與增強子位點結合時,它會增加選擇附近位點作為剪接連線的可能性。就像剪接沉默子一樣,這些位點也可以在內含子和外顯子中找到。在內含子中,它們被稱為內含子剪接增強子,而在外顯子中被稱為外顯子剪接增強子。但是,與它們的沉默子對應物不同,增強子位點通常允許啟用蛋白的結合,這些啟用蛋白屬於 SR 蛋白家族。這些蛋白質富含精氨酸和絲氨酸。
某些特定訊號如何調控可變剪接?最近發現可變剪接幾乎發生在所有人類基因中。最典型的是,當發生可變剪接時,特定外顯子可能在不同的細胞型別或生長條件下被包含或排除。在每種情況下,剪接模式、調控蛋白與順式作用輔助序列的結合通常決定剪接模式,而這些序列反過來控制結合發生的位置和/或酶複合體在鄰近剪接位點處的反應方式。(可變剪接的組合調控)重要的是,由此產生的 mRNA 的開放閱讀框或控制 mRNA 穩定性或翻譯的順式調控元件的存在可以透過上述任何一種差異模式改變。因此,塑造任何給定細胞的蛋白質組需要精確控制可變剪接,而細胞功能對不斷變化的環境條件的響應方式也可以透過剪接模式的變化而發生顯著改變。

可變剪接的組合調控 剪接體是一種催化內含子去除和外顯子基本連線的巨型分子複合體。為了對前 mRNA 中內含子和外顯子邊界處的序列元素進行排序,各種剪接體亞基的結合決定了連線和切割的確切位點。這些亞基是 5' 剪接位點、分支點序列、富含嘧啶的軌跡和 3' 剪接位點。然而,對於哺乳動物來說,剪接位點是高度保守的;因此,它們通常不足以以高親和力結合剪接體。透過機制結合剪接體的效率可能會受到結合到外顯子或內含子中非剪接位點序列的蛋白質的影響。外顯子或內含子剪接增強子是幫助促進剪接體識別外顯子的序列,而剪接沉默子則是抑制外顯子識別的必要條件。外顯子包含(綠色橢圓形)透過普遍表達的 SRSF 蛋白家族成員的增強子結合得到促進,而外顯子使用透過 hnRNP 蛋白家族成員透過沉默子元件(紅色橢圓形)抑制。FOX、CELF、神經腫瘤腹側抗原 (NOVA) 和類肌盲 (MBNL) 蛋白是一些其他組織限制性更高的剪接調節因子,這些調節因子透過仍然很大程度上未定義的機制作為增強子和剪接抑制因子同樣起作用。因此,單個調控蛋白的結合或表達平衡的細微變化通常會改變 mRNA 亞型表達的比例。
-
神經腫瘤腹側抗原 1
-
類肌盲剪接調節因子 1
剪接蛋白的翻譯後修飾
在許多情況下,磷酸化、乙醯化、甲基化、SUMO 化和羥基化參與剪接調節蛋白的修飾。在 SR 蛋白中發現的廣泛 Arg-Ser 二肽的磷酸化是表徵最充分的修飾。廣泛的翻譯後修飾還包括 HnRNP 蛋白,以及其他非 SR 剪接因子。

近年來,諸如深度測序和敏感微陣列等技術工具為我們揭示了更多關於可變剪接事件的知識。幾乎所有的人類基因都經歷某種形式的可變剪接,包括特定外顯子的差異排除或包含,外顯子部分的排除,以及內含子和外顯子的包含。這些差異趨勢可以改變加工後的mRNA的閱讀框架,或者改變任何監控mRNA翻譯或穩定性的順式調控因子。因此,可變剪接的調控對於塑造細胞蛋白質組至關重要;剪接模式的改變可以改變細胞響應環境變化的功能。心臟組織發育階段、神經元去極化前後以及細胞凋亡前後觀察到的結果表明,可變剪接事件在訊號傳導和發育過程的功能結果中起著重要作用。
由於可變剪接通常由調節蛋白結合到控制結合位置和附近剪接位點酶複合物活性的輔助序列來決定,因此它被用於響應DNA損傷和T細胞活化。一個關於DNA損傷的例子包括E3泛素連線酶鼠雙分鐘-2(MDM2)的可變剪接。MDM2透過靶向p53(一種抑癌基因)使其發生蛋白酶體降解,從而特異性地控制p53的水平。一旦感知到DNA損傷,Mdm2的外顯子就會被跳過,從而減少MDM2的功能,因此允許p53積累。這種誘導的MDM2調控提供了一個例子,說明如何將剪接與轉錄相耦合,因為外顯子跳過模擬了受損的DNA。在這種情況下,細胞表現出“對可變剪接的嚴格控制,這有助於調節蛋白質表達,因為細胞中的條件正在變化”。[3]
改變蛋白質的相互作用是實現可變剪接的另一種方法。T細胞活化的一個證明就是這種情況。在T細胞活化中,可變剪接類似於DNA損傷,其中改變的蛋白質與其他蛋白質的相互作用調節特定T細胞活化期間CD45基因的剪接。在靜息T細胞中,RNA結合蛋白PSF被酶GSK3磷酸化,這會導致磷酸化的PSF與TRAP150形成複合物。結果,PSF不能結合到CD45 RNA。這阻止了任何可能的外顯子排除,導致不參與剪接。然而,在活化的T細胞中,由於抗原與T細胞受體結合並導致GSK3活性下降,因此GSK3很少或沒有。沒有GSK3,PSF不會與TRAP150結合,並且可以自由地結合到RNA。這是一個主要的例子,說明剪接是如何由訊號誘導的轉錄變化控制的。
RNA結合蛋白調控剪接
[edit | edit source]改變調節蛋白的表達水平是影響可變剪接的最簡單方法。由於對給定轉錄本的複雜影響,一個剪接因子的表達發生微小變化就會改變決定外顯子排除或包含的元件。已證明訊號通路可以改變核因子-κB和T細胞核因子等轉錄啟用因子的控制。因此,訊號誘導編碼SR蛋白或其他剪接調節因子的基因的轉錄,從而改變響應這些因子的基因的剪接。在一個例項中,有人提出T細胞的刺激會觸發編碼酪氨酸磷酸酶CD45的基因的剪接訊號。此外,PTB相關剪接因子和hnRNP L樣蛋白啟用CD45外顯子4和6的消除。有趣的是,蛋白質表達的誘導變化不僅僅來自轉錄。如剪接調節蛋白CELF1所示,其蛋白質水平的增加是由於CELF1穩定性和磷酸化的增加,這導致了總體上調的穩態水平。這種磷酸化增加也負責DM細胞中的蛋白激酶C活性。不出所料,蛋白質穩定性的增加還有其他調控;它也受到心臟發育過程中miRNA的控制。這兩個耦合機制突出了這樣一種觀點,即調節調節蛋白表達對於維持細胞功能所需的適當剪接模式至關重要。[3]
RNA結合蛋白的定位
[edit | edit source]除了上面提到的蛋白質表達和穩定性方法之外,當由於調節蛋白的定位而發生訊號變化時,也會發生可變剪接。許多調節蛋白,如上面提到的SR蛋白和hnRNP,必須在細胞核和細胞質之間來回穿梭。結果,這些調節蛋白在細胞核和細胞質中的相對分佈會改變訊號通路。這些改變的通路將導致剪接差異。兩種其分佈受調控的調節蛋白包括SRPK1和hnRNP蛋白(特別是hnRNP A1)。在SRPK1的情況下,這種調節蛋白通常由於與熱休克蛋白的相互作用而存在於細胞質中。然而,當細胞發生滲透性休克時,SRPK1蛋白會轉移到細胞核,並導致SR蛋白的磷酸化。這種磷酸化導致蛋白質與其靶基因之間不同的相互作用,併產生不同的剪接模式。在hnRNP的情況下,滲透性休克實際上對這種蛋白質的定位具有與SRPK1相反的影響。hnRNP通常也存在於細胞質中,但與SRPK1相反,滲透性休克不會導致它轉移到細胞核。實際上,hnRNP的磷酸化阻止其進入細胞核。
可變剪接中的反饋迴路
[edit | edit source]
由於所有生物都經歷穩態,細胞也是如此。為了讓細胞進行穩態,它們必須在條件恢復正常後關閉誘導的剪接訊號。例如,這些調控可能包括去除抗原、DNA修復和神經元復極化。重置基因表達的一種方法是透過去除初始受體或訊號因子本身來停用訊號。當然,諸如磷酸酶和激酶之類的受體會經歷自抑制訊號誘導的可變剪接。例如,響應T細胞活化,CD45的可變剪接將降低細胞對接受抗原刺激訊號的敏感性。在另一個例子中,編碼負責T細胞訊號啟用的激酶的分子,例如FYN原癌基因、訊號調節激酶-1和酪氨酸激酶2β蛋白,由於T細胞活化而經歷可變剪接,以減少表達或改變定位模式。
誘導相反調節因子的表達可以幫助重置誘導的剪接訊號。神經元慢性去極化就是一個例子,這會導致由CaRRE控制的外顯子跳過增加。一些這些CaRRE減少的外顯子在長時間去極化中再次出現。這種剪接模式與CaMK誘導的FOX1的可變剪接有關,FOX1編碼RNA結合蛋白。FOX1調節參與突觸活動的基因的剪接模式。此外,許多由CaRRE控制的基因也具有FOX1結合位點,這可能對外顯子包含產生與CaRRE序列相反的拮抗作用。由於大多數研究只調節少數基因,因此需要進行更多研究才能更全面地瞭解在給定通路的下游發生的可變剪接。[3]
蛋白質剪接的下一步是什麼?
[edit | edit source]儘管上面提到了刺激因素,但對訊號通路如何調節可變剪接的整體圖景還遠遠沒有完整。這些訊號通路的研究所處階段仍然非常早。這裡介紹的方法通常對應於僅少數基因的可變剪接。因此,為了瞭解整個通路的可變剪接,還需要取得更多進展。
參考文獻
[edit | edit source]1. Black, Douglas L. (2003). "可變前信使RNA剪接機制”。生物化學年度評論 72 (1): 291–336。
2. Clark, David (2005). 分子生物學。阿姆斯特丹:愛思唯爾學術出版社。
3. Heyd, Florian和Kristen W. Lynch. DEGRADE, MOVE, REGROUP: 訊號控制剪接蛋白 費城:生物化學趨勢,2011。列印。
4. Matlin, AJ;Clark F,Smith, CWJ (2005年5月)。“理解可變剪接:走向細胞程式碼”。自然評論 6 (5): 386–398。
5. Nilsen, T.W. 和 Graveley, B.R. (2010) 可變剪接擴充套件真核生物蛋白質組。自然 463, 457-463。
6. Pan, Q;Shai O,Lee LJ,Frey BJ,Blencowe BJ (2008年12月)。“透過高通量測序深入調查人類轉錄組中可變剪接複雜性的”。自然遺傳學 40 (12): 1413–1415。
7. 圖片:維基媒體公社
8. Heyd F, Lynch KW. 趨勢生化科學. 2011年8月;36(8):397-404. Epub 2011年5月17日。評論。2. PMID: 21596569 [PubMed - 編入MEDLINE]
9. Barash, Y;等 (2010)。“破譯剪接程式碼”。自然 465 (7294): 53–59。
10. Wang, Z;Burge, Cb (2008)。“剪接調控:從調控元件的零件清單到綜合剪接程式碼”