結構生物化學/蛋白質被脂肪酸修飾
蛋白質被脂肪酸修飾,在半胱氨酸殘基上,引起疏水相互作用。這是一種非常重要的蛋白質翻譯後修飾,透過使蛋白質-蛋白質相互作用、訊號轉導和許多其他蛋白質功能成為可能,從而使蛋白質多樣化。其中一個廣為人知的脂類連線蛋白是 G 蛋白 1。蛋白質遵循的途徑現在正被清晰地理解。多藥耐藥 (MDR) 基因的發現改變了細胞靶向蛋白質的方式。另一個重大發現是發現了一些蛋白質表面存在的小型脂肽。蛋白質的脂類修飾在真核細胞中很重要,因為它們增加了柔韌性和蛋白質特異性。真核細胞存在三種共價脂類修飾:肉豆蔻醯化、棕櫚醯化和異戊烯化。
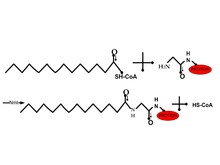
許多細胞肽與一個罕見的 14 碳鏈(醯化)共價連線到甘氨酸的醯胺鍵上。由於這種修飾主要在胞質溶膠中觀察到,因此疏水功能並非這種修飾的唯一功能。N-肉豆蔻醯基轉移酶從酵母和哺乳動物中純化出來。由於溶解性和催化作用,去除內部 Met 後,可以使用肉豆蔻醯輔酶 A 來實現。與疏水區域 2 相比,醯基鏈在酶的效用中起著更重要的作用。在體內,亞甲基的替換與 S 或 O 因此使其更親水。因此,這會改變蛋白質在膜中的分佈。這可用於靶向藥物遞送2。
這涉及半胱氨酸殘基上的硫酯鍵和初級棕櫚酸。然而,由於難以純化不穩定(膜結合棕櫚醯基轉移酶),因此調節該過程的機制知之甚少。另一個挑戰是棕櫚醯輔酶 A 是一種極好的醯基供體,但不需要滿足任何蛋白質序列規格。然而,已經觀察到目標位點位於細胞質側的跨膜區域附近。許多位於細胞質區域附近的蛋白質都被棕櫚醯化2。
這是一種在 C 端的三聯體修飾,取決於基序 CAAX(C,半胱氨酸;A,脂肪族氨基酸;X,任何氨基酸)的初級序列。第一步是在半胱氨酸殘基上新增異戊二烯脂類法呢醇,這將新增第 15 個碳。第二步是蛋白水解去除 AAX 並對 α-羧基進行羧甲基化2。
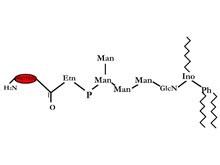
GPI 錨定蛋白是透過錐蟲可變表面糖蛋白 (VSG) 和哺乳動物 Thy-1 抗原發現的。現在已經在許多真核細胞的表面觀察到,包括人類和酵母。透過使用細菌磷脂醯肌醇特異性磷脂酶 C (PI-PLC) 發現了這種鍵的測試,它釋放了 GPI 錨定。醯胺 C 端與乙醇胺連線,乙醇胺透過磷酸二酯鍵進一步連線到三甘露糖基葡糖胺核心聚糖。在三甘露糖基葡糖胺核心聚糖的肌醇第 6 位,磷脂醯肌醇 (PI) 連線在雙層的外部層。甘油基團可能存在許多可能的變異:烷基或醯基,並且鏈長也可能不同。另一個結構差異是聚糖可以具有額外的糖,一些例子是 aGal,/JGalNAc 或 aMan,以及/或磷酸乙醇胺。由於這些許多結構差異,因此這些蛋白質可以執行許多不同的功能 2。
目前只確定了四種修飾真核蛋白質的方法。然而,這並不意味著不存在其他蛋白質的脂類修飾。使用代謝標記和 SDS-PAGE 來識別受脂類調控的蛋白質,發現大約觀察到 10-50 種蛋白質。這可能導致一個結論,即大約 10-50% 的蛋白質被脂類修飾。蛋白質脂類修飾的主要功能之一是定位。分析蛋白質的脂類修飾,我們可以更好地理解細胞功能2。
1. Jui-Yun Lu 和 Sandra L. Hofmann,脂類修飾蛋白的溶酶體代謝——脂類研究雜誌
2. ANTHONY I. MAGEE,蛋白質的脂類修飾及其與蛋白質靶向的相關性。評論
