結構生物化學/獨特性質/水的相態
外觀
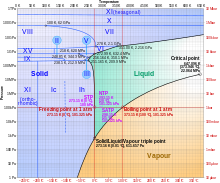
物質發生相變的溫度是一個物理性質,而不是化學性質,因為它是由於分子間鍵的斷裂和形成造成的(物質的組成不變)。為了熔化或汽化一種物質,必須輸入能量來打破這些分子間鍵(例如氫鍵或範德華力)。這意味著用於熔化或汽化的能量不會導致分子更劇烈地振動或以更高的速度移動。換句話說,在相變過程中溫度保持不變,如右圖第三個圖表所示。

請注意,汽化熱遠高於熔化熱。這是因為只有少數氫鍵需要被打破才能使冰融化。每個水分子仍然保持著 3-4 個與相鄰分子的氫鍵。另一方面,為了將液態水蒸發成水蒸氣,所有氫鍵都必須被打破。因此,需要更多的能量輸入。
H2O 可以存在於三種不同的相態:固態、液態和氣態。
如右圖相圖所示,隨著溫度的升高,狀態開始發生變化。冰開始融化的溫度是 0°C。在室溫 25°C 下,冰變成液體。最後,在 100°C 的溫度下,水開始沸騰,變成蒸汽。
ΔH 值是焓,可以用將單位質量的物質從一種相態轉變為另一種相態所需的能量/熱量來表示。每種相態都有自己的表示符號。
固相到液相的轉變焓稱為熔化熱。它衡量為了發生熔化,需要向系統輸入多少能量。反過來,從液態到固態的轉變稱為凝固,凝固熱的數值是熔化熱的負值。
液相到氣相的轉變焓稱為汽化熱。它衡量為了發生汽化,需要向系統輸入多少能量。反過來,從氣態到液態的轉變稱為凝結,凝結熱的數值是汽化熱的負值。
| H2O 的 ΔH 值 | (kJ/mol) | |
|---|---|---|
| ΔH熔化 | 6.01 kJ/mol | |
| ΔH汽化 | 40.65 kJ/mol | |
| ΔH凝固 | -6.01 kJ/mol | |
| ΔH凝結 | -40.65 kJ/mol |
