工程熱力學/應用
所有物質都可以存在三種狀態:固體,液體,和氣體。所有單組分系統都具有某些共同特徵,因此研究一個典型的單組分系統將非常有用。
在本分析中,我們考慮在恆定壓力下傳遞給物質的熱量。上圖顯示了在三個不同的恆定壓力下的溫度與比容(1/密度)曲線。上面標記為 p1、p2 和 pc 的三條線曲線是等壓線,顯示了恆定壓力下的條件。當液體和蒸汽共存時,稱為飽和狀態。當液體和蒸汽處於平衡狀態時,溫度和壓力沒有變化,因此溫度稱為飽和溫度,壓力稱為飽和壓力。飽和狀態由圖表中的水平線表示。在液體和蒸汽的純物質可以平衡共存的溫度範圍內,對於每個飽和溫度值,只有一個對應的飽和壓力值。如果液體的溫度低於飽和溫度,則稱為過冷液體。如果蒸汽或氣體的溫度高於飽和溫度,則稱為過熱蒸汽。
飽和混合物中液體和蒸汽的量由其品質 x 指定,它是混合物中蒸汽的比例。因此,表示流體汽化的水平線在其左端點(100% 液體)處具有x=0 的品質,在其右端點(100% 蒸汽)處具有x=1 的品質。前面圖中藍色曲線顯示了飽和液體的飽和溫度,即 x=0。圖中綠色曲線顯示了飽和蒸汽的飽和溫度,即 x=1。這些曲線不是等壓線。
如果您還考慮固態,那麼我們得到該物質的相圖。固態、液態和氣態平衡共存的點稱為
三相點。請注意,隨著飽和溫度的升高,液體和蒸汽的比容相互接近,直到藍色和綠色曲線相遇並在 pc 等壓線上的點 C 處相遇。在那個點 C,稱為臨界點,液體和蒸汽狀態合併在一起,它們的所有熱力學性質都變得相同。臨界點具有特定的溫度 Tc 和壓力 pc,它們取決於所討論的物質。在臨界點以上的溫度下,該物質被認為是過熱氣體。
該圖基於水的圖。其他純(單組分)物質具有相應的溫度與比容圖,形狀相當相似,但溫度、壓力和比容會不同。
物質的熱力學性質在圖表中給出。一個常用的圖表是莫利埃圖,它是焓與熵的圖。壓力焓圖經常用於製冷應用。這些圖表很有用,因為許多過程是等焓的,因此獲取值就像在圖表上畫一條直線並讀出資料一樣簡單。
蒸汽表給出了水在不同溫度下的比容、焓、熵和內能的值。它們對工程師非常有用,在蒸汽輪機、蒸汽機和空調等應用中都有應用。
氣體表給出像空氣這樣的常見氣體的相同方程。雖然大多數氣體大致遵循理想氣體方程,但氣體表記錄了實際值,在許多情況下更準確。它們不像蒸汽表那麼重要,但在許多情況下,從表格中查詢值比計算答案要容易得多。
吉布斯相律指出,對於具有C個組分和P個相的處於平衡狀態的非均相系統,自由度F = C - P + 2。因此,對於具有兩個相的單組分系統,只有一個自由度。F=1-2+2 F =1 也就是說,如果您給定溼蒸汽的壓力或溫度,您就可以獲得所有性質,而對於過熱蒸汽(只有一相),您將需要壓力和溫度。
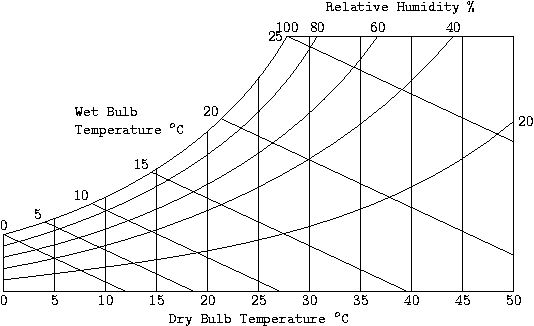
溼度學是研究空氣和水蒸汽混合物的學科,用於空調。對於此應用,空氣被認為是氮氣和氧氣的混合物,其他氣體的含量足夠少,因此可以近似為更多的氮氣和氧氣,而不會產生太多誤差。在本溼度學部分中,蒸汽指的是水蒸汽。對於正常(大氣)壓力的空氣,蒸汽的飽和壓力非常低。此外,在這些條件下,空氣距離其臨界點很遠。因此,空氣蒸汽混合物表現為理想氣體混合物。如果蒸汽的分壓小於該溫度下水的飽和壓力,則該混合物稱為不飽和。空氣蒸汽混合物中的水分含量由其溼度來量化。
絕對溼度ω 是蒸汽和空氣質量之比,即,ω = mv/ma。現在,應用理想氣體方程pV = mRT 對於水蒸汽和空氣,我們有,由於體積和溫度相同,ω = 0.622 pv/pa。水蒸汽與空氣的比氣體常數(前面方程中的 R)之比等於 0.622。
相對溼度φ 是蒸汽壓與該溫度下飽和蒸汽壓之比,即,φ = pv/pv,sat。
飽和比是絕對溼度與飽和狀態下的絕對溼度之比,即ψ = ω/ωsat。很容易看出,飽和比非常接近相對溼度的值。
上圖顯示了絕對溼度與溫度的關係。混合物的初始狀態為 1,它在等壓和恆定絕對溼度下被冷卻。當它到達 2 時,它達到飽和狀態,其絕對溼度為 ωa。進一步冷卻會導致冷凝,系統移動到點 3,其絕對溼度為 ωb。2 處的溫度稱為露點。
習慣上,將所有溼度學量按每單位質量的幹空氣表示。因此,上圖中從 2 到 3 移動時冷凝的空氣量為 ωb − ωa。
考慮一個未飽和的混合物進入一個腔室。假設向氣流中噴灑水,使溼度增加,並以飽和混合物離開。這伴隨著溫度的降低,因為從空氣中移除了用於汽化的熱量。如果供應的水處於氣流出口的溫度,則沒有熱量從水轉移到混合物。混合物的最終溫度稱為絕熱飽和溫度。
空氣蒸汽混合物的相對溼度是透過使用幹球和溼球溫度計來測量的。乾球溫度計是普通溫度計,而溼球溫度計的球體被潮溼的燈芯覆蓋。當混合物流過兩個溫度計時,乾球溫度計顯示氣流的溫度,而水從燈芯蒸發,其溫度下降。如果忽略由於對流造成的熱傳遞,則該溫度非常接近絕熱飽和溫度。
該圖給出了絕對溼度與溫度的關係,以及焓。從該圖中,您可以根據幹球和溼球溫度確定相對溼度。根據第一定律,對於沒有熱傳遞的流動系統,焓為常數。現在,對於絕熱飽和過程,沒有熱量傳遞,因此絕熱飽和線與溼球溫度和等焓線相同。
問題
1.鳳凰城的溫度為 35 °C,相對溼度為 40%。可以用傳統的空氣冷卻器冷卻房間嗎?
- 我們需要找到點T = 35°C 和 φ = 40% 的溼球溫度。從溼度圖可以看出,溼球溫度在 20 到 25°C 之間。因此,您可以使用蒸發式冷卻器將房間冷卻到舒適的溫度。
2.洛杉磯的溫度為 37 °C,相對溼度為 83%。可以用傳統的空氣冷卻器將房間冷卻到什麼溫度?
- 在這種情況下,溼球溫度約為 34.2°C。因此,在這種情況下,您不能使用普通的冷卻器來降低房間溫度。您需要使用空調。
人體只能在狹窄的條件範圍內有效地工作。此外,它不斷地向周圍環境釋放約 60 瓦的熱量,在劇烈運動時釋放更多。人體的溫度透過汗液從身體蒸發來維持。因此,為了舒適,溫度和相對溼度都應該較低。
傳統的空調包括將溼度設定在可接受的水平,同時降低溫度。將溼度降低到零不是理想的目標。例如,低溼度會導致諸如靜電積聚機會增加等問題,從而導致敏感電子裝置損壞。在這種情況下,50% 的溼度水平更可取。
最常見的降低溼度的 方法是使用基於反向卡諾迴圈工作的傳統空調來冷卻空氣。冷凝的蒸汽被去除。現在,產生的空氣非常冷,需要在釋放回空調區域之前將其加熱回室溫。
機器中使用的幾種熱力學迴圈可以用理想迴圈來近似。之前已經表明,卡諾發動機是在兩個熱庫之間執行的最有效的發動機。但是,由於實際困難,卡諾迴圈不能在所有情況下實現。以下部分將討論實踐中發現的理想化(非卡諾)系統。
在朗肯迴圈中,也稱為標準蒸汽動力迴圈,工作流體遵循一個閉合迴圈。我們將考慮水作為工作物質。也可以使用其他材料,例如有機材料(參見有機朗肯迴圈);工作流體的特性對實際過程有很大影響。在朗肯迴圈中,水使用液體泵從低壓泵送到高壓。然後在恆壓下在鍋爐中加熱此水,其溫度升高,並被轉換為過熱蒸汽。然後,這種蒸汽在膨脹機中膨脹以產生功。該膨脹機可以是渦輪機或往復式(即活塞)機器,例如較舊的蒸汽機車或船舶中使用的機器。膨脹機的輸出在冷凝器中冷卻至液態,然後送入泵。朗肯迴圈與卡諾迴圈的不同之處在於,泵的輸入是液體(它在冷凝器中冷卻更多)。由於液體的比容比蒸汽小,因此這使得可以使用小型低功率泵。此外,鍋爐中的熱傳遞主要發生在相變過程中,而不是卡諾迴圈中理想氣體的等溫加熱,因此效率相當高(儘管它仍然低於卡諾效率)。將液體加熱到沸點的熱傳遞量與相變期間的熱傳遞量相比非常小。蒸汽過熱,因此渦輪機內部不存在液態。渦輪機中的冷凝可能是災難性的,因為它會導致葉片的腐蝕和侵蝕。
朗肯迴圈有幾種改進,可以帶來更好的實際設計。在再熱迴圈中,有兩個串聯工作的膨脹機,高壓級產生的蒸汽在進入低壓膨脹機之前再次在鍋爐中加熱。這避免了渦輪機中出現水分的問題,並提高了效率。再生迴圈是朗肯迴圈的另一種改進,旨在提高效率。在許多朗肯迴圈實施中,水以過冷狀態進入鍋爐,並且,鍋爐供熱溫度與流體溫度之間的較大溫差會導致不可逆性,從而導致效率下降。在再生迴圈中,冷凝器的輸出由從膨脹機抽取的一些蒸汽加熱。由於上述原因,這會導致整體效率提高。
奧托迴圈是大多數汽車使用的往復式內燃機中發現的過程的理想化。雖然在實際發動機中,氣體以廢氣形式排出,但事實證明,這是一種分析該過程的好方法。當然,實際發動機中還有其他損失。例如,高速發動機的部分燃燒和進氣問題。理想迴圈中的工作物質是理想氣體,而不是發動機中的空氣燃料混合物。
- 熱量在 1-2 期間以恆定體積傳遞。
- 氣體在 2-3 期間可逆絕熱膨脹,在此期間完成功。
- 熱量在 3-4 期間在低溫下以恆定體積排出。
- 氣體在 4-1 期間可逆絕熱壓縮。
熱量在 1-2 期間以恆定體積傳遞,因此 Q1-2 = m cv(T2 − T1)。類似地,在 3-4 期間排出的熱量為 Q3-4 = m cv (T3 − T4)。因此,奧托迴圈的熱效率為
ηth = (Q1-2 − Q3-4)/Q1-2
ηth = 1 − Q3-4/Q1-2
ηth = 1 − (T3 − T4)/(T2 − T1)
由於 2-3 和 4-1 是涉及理想氣體的可逆絕熱過程,我們有:
T2/T3 = (V3/V2)γ − 1
以及
T4/T1 = (V1/V4)γ − 1
但是,
V1 = V2
以及
V3 = V4
因此,我們有
T2/T3 = T1/T4
所以,
ηth = 1 − (T3/T2)(1 − T4/T3)/(1 − T1/T2)
或者
ηth = 1 − T3/T2
如果我們引入壓縮比 rc = V3/V2,那麼我們有:
ηth = 1 − rc1 − γ
可以看出,增加壓縮比會提高熱效率。然而,增加壓縮比會導致峰值溫度升高,這可能會導致燃料自燃,不受控制的點火,從而導致衝擊波穿過汽缸,被稱為爆震。
柴油迴圈是壓縮點火發動機(不使用火花塞的發動機)的理想迴圈。柴油迴圈和奧托迴圈之間的區別在於熱量在恆壓下供應。
- 熱量在 1-2 中以恆定壓力可逆地供應。
- 在 2-3 中進行可逆絕熱膨脹,在此過程中進行功。
- 熱量在 3-4 中以恆定體積可逆地排出。
- 氣體在 4-1 中可逆絕熱壓縮。
在 1-2 期間,熱量以恆定壓力傳遞給系統,因此
Qin = m cp (T2 − T1)
在 3-4 期間,系統以恆定體積排出熱量
Qout = m cv (T3 − T4)
因此,柴油迴圈的效率為
ηth = (Qin − Qout)/Qin
ηth = 1 − Qout/Qin
ηth = 1 − (cv (T3 − T4))/(cp (T2 − T1))
ηth = 1 − (1/γ) (T3 − T4)/(T2 − T1)
我們將截止比定義為 rt = V2/V1,由於 1 和 2 處的壓力相等,我們有,應用理想氣體方程,T2/T1 = rt。現在,對於絕熱過程 2-3 和 4-1,我們有:
由於 V3 = V4,我們有
雙迴圈有時用於近似實際迴圈,因為發動機中熱傳遞所需的時間對於奧托迴圈而言並非為零(因此並非恆定體積)。在柴油迴圈中,由於燃燒過程的性質,熱量輸入並非在恆定壓力下發生。
燃氣輪機是旋轉內燃機。在第一階段,從外部吸入空氣,並使用壓縮機進行壓縮。然後引入燃料,混合物在燃燒室中點燃。熱氣體使用渦輪機進行膨脹,渦輪機產生功。渦輪機的輸出作為廢氣排出到外部。
理想的燃氣輪機迴圈如上所示。四個階段是
- 在 1-2 期間,熱量以恆定壓力輸入。
- 在 2-3 期間進行可逆絕熱膨脹,在此過程中進行功。
- 在 3-4 期間,熱量以恆定壓力排出。
- 在 4-1 期間進行可逆絕熱壓縮,在此過程中消耗功。
在燃氣輪機迴圈中,在過程 4-1 中消耗了大量的功,因為工作物質(氣體)具有很高的壓縮性。壓縮機需要處理大量的體積並實現較高的壓縮比。
燃氣輪機迴圈中的熱量輸入由 *Qin = m cp (T2 - T1)*給出,排出的熱量 *Qout = m cp (T3 - T4)*。因此,熱效率由下式給出:
由於絕熱過程發生在相同的壓力之間,因此溫度比相同
或者
其中 *rp* 是壓力比,是燃氣輪機迴圈的基本量。
理想製冷迴圈是卡諾迴圈的逆迴圈,作為熱泵而不是熱機執行。但是,使這種系統工作的實際操作方面存在困難。
氣體制冷迴圈用於飛機中冷卻機艙空氣。周圍空氣被壓縮,然後使用渦輪機的工作進行冷卻。渦輪機本身使用壓縮空氣的工作,使其進一步冷卻。渦輪機的輸出以及用於冷卻壓縮機輸出的空氣混合在一起併發送到機艙。
朗肯蒸氣壓縮迴圈是理想卡諾迴圈的常見替代方案。一種工作物質,例如氟利昂或 R-134a,稱為製冷劑,根據其沸點和汽化熱來選擇。蒸氣壓縮製冷系統的元件包括壓縮機、冷凝器、膨脹(或節流)閥和蒸發器。工作物質(以氣態形式)由壓縮機壓縮,其輸出在冷凝器中冷卻為液體。冷凝器的輸出在節流閥中節流到較低壓力,併發送到吸收熱量的蒸發器。來自蒸發器的氣體被送入壓縮機,完成迴圈。
標準制冷機使用節流閥而不是渦輪機來膨脹氣體,因為產生的功輸出不足以證明渦輪機的成本。這種膨脹與不可逆性相關聯,但在考慮建設成本時,它是具有成本效益的。